Вовремя поставленная прививка от столбняка может спасти жизнь
В современной медицине самым действенным способом профилактики большинства инфекционных заболеваний является вакцинация, которая помогает организму самостоятельно вырабатывать защитные антитела. Например, прививка от столбняка, поставленная вовремя, может спасти жизнь и взрослому человеку и ребенку.
Столбняк – это инфекционное заболевание с острым характером течения и преимущественным поражением нервной системы. Возбудитель столбняка – Clostridium tetani – подвижная грамположительная палочка, которая может обитать в различной среде (грунт, соленая или пресная вода). Наиболее часто ее обнаруживают в местах, где земля влажная и получает много удобрений. Палочки столбняка все время обитают в кишечнике человека или домашних животных, но они вызывают заболевание. Только попадая в грунт, палочки образуют споры, которые способны прожить в нем несколько лет. Заражение происходит посредством прямого контакта микроорганизма с поврежденным участком кожных покровов – раневой путь передачи.
Как развивается столбняк? Инкубационный период при столбняке колеблется от 5 до 14 дней. При анаэробных условиях в ране споры прорастают и выделяют экзотоксин, который по нейрогенным, гематогенным, лимфогенным путям попадает в центральную нервную систему (спинной мозг, продолговатый мозг, ретикулярная формация ствола), вызывая параличи вставочных нейронов рефлекторных дуг спинного и продолговатого мозга. Вырабатываемые в мотонейронах импульсы поступают к мышцам непрерывно, вызывая тоническое напряжение скелетных мышц. Поражается симпатическая нервная система: повышается артериальное давление, появляется тахикардия, спазм сосудов, гемолиз.
Источником инфекции столбняка являются травоядные животные, у которых вегетативная форма бактерии обитает в кишечнике, не вызывая заболевания.
Палочки в окружающую среду попадают с фекалиями таких животных. При этом наиболее часто остаются в почве. В зависимости от условий, бактерии могут оставаться в вегетативной форме с активным ростом и размножением или переходить в споры. В кишечник травоядных животных клостридии попадают с поедаемой животным травой. В летнее время или в странах с тропическим или субтропическим климатом, клостридии могут активно размножаться и развиваться в почве, если она богата органическими веществами и влагой. Заражение человека происходит раневым путем при попадании почвы или пыли с клостридиями или их спорами в рану.
В кишечник травоядных животных клостридии попадают с поедаемой животным травой. В летнее время или в странах с тропическим или субтропическим климатом, клостридии могут активно размножаться и развиваться в почве, если она богата органическими веществами и влагой. Заражение человека происходит раневым путем при попадании почвы или пыли с клостридиями или их спорами в рану.
Диагностика столбняка. Клиническая картина столбняка достаточно специфична для постановки диагноза. Исследованию на предмет выявления возбудителя могут подвергаться материалы вскрытия трупа, перевязочный и шовный материал, смывы с хирургического инструментария, пыль, почва, воздух.
Выделение возбудителя обычно возможно из места попадания инфекции (соскоб или отделяемое в месте повреждения кожи). Иногда возникает необходимость мазков из носа и слизистой глотки, влагалища и матки (при послеродовом или послеабортном столбняке). Исследуя полученный биологический материал, производят выделение столбнячного экзотоксина и биологическую пробу на мышах.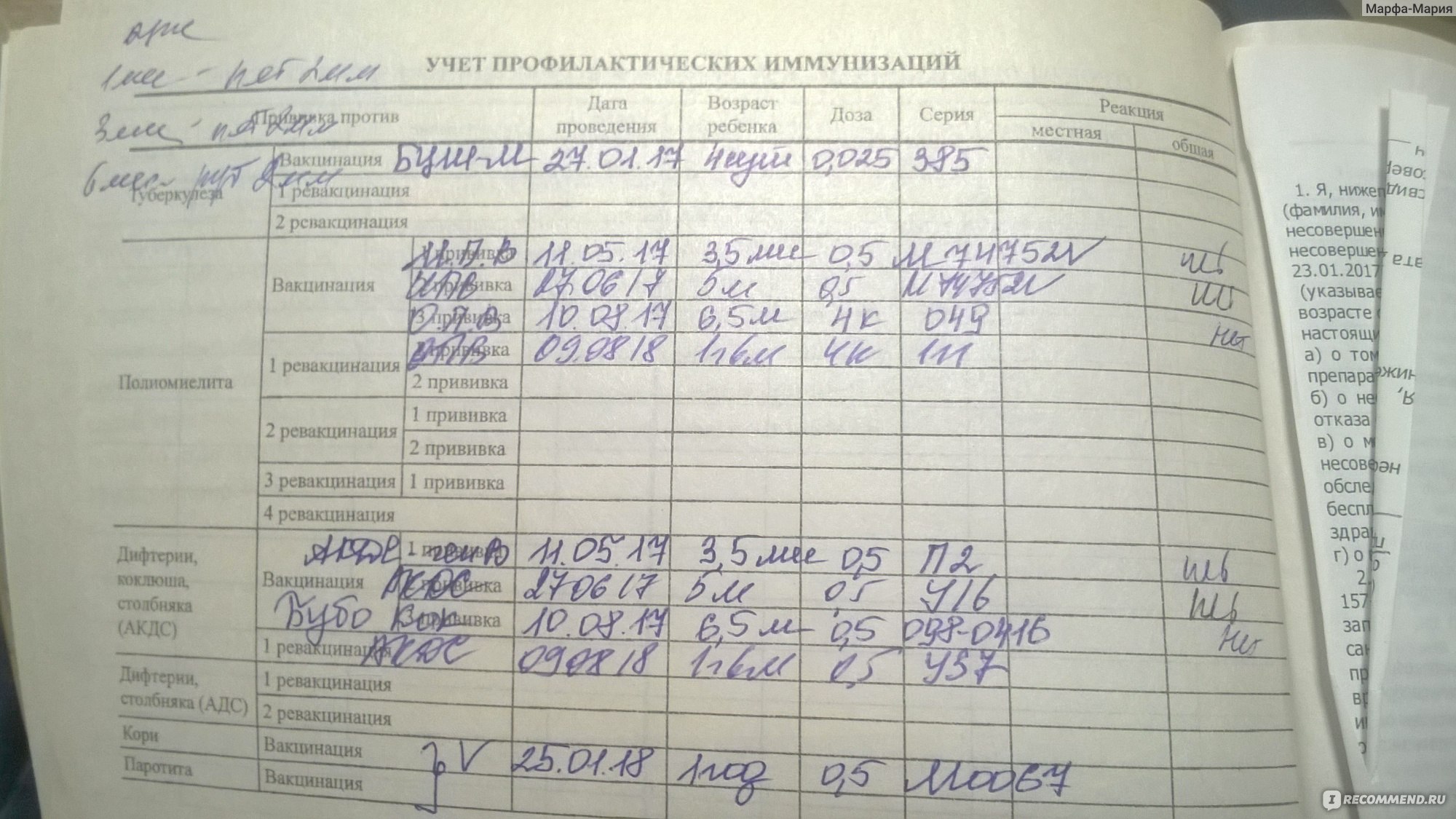
Осложнения. Тяжелыми осложнениями столбняка с высокой вероятностью летального исхода является асфиксия и остановка сердца. Кроме того, столбняк может способствовать возникновению переломов костей, разрывов мышц, компрессионной деформации позвоночного столба. Нередким осложнением столбняка является пневмония, может развиться коронарный спазм и инфаркт миокарда. Во время выздоровления иногда отмечаются контрактуры, параличи третьей, шестой и седьмой пар черепно-мозговых нервов. У новорожденных столбняк может осложниться сепсисом.
Прогноз. Прогноз столбняка зависит от формы течения, которая тем тяжелее, чем короче инкубационный период и быстрее происходит развертывание клинической симптоматики. Тяжелые и молниеносные формы столбняка характеризуются неблагоприятным прогнозом, при неоказании своевременной помощи возможен летальный исход. Легкие формы столбняка при должной терапии благополучно излечиваются.
Профилактика. Основная мера профилактики – вакцинация, которая проводится по схеме, начиная с возраста 3 месяцев, в три этапа. Вакцинация против этого заболевания входит в Национальный календарь прививок. Используют вакцину АКДС или другие, содержащие столбнячный анатоксин. Взрослым необходима ревакцинация, чтобы поддерживать иммунитет против столбняка. Ревакцинация взрослых проводится каждые десять лет.
Основная мера профилактики – вакцинация, которая проводится по схеме, начиная с возраста 3 месяцев, в три этапа. Вакцинация против этого заболевания входит в Национальный календарь прививок. Используют вакцину АКДС или другие, содержащие столбнячный анатоксин. Взрослым необходима ревакцинация, чтобы поддерживать иммунитет против столбняка. Ревакцинация взрослых проводится каждые десять лет.
Конечно, прививка – это не 100% гарантия того, что вы не заболеете, но болезнь будет протекать легко и без тяжелых осложнений. Сегодня учеными доказано, что 95% охват прививками населения, проживающего на отдельной территории, предотвращает заболеваемость столбняком.
АДС — вакцина против дифтерии и столбняка
АДС – это вакцина против дифтерии и столбняка, назначаемая детям, начиная с возраста трех лет
Как правило, для вакцинации детей против дифтерии и столбняка применяют вакцину АКДС, которая обладает еще одной активностью, а именно способностью вызывать выработку у ребенка антител, активных в отношении возбудителей коклюша.
Кому показана прививка вакциной АДС
К сожалению, некоторые дети демонстрируют на прививку АКДС слишком сильную патологическую реакцию, а потому врачи вынуждены отказываться от вакцинации АКДС. В то же самое время профилактика таких заболеваний, как столбняк и дифтерия, является жизненной необходимостью. Чтобы защитить чувствительных и ослабленных детей от этих страшных инфекций и была разработана вакцина АДС, лишенная самого тяжелого компонента вакцины АКДС – взвеси инактивированных палочек коклюша.
Помимо ослабленных и чувствительных детей прививку АДС назначают:
- для ревакцинаций детей старшего возраста, подростков и взрослых;
- для вакцинации детей от шести лет, у которых до этого возраста имелся строгий отвод от прививок против столбняка и дифтерии;
- для вакцинации ранее не иммунизированных взрослых.
На сегодняшний день существует несколько схем вакцинаций препаратом АДС, которые достаточно сильно отличаются друг от друга в зависимости от того, для людей какого возраста применяется вакцина.
Абсолютных противопоказаний для
Запись на прием к врачу педиатру
Для уточнения подробностей, пройдите консультацию квалифицированного специалиста в клинике «Семейная».
Чтобы уточнить цены на прием врача педиатра или другие вопросы пройдите по ссылке ниже:
Вакцинация и иммунопрофилактика
Вакцинация — это самое эффективное и экономически выгодное средство защиты против инфекционных болезней, известное современной медицине.
Вакцинация — это введение в организм человека ослабленный или убитый болезнетворный агент для того, чтобы стимулировать выработку антител для борьбы с возбудителем заболевания.
Среди микроорганизмов, против которых успешно борются при помощи прививок, могут быть вирусы (например возбудители кори, краснухи, свинки, полиомиелита, гепатита А и В и др.
Чем больше людей имеют иммунитет к той или иной болезни, тем меньше вероятность у остальных (неиммунных) заболеть, тем меньше вероятность возникновения эпидемии.
Выработка специфического иммунитета до защитного уровня может быть достигнута при однократной вакцинации (корь, паротит, туберкулез) или при многократной (полиомиелит, АКДС).
Ревакцинация (повторное введение вакцины) направлена на поддержание иммунитета, выработанного предыдущими вакцинациями.
АКДС, АДС и АДС-м вакцины
АКДС вакцина защищает против дифтерии, столбняка и коклюша.Содержит инактивированные токсины дифтерийных и столбнячных микробов, а также убитые коклюшные бактерии.
АДС-м — вакцина против дифтерии и столбняка, с уменьшенным содержанием дифтерийного анатоксина.

Дифтерия. Инфекционное заболевание, при котором нередко возникает сильная интоксикация организма, воспаление горла и дыхательных путей. Кроме того, дифтерия чревата серьезными осложнениями — отеком горла и нарушением дыхания, поражением сердца и почек. Дифтерия нередко заканчивается смертью. Широкое использование АКДС вакцины в послевоенные годы во многих странах практически свело на нет случаи дифтерии и столбняка и заметно уменьшило число случаев коклюша. Однако, в первой половине 90-х годов в России возникла эпидемия дифтерии, причиной которой был недостаточный охват привиками детей и взрослых. Тысячи людей погибли от заболевания, которое можно было предотвратить при помощи вакцинации.
Столбняк. При этом заболевании возникает поражение нервной системы, вызванное токсинами бактерий, попадающих в рану с грязью. Столбняком можно заразиться в любом возрасте, поэтому очень важно поддерживать иммунитет регулярными (через каждые 10 лет) прививками от этого заболевания.
Коклюш. При коклюше поражается дыхательная система. Характерным признаком заболевания является спазматический «лающий» кашель. Осложнения чаще всего возникают у детей первого года жизни. Наиболее частой причиной смерти является присоединившаяся вторичная бактериальная пневмония (воспаление легких). Пневмония возникает у 15% детей, заразившихся в возрасте до 6 месяцев.
Вакцина АКДС вводится внутримышечно в ягодицу или переднюю поверхность бедра.
Вакцинация АКДС является обязательным условием при устройстве ребенка в детский сад.
После проведения вакцинации и ревакцинации согласно календарю прививок проводятся ревакцинации взрослым каждые 10 лет вакциной АДС-М.
Вакцина против полиомиелита
Полиомиелит – в прошлом широко распространенная кишечная вирусная инфекция, грозным осложнением которой были параличи, превращающие детей в инвалидов. Появление вакцин против полиомиелита позволило успешно бороться с этой инфекцией. У более чем 90% детей после вакцинации вырабатывается защитный иммунитет.
У более чем 90% детей после вакцинации вырабатывается защитный иммунитет.
Вакцинация против полиомиелита является обязательным условием при устройстве ребенка в детский сад. Проводится согласно календарю прививок. Ревакцинация взрослого человека рекомендуется в случае, если он выезжают в опасные по полиомиелиту районы. Взрослых людей, не получивших вакцинацию в детстве и не защищенных против полиомиелита, рекомендуется прививать.
Вакцина против туберкулеза
Туберкулез — инфекция поражающая преимущественно легкие, но процесс может затрагивать любые органы и системы организма. Возбудитель туберкулеза — микобактерия Коха — очень устойчива к применяемому лечению.
Для профилактики туберкулеза применяют БЦЖ вакцину. Она представляет собой живые, ослабленные микобактерии туберкулеза. Вакцинация проводится обычно в родильном доме.
Вводится внутрикожно в верхнюю часть левого плеча. После введения вакцины образуется небольшое уплотнение, которое может нагноится и постепенно, после заживления, образуется рубчик (как правило весь процесс длится от 2-3 месяцев и дольше).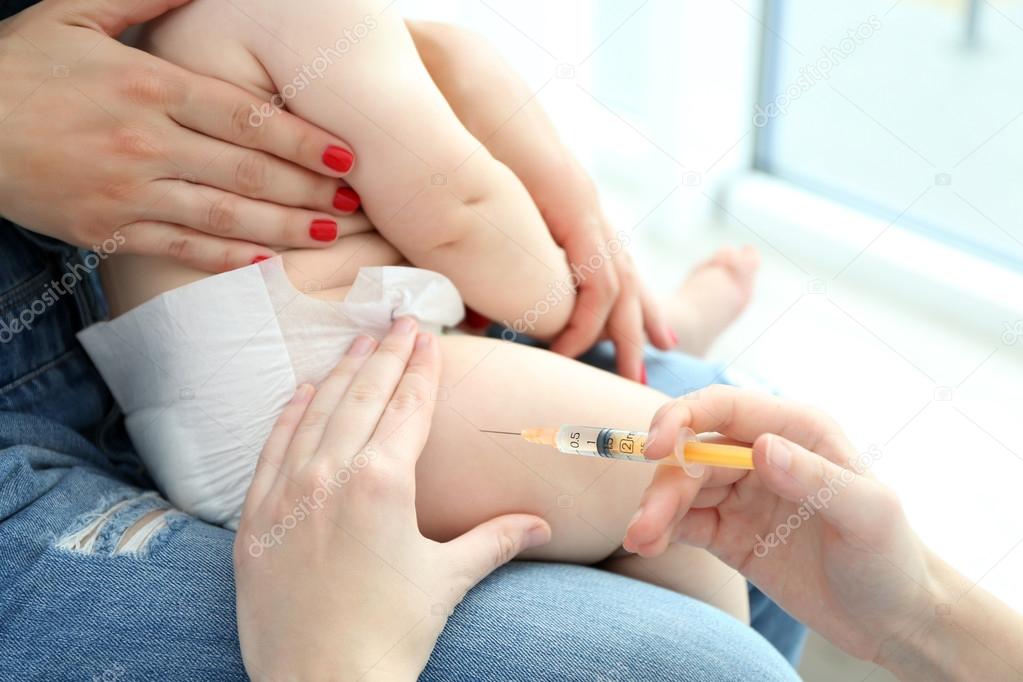 Для оценки приобретенного иммунитета, в дальнейшем, ребенку ежегодно проводится туберкулиновая проба (реакция Манту).
Для оценки приобретенного иммунитета, в дальнейшем, ребенку ежегодно проводится туберкулиновая проба (реакция Манту).
Вакцина против кори
Корь — вирусное заболевание, чрезвычайно заразное. При контакте с больным корью заболевают 98% непривитых или не имеющих иммунитета людей.
Вакцина готовится из живых ослабленных вирусов кори. Вакцина вводится подкожно под лопатку или в области плеча. Вакцинация против кори является обязательным условием при устройстве ребенка в детский сад. Вакцинация и ревакцинация проводится согласно календарю прививок
Вакцина против паротита (свинки)
Паротит — вирусное заболевание, поражающее преимущественно слюнные железы, поджелудочную железу, яички. Может быть причиной мужского бесплодия и осложнений (панкреатит, менингит). Иммунитет после однократной вакцинации, как правило, пожизненный. Вакцина готовится из живых ослабленных вирусов паротита. Вводится подкожно, под лопатку или в плечо.
Вакцина против гепатита B
Гепатит B — вирусное заболевание, поражающее печень. Опасным последствием этой болезни является ее затяжное течение с переходом в хронический гепатит, цирроз и рак печени. Заболевание передается половым путем и через контакт с кровью больного или носителя вируса гепатита В. Для заражения достаточно контакта с ничтожным количеством крови. Вакцина против гепатита В готовится генно-инженерными методами. Вводится внутримышечно в бедро или плечо.
Иммунизируются новорожденные, дети первого года жизни и взрослые из групп риска (медицинские работники, пациенты на гемодиализе или получающие в больших количествах препараты крови, лица поживающие в районах с высоким уровнем хронического носительства вируса гепатита В, наркоманы, гомосексуалисты, здоровые лица, имеющие в качестве полового партнера носителя HBs антигена, любые сексуально активные люди, имеющие большое число половых партнеров, индивидуумы с длительным сроком заключения в тюрьмах, пациенты учреждений для лиц с отставанием в развитии).
Отводы от прививок
Нередко принимаются решения о невозможности вакцинации детей с ослабленным здоровьем. Однако по рекомендации Всемирной Организации Здравоохранения именно ослабленные дети должны прививаться в первую очередь, так как они наиболее тяжело болеют инфекциями. В последнее время перечень заболеваний, считавшихся противопоказаниями для вакцинации, существенно сужен.
Абсолютными противопоказаниями для прививки являются: тяжелая реакция на предшествующее введение данного препарата, злокачественное заболевание, СПИД.
Временными противопоказаниями для прививок всеми вакцинами служат острые лихорадочные заболевания в периоде разгара или обострение хронических болезней. Плановая вакцинация откладывается до окончания острых проявлений заболевания и обострения хронических заболеваний. При нетяжелых ОРЗ, острых кишечных заболеваниях и др. прививки проводятся сразу же после нормализации температуры тела.
Анализы вместо прививок: когда это возможно
О пользе и вреде прививок в последние десятилетия ведутся серьезные споры. На самом же деле антипрививочное движение существует еще со времен изобретения вакцины от оспы, и тогда главным аргументом «оппозиции» была религия. Сегодня ей на смену пришли осложнения, «ложная» статистика и даже заговор фармацевтов. Так есть ли реальные основания для опасений? И когда прививка действительно противопоказана?
На самом же деле антипрививочное движение существует еще со времен изобретения вакцины от оспы, и тогда главным аргументом «оппозиции» была религия. Сегодня ей на смену пришли осложнения, «ложная» статистика и даже заговор фармацевтов. Так есть ли реальные основания для опасений? И когда прививка действительно противопоказана?
Немного истории
Впервые слово «вакцинация» мир услышал еще на рубеже 19 столетия.
Тогда вирус натуральной оспы ежегодно «выкашивал» до полумиллиона человек, а выжившие оставались на всю жизнь отмечены шрамами. Врачи годами пытались найти спасительное средство от заразы, но точку в этой «войне» помогла поставить случайность.
Английский врач Эдвард Дженнер однажды стал свидетелем любопытного разговора об оспе. Доярка уверяла, что не может заразиться черной оспой, так как переболела коровьей. И о том, что ее землякам это давно известно.
Дженнер решил проверить это заявление на практике и заразил коровьей оспой 8-летнего мальчика. Ребенок не только остался жив, но и действительно стал не восприимчив к оспе, несмотря на многочисленные попытки его заражения.
Ребенок не только остался жив, но и действительно стал не восприимчив к оспе, несмотря на многочисленные попытки его заражения.
Так появилась самая первая в истории человечества вакцина, а одна из особо опасных инфекций начала терять силу.
Но это не вся история.
С «рождением» вакцинации, появились и ее противники. Представители духовенства и врачи требовали прекратить вводить людям вакцину, утверждая, что та может сделать их «быкоподобными». А когда стало очевидным, что в быков никто не превратился, в ход пошла недопустимость вмешательства в вопросы жизни и смерти.
Впоследствии вакцинацию приняли на законодательном уровне, а вместе с тем и ее противники объединились в организации.
В середине 19 века им даже удалось добиться отмены «прививочного» закона, вслед за чем смертность от оспы резко подскочила.
Больше этот закон никто не отменял, но антипрививочное движение существовать не перестало до сих пор.
Современные аргументы
Сегодня движение против прививок апеллирует фактами, правда взятыми из истории или единичных случаев.
Так, мнение о низком качестве вакцин впервые появилось еще в 1955 году, когда еще не было строгого регламента разработки таких препаратов, и в применение действительно вышла недоработанная вакцина от полиомиелита.
Итог этой истории стал величайшей драмой, ведь из 200 тысяч привитых, 40 — оказались парализованы. Вакцина была изъята из производства, а создание новых замерло на много лет.
Однако полиомиелит продолжал калечить жизни сотен тысяч людей, среди которых были в основном дети. Поэтому создание безопасного препарата все-таки состоялось, но и здесь «оппозиция» нашла аргументы.
В особо редких случаях вакцины и сегодня вызывают осложнения. Как, например, поражение нервной системы после введения «живой» вакцины от полиомиелита (в виде капель). Сейчас применяется для первого введения «убитая» (инактивированная) вакцина от полиомиелита, вводимая инъекционно и неспособная в принципе привести к заболеванию.
Случаи осложнений вакцинации действительно имеют место, поскольку индивидуальные реакции некоторых людей выходят за рамки предсказуемых. Правда частота таких осложнений не может конкурировать с пользой по сдерживанию калечащих эпидемий.
Так, осложнения все то же полиомиелитной вакцины наблюдают в 1-3 случаях на 1 млн введений. Абсцесс от введения АДС-М возникает у 6-10 привитых. А частота энцефалита из-за противокоревого препарата не превышает 1 случая.
В то же время без массовой иммунизации, например, в странах третьего мира, эти инфекции по-прежнему уничтожают и инвалидизируют население. А статистика такой заболеваемости всегда открыта на портале ВОЗ.
Вакцины и аутизм
В конце ХХ века, британский ученый Эндрю Вейкфилд опубликовал громкую статью о связи вакцины MMR (корь, паротит, краснуха) с аутизмом.
Работа мгновенно получила широкую известность и стала новым аргументом против прививок.
Позднее правда статья была отозвана, поскольку содержала значимые статистические ошибки. Но до «ушей» общественности эта новость так и не дошла. И связью аутизма с прививками до сих пор «пугают» антипрививочные статьи.
Когда и правда «нельзя»
Разумеется, вакцины, как и любой препарат, имеют противопоказания.
К общим из них относятся:
- острые воспалительные процессы,
- обострение хронических заболеваний,
- период восстановления,
- иммунодепрессивные состояния
- и онкология.
Среди специфических:
- эпизоды фебрильных судорог в анамнезе и прогрессирующие патологии нервной системы – для АКДС;
- тяжелая аллергия на белок куриного яйца – для вакцин от кори, паротита и гриппа;
- аллергия на пекарские дрожжи – для препаратов от гепатита В
- и некоторые другие.
Каждое из противопоказаний прописано в инструкции к препарату и доступно к просмотру любым желающим.
Такие случаи являются обоснованием для медицинского отвода от вакцинации, который может носить как временный, так и пожизненный характер.
Анализы вместо прививок
Использовать анализ крови на антитела вместо очередной прививки можно в случае, если данные о прививках утеряны, или пациент уверен, что уже перенес инфекцию ранее.
Оценить степень защиты от заражения позволяет концентрация IgG в крови к конкретному возбудителю.
Проверить таким образом можно иммунитет к:
Но чаще всего «прения» вызывает Манту.
Официально признанной замены реакции считается только Диаскин-тест. Однако, по договоренности с детским учреждением, можно сдать анализ крови T-SPOT или квантифероновый тест.
Таким образом, прививаться или протестовать – личное решение каждого, однако до его принятия стоит тщательно взвесить все обоснованные «за» и «против».
20 вопросов о вакцинации, которые родители задают чаще всего
В России существует национальный календарь прививок — это принятая схема вакцинации для защиты от наиболее распространенных инфекций, которые могут крайне тяжело протекать у маленьких детей. Нельзя сказать, что это жесткий документ — согласно законодательству, у родителей есть выбор: они могут прививать ребенка, а могут отказаться от прививок, взяв на себя ответственность за это.
Прививки, которые входят в национальный календарь: БЦЖ (вакцина против туберкулеза), вакцина против гепатита В, пневмококка, полиомиелита, кори, паротита и краснухи, АКДС (вакцина против дифтерии, столбняка и коклюша), а также ежегодная прививка против гриппа. Прививка от гемофильной инфекции включена в нацкалендарь для групп риска, но это не значит, что она не нужна любому здоровому ребенку, просто государство готово оплатить ее только детям с проблемами со здоровьем.
Дополнительные прививки, которые можно сделать по желанию (и за отдельную плату) — это, например, вакцины против ветряной оспы, ротавирусной инфекции, клещевого энцефалита, гепатита А, менингококковой инфекции.
Любая прививка не приводит к абсолютной защите от инфекции. Привитый ребенок может перенести инфекцию в более легкой форме, без осложнений. Никто не гарантирует, что он никогда не заболеет, все зависит от эффективности работы иммунной системы: у одних антитела сохраняются очень долго, а у других быстро теряются. Тем не менее большинство вакцин способствуют формированию иммунных клеток памяти, которые приводят к адекватному ответу организма. При повторной встрече с микробом они начинают быстро работать и хорошо отвечать на контакт.
К сожалению, никто не застрахован от тяжелого течения болезни с осложнением. Пожалуйста, взвесьте: вам нужно серьезное течение с осложнением или теоретическая возможность легкого течения? Получается, что это личностный выбор каждого родителя: «Только я могу решить, что хочу делать ребенку, а что нет». Это неправильно, и в некоторых государствах сейчас принята другая тактика: ребенку рекомендовано в определенный срок явиться на вакцинацию — медсестра измеряет ему температуру и делает прививку (врач даже не касается этого вопроса).
У нас несколько другой подход: чтобы допустить к вакцинации, иногда необходимо просмотреть определенное количество анализов (так как некоторые родители проводят лабораторное обследование без рекомендаций врача), осмотреть ребенка, померить температуру и только потом допускать к вакцинации.
Я делюсь своими знаниями о прививках, мировым опытом, научными данными, плюсами вакцинации, а право принимать решение оставляю за ними. Заставлять их и говорить: «Вы делаете неправильно», — это не дает никакого эффекта. В принципе, большинство родителей все же приходят на вакцинацию, даже те, дети которых имеют серьезные проблемы со здоровьем.
До приема родителям следует изучить информацию о заболевании, от которого они планируют прививать ребенка, и выяснить, каковы могут быть последствия этой болезни: полистать картинки в интернете, послушать, к примеру, как кашляет не привитый от коклюша пациент. Взвесить все: нужны ли такие последствия или все-таки планово проводить профилактику этих инфекций.
Нет. Не существует документов, регламентирующих сдачу анализов перед каждой прививкой. Сдавать анализы необходимо только определенным группам пациентов, у которых есть проблемы со стороны крови. Главное перед вакцинацией — соматическое здоровье в течение двух недель как минимум, отсутствие заболевших в окружении и желание привиться. Если пациент болел какой-то тяжелой инфекцией: бронхитом, пневмонией, долго лечился антибиотиками, то интервал должен составлять месяц. А после банальной ОРВИ не затяжного характера (даже с температурой 39) достаточно двух недель.
Перед прививкой нет необходимости в назначении антигистаминных препаратов. В некотором случае они назначаются для аллергиков, но и этот опыт сохраняется пока только у нас. Врачи в большинстве европейских стран даже при вакцинации аллергиков не назначают плановый прием антигистаминных препаратов.
К нормальным вакцинальным реакциям, которые могут возникнуть примерно у 10 % детей, относятся: высокая температура, местные проявления (краснота, припухлость, отечность). Например, после прививки от кори, краснухи, паротита с четвертого по 15-й день может появиться коре- и краснушеподобная сыпь, увеличение слюнных желез, легкие катаральные проявления — кашель, першение в горле, небольшой насморк. Все это кратковременно, чаще всего не сопровождается интоксикацией, ребенок достаточно хорошо себя чувствует, температура снижается после жаропонижающих.
Отек больше восьми сантиметров на месте вакцинации считается патологической аллергической местной реакцией на вакцину: у шестимесячного ребенка он занимает почти все бедро. Бывают общие аллергические реакции в виде сыпи, но это возникает крайне редко и тоже требует определенных действий со стороны врачей: не всегда родители вспоминают, что ребенок в день прививки ходил на день рождения и там впервые попробовал, например, соломку в шоколаде, покрытую кунжутом.
Любые состояния, которые возникают после прививки, требуют расследования: доктор должен определить, связано это с введенной вакциной или нет. И в большинстве случаев это не связано. Наш опыт показывает, что дети, которые едут к нам с диагнозом патологической реакции на прививку, в 90 % случаев имеют какие-то заболевания: ОРВИ, острые кишечные инфекции, впервые выявленные проблемы со стороны почек.
Если реакции после введения вакцины нет, это не значит, что антитела не вырабатываются: все зависит от особенностей иммунной системы человека. Кто-то даже на мягкие вакцины реагирует повышением температуры, а кто-то бессимптомно переносит любую вакцинацию.
Самая тяжелая реакция на прививку во всем мире — анафилактический шок, это острая аллергическая реакция на компоненты вакцины. Такая острая аллергическая реакция происходит в первые 30 минут после введения вакцины, максимально — в течение двух часов. Поэтому как минимум первые 30 минут любой привитый должен находиться в учреждении и сидеть рядом с кабинетом, где проводилась вакцинация. В каждом прививочном кабинете есть укладка для оказания первой помощи, в том числе при анафилактическом шоке.
Анафилактический шок на вакцины — крайне редкая ситуация, один случай на 100 тысяч используемых доз. Он бывает не только от вакцин, провокатором может стать все что угодно: конфета, лекарства, клубника, сосиски, яйца — можно съесть выпечку, в которых содержится яйцо и «выдать» анафилактический шок. Мы от этого не застрахованы.
Аутизм, ДЦП, органические поражения центральной нервной системы не связаны с вакцинацией. У нас есть огромное количество пациентов с органическим поражением ЦНС и ДЦП, и они не привиты.
Доказано, что микродобавки, которые содержатся в вакцинах, не оказывают никакого воздействия на организм привитого. То, что ребенок получает при массовой вакцинации из дополнительных веществ, — малая толика того, что мы получаем в жизни. Если говорить о гидроксиде алюминия, то он содержится в воздухе в больших городах с фабриками и заводами: родители не думают, что каждый день, ведя на прогулку своего маленького ребенка, они вдыхают этот воздух. Или, например, в морской рыбе, которую мы с удовольствием едим, огромное количество ртути — в частности, в тунце, который очень распространен в европейских странах.
Сколько угодно. Они делаются на расстоянии два-три сантиметра друг от друга, в бедро или в плечо. Антигенная нагрузка несколько увеличивается, но она не так высока. В вакцине АКДС отечественного производства три тысячи антигенов. В современных многокомпонентных вакцинах (например, «Пентаксиме») — около 25–27. Это в разы меньше, чем в АКДС, которую ребенок в три месяца воспринимает совершенно адекватно.
Да, живую и «убитую» вакцины можно ставить в один день, только наблюдение в поствакцинальном периоде в таком случае будет длиннее: на инактивированные вакцины реакция может быть в первые три дня, на живые — с четвертого по 15-й день. Поэтому за температурой надо будет следить несколько дольше.
Единственное, нельзя ни с чем совмещать прививку БЦЖ, ее всегда делают отдельно.
У ВОЗ есть программа о переходе на полное использование инактивированных вакцин против полиомиелита. Живую вакцину хотят отменить, чтобы прекратить циркуляцию полиовируса вакцинного штамма, так как в живой вакцине содержится ослабленный полиовирус. Привитые этой вакциной в течение двух месяцев с фекалиями выделяют полиовирус и могут быть источником инфекции.
Реализация этой программы, по крайней мере, в России, пока довольно сложна: нам не хватает доз, чтобы прививать все население. Сейчас у нас действует схема сочетанного использования: две инактивированные вакцины, третья и последующие — живые. Первые два введения полностью защищают от паралитических форм полиомиелита и по нацкалендарю предоставляются бесплатно. Если родители хотят, то могут дальше прививать ребенка инактивированной вакциной, а не живой. Эффективность такой схемы высока.
Отечественная вакцина содержит цельноклеточный коклюшный компонент и считается вакциной, после которой с большей частотой возникает температура. «Пентаксим» же содержит бесклеточный коклюшный компонент, он более мягкий, помимо этого, защищает сразу от пяти инфекций. От шести инфекций защищает «Инфанрикс Гекса». В силу того, что у иностранных вакцин другой состав по коклюшному компоненту, у них несколько ниже эффективность. Если у АКДС это пять-семь лет эффективной защиты от коклюша, то, например, у «Инфанрикс Гекса» — четыре-шесть лет.
Нет, нельзя! Дело в том, что от разных инфекций нужно разное количество вакцинаций. Если мы говорим о профилактике коклюша, то для длительной защиты нужно четыре прививки. После первой через пару недель выработаются антитела, но они могут сохраняться недолго, поэтому требуется дополнительное введение. Что касается дифтерии и столбняка, то достаточно двух прививок с ревакцинацией через год — это дает хорошую защиту. Для длительной защиты от полиомиелита необходимо четыре прививки. Так что нельзя сказать, что после одного введения защита не будет выработана, но она будет кратковременной.
Никаких ограничений по последовательности введения вакцин нет (если у пациента нет противопоказаний): можно начинать с вакцины, которая наиболее актуальна на сегодняшний день.
Да, до сих пор 90 % детей, болеющих ветряной оспой, переносят ее довольно гладко. Но ветрянка опасна бактериальными осложнениями, которые могут возникнуть: сильный зуд приводит к расчесыванию, инфицированию, и такая ситуация может требовать назначения антибактериальной терапии.
Одним из серьезных осложнений ветряной оспы является ветряночный энцефалит. Наиболее часто он встречается у детей девяти-десяти лет, тех, кто не переболел в раннем детстве. Когда дети заканчивают детский сад, идут в школу, родители прекрасно понимают, что с возрастом возможность более тяжелого течения ветряной оспы возрастает, и решают вакцинировать детей.
К сожалению, пока вакцина от ветряной оспы не введена в нацкалендарь и не будет проводиться массовой вакцинации детей, мы будем видеть сезонные вспышки этой болезни.
В России привитость населения составляет более 95–98 %, но как только этот процент будет снижаться, мы можем увидеть вспышки любых заболеваний. Недавний пример — эпидемия кори в Европе и на Украине. Сейчас у нас ограниченные случаи заболевания, они не дают большого распространения, но тем не менее корью болеют взрослые и дети. Большая часть пациентов не имели прививок, а некоторые из них утеряли защиту.
В 90-х годах произошла последняя вспышка дифтерии: была перестройка, многие отказывались от вакцинации. В нашем институте были перепрофилированы многие отделения для борьбы с дифтерией. К сожалению, дети погибали. Те доктора, которые работали тогда, рассказывали: вечером пациент поступил, вводят сыворотку, а к утру приходишь — а его нет. После этого таких больших вспышек, слава богу, не было.
Обложка: Sherry Young — stock.adobe.com
«Вся правда о прививках» или чего на самом деле стоит бояться родителям, отказывающимся от вакцинации? (+видео!)
— Начиная читать «Откровения о прививках от педиатра-невролога, которая работала врачом педиатром в детском саду и прививала детей», я ожидал увидеть трагические истории с детьми, которых прививал сам автор – доктор Емельянова, и у которых развились тяжелые последствия. Ничего похожего я не прочел – ни одного конкретного случая автор не приводит, разве что случай ребенка, умершего через 3 дня после прививки. Как врач, она должна была бы рассказать, к какому заключению о причинах смерти в конце концов пришла комиссия. Ведь все случаи побочных явлений после прививок тщательно рассматриваются комиссионно, так что ни один из них не остается не расследованным – особенно в наше время, когда противники вакцинации ищут любого повода очернить прививки.
Так вот, внезапная смерть младенцев – это устоявшийся диагноз. В возрасте 2-4 месяцев жизни внезапно умирают дети, как получившие, так, чаще не получившие прививку. Педиатр, тем более со стажем, должен знать, что внезапная смерть младенцев – это вторая по частоте причина постнеонатальной младенческой смертности. А также и то, что из известных причин на первом месте стоят курение родителей, сон младенца на животе, сон в одной постели с матерью. Вот об этом стоит предупредить родителей. А от введения АКДС умереть просто невозможно, за 3 дня эта инактивированная вакцина даже еще не начнет действовать на иммунную систему.
— Помимо голословности заявлений, отсутствия фактов, какие особенности материала Вы бы еще отметили?
Это некомпетентность. Автор не пишет, где и сколько она училась на невропатолога, после того как прекратила работать в детском саду. Не думаю, что подготовка была серьезной. Она, например, указывает: «Известно, что скрытая или явная патология нервной системы после вакцинации может манифестировать в виде судорожной готовности. То есть, вакцинация может провоцировать эпилепсию (описанное осложнение на вакцинацию)».
Я напомню, что эпилептический припадок у больного эпилепсией гораздо чаще вызывает мелькание экрана телевизора, чем болевые ощущения, связанные с прививкой. Может запретить телевизор? Да, у небольшой части детей повышение температуры после введения вакцины может вызвать фебрильные судороги. Но ведь и они у 99 детей из 100 бывают при развитии инфекции. К тому же, врач-невропатолог должен не распалять родителей по этому поводу, а объяснить, что фебрильные судороги доброкачественные и ничем ребенку не грозят.
Также автор указывает: «Однажды на консультации был особенно тяжелый ребенок, угрожаемый по ДЦП (на самом деле-то уже с ДЦП, но такой диагноз ему поставят после года), я запретила делать ему вакцинацию, потому что на ее фоне ДЦП резко прогрессирует».
Это ее утверждение выглядит совсем дико — ДЦП – врожденное заболевание, ребенок рождается с теми или иными повреждениями, которые могут позже проявиться двигательными или иными расстройствами по мере роста ребенка (например, неспособность сидеть до 6-8 месяцев выявить нельзя, как и неспособность ходить до возраста 1 года), но никак не прогрессировать.
Противники вакцинации чаще всего связывают с прививкой поражения нервной системы. Я хотел бы предложить автору покопаться в книгах по неврологии и найти там – среди причин нервных болезней – прививки, и рассказать родителям, какие это болезни. Да, еще 10 лет назад у детей с врожденным иммунодефицитом живая полиомиелитная вакцина вызывала параличи (5-8 детей в год на всю Россию) – но сейчас прививают инактивированной вакциной, так что эти осложнения исчезли.
Что касается причитаний о том, что прививка «является серьезной иммунобиологической операцией», это говорилось задолго до г. Онищенко; думаю, доктор Емельянова согласится со мной, что, например, употребление в пищу многих продуктов, вызывающих аллергию, — гораздо более частая, чем прививки и более «серьезная иммунобиологическая операция», поскольку вызывает подчас тяжелые поражения, вплоть до анафилактического шока, с летальным исходом. Вот бы ей разъяснить родителям, какие виды пищи лучше не давать маленькому ребенку.
— А как Вы могли бы прокомментировать такое утверждение: «все современные вакцинирующие препараты получают методами биотехнологии с использованием сывороток и клеток животных. У животных, как становится известно нам чем дальше, тем больше, есть чрезвычайно опасные для человека инфекции типа прионных и ретровирусных. Очистить вакцину от примесей, потенциально содержащих эти инфекции, принципиально невозможно?
Действительно, есть опасения передачи ретровирусов и прионов через вакцины – это, конечно проблема, но с ней пока что успешно справляются изготовители вакцин. Фактов подобных заболеваний не могут привести даже ярые противники вакцинации.
— Действительно ли вакцины могут спровоцировать серьезные аутоиммунные заболевания?
Причина их вообще не совсем ясна, так что их легко нарочно привязать к теме прививок. Но и это не получается – в ряде стран подсчитана частота этих болезней до проведения прививок (например, против папилломавирусной инфекции) и после – цифры сходятся, указывая на непричастность вакцин к их развитию. Вообще, противники вакцинации любят ссылаться на отдельные случаи, обычно недостаточно обследованные, и не приводят цифры. А они интересны.
Так, в 80-е годы пошел вниз охват прививками АКДС – и с 90-х годов в странах бывшего СССР разразилась эпидемия дифтерии – 120 000 случаев при 6000 умерших. Плюс к этому рост коклюша и кори. Тогда Минздрав спросил инфекционистов – что делать? Единственный выход – массовые прививки – и привиты были все 150 000 000 россиян, некоторые повторно. И, знаете, каких-то особых неприятностей это не принесло. И после 1995 г. массовые прививки детей от полиомиелита погасили вспышку, привили всех, так что при заносе этой инфекции в 2010 г. из Таджикистана в России заболели полиомиелитом всего 8 детей – и все не привитые (6 из них с фиктивными справками о прививках).
А кто болеет корью в наше время? Дети, чьи родители слушают «всю правду о прививках». И с коклюшем мы пока справиться как следует не можем из-за большого числа отказавшихся от прививок. Зайдите в нашу клинику, поговорите с родителями не привитого ребенка с коклюшем – а это 15-20 приступов кашля в день со рвотой, и так в течение 3-4 недель. Из-за низкого охвата заражаются дети первых месяцев, еще не привитые – они болеют очень тяжело, и нередко дело кончается летальным исходом.
Мой совет докторам, устроившим антипрививочную пропаганду, повернитесь лицом к действительным проблемам и не дурите голову 20 миллионам родителей в России, прививающих детей от всех инфекций. Ведь предсказывали люди вашего круга в конце 18 века, что прививки Дженнера против оспы приведут к появлению рогов и вымени у привитых. Сейчас эти страсти Вы заменили на аутоиммунные болезни, диабет, рак. Уже много поколений человечества выросло с прививками (уверен, и авторы статей против прививок), прививки не только не мешали, но и способствовали, как никакие другие меры медицинского характера, улучшению показателей физического развития человека, его способностей, снижению смертности и увеличению продолжительности жизни – и в дальнейшем они будут способствовать укреплению здоровья, нравится это противникам прививок или нет.
Я, например, сделал всем своим детям, внукам и правнукам все необходимые прививки, и сам ежегодно прививаюсь от гриппа.
Подготовлено по материалам портала:
Использованы иллюстрации комикса Maki Naro.
Переводчик: irvitzer.
Дифтерии и столняка |
Вакцинация против дифтерии
Дифтерия – это опасное инфекционное заболевание, которое вызывается микроорганизмом рода коринебактерии (бацилла Лёффлера).
Заболевание передается преимущественно воздушно-капельным путем и поражает органы дыхательной системы, кожу, глаза, нервную и даже половую систему. Повышение температуры, боль в горле, слабость, отек тканей шеи, увеличение многих групп лимфоузлов и появление налета на миндалинах в виде пленок – далеко не все прелести дифтерии.
Столбняк – патология крайне тяжело поддается терапии, вакцинация считается оптимальным методом для борьбы с ней. Когда делают прививку от столбняка? С 14-16 лет вакцинация против болезни каждые 10 лет. Ограничений по возрасту нет, что связано с ростом продолжительности жизни и широким распространением болезни. При нарушении графика иммунизации или при возникновении экстренной ситуации могут делать внеочередную прививку от столбняка.
Делать прививку от дифтерии и столбняка взрослым? – да, ведь заболевание опасно своими осложнениями.
- Развиваются заболевания нервной системы, чаще в виде параличей дыхательных путей, конечностей, мышц шеи и голосовых связок.
- Воспаление мышцы сердца или миокардит.
- Может наступить смертельный исход вследствие паралича дыхательной мускулатуры.
За последние десятилетия количество случаев заболеваемости дифтерией удалось значительно снизить благодаря вакцинации. Единичные случаи дифтерии чаще встречаются в коллективах, где есть не привитые.
Осложнения при отсутствии вакцинации от столбняка
- Наличие долго незаживающих ран, гнойные нарывы на коже
- Появление ран на кожном покрове или слизистой оболочке в результате обморожений, травм, сильных ожогов
- Укус животного
- Грядущая операция (если ранее прививку АКДС и АДС-м не делали)
График вакцинации от дифтерии для взрослых
В случае, если человек получил все прививки в положенное время – то вакцину вводят начиная с 14-16-летнего возраста каждые 10 лет однократно.
Если человек пропустил вакцинацию более 10 лет, то иммунизация против дифтерии и столбняка проводится по схеме 0-1-6, то есть интервал между первой и второй вакцинацией 30-45 дней, ревакцинация через 6 месяцев от первой прививки, далее через каждые 10 лет проводится однократная ревакцинация.
Все данные о необходимых прививках содержаться в прививочной карте в медицинской книжке. Их составляет и ведет участковая служба в поликлинике. Вызывает на прием и вакцинацию чаще всего участковая медсестра.
Вакцинация против дифтерии и столбняка входят в обязательные прививки согласно национальному календарю профилактических прививок. Приказу МЗ РФ от 21.03.2014г. “Об утверждении национального календаря профилактических прививок и профилактических прививок по эпидемическим показаниям”.
Клинические испытания приближают вакцину на один шаг
Поделиться на PinterestНовое исследование приближает нас к потенциальной вакцине против ВИЧ. Пауло Соуза / Getty Images- Клинические испытания фазы 1 подтверждают, что первый этап нового подхода к вакцинации безопасен и в принципе может работать против ВИЧ.
- Стратегия будет включать серию вакцинаций, которые активируют и развивают редкий тип иммунных клеток.
- Теоретически полученные иммунные клетки могут продуцировать антитела, которые нацелены на недоступное в противном случае слабое место на внешней поверхности вируса.
- Ученые могли бы использовать тот же подход для разработки вакцин против других сложных патогенов, таких как малярия и вирусы гриппа, денге, Зика и гепатита С.
Исследователи сделали первый шаг к разработке нового типа схемы вакцинации, которая могла бы защитить людей от ВИЧ.
Вирус, который постепенно ослабляет иммунную систему, поражает около 38 миллионов человек во всем мире.
Существуют высокоэффективные противовирусные препараты для лечения ВИЧ, но люди, живущие с вирусом, должны принимать их всю оставшуюся жизнь, и долгосрочные последствия инфекции для здоровья остаются серьезными.
Кроме того, доступ к услугам по профилактике и лечению ограничен в некоторых частях мира.
По оценкам Всемирной организации здравоохранения (ВОЗ), в результате в 2019 году было зарегистрировано 1,7 миллиона новых случаев инфицирования ВИЧ, и 690 000 человек умерли от причин, связанных с ВИЧ.
Несмотря на десятилетия работы, ученым не удалось разработать эффективную вакцину против вируса.
Причина этого в том, что большая часть поверхности вируса плотно покрыта молекулами сахара, которые не вызывают иммунный ответ, а части, которые подвергаются воздействию, сильно варьируются.
Как и SARS-CoV-2, вирус, вызывающий COVID-19, ВИЧ использует белки-шипы на своей внешней поверхности, чтобы проникнуть в свои клетки-хозяева.
«Спайк-белок у вирусов ВИЧ гораздо более коварный», — объясняет Уильям Шиф, доктор философии, профессор и иммунолог Научно-исследовательского института Скриппса в Ла-Хойя, Калифорния, и исполнительный директор Международной инициативы по созданию вакцины против СПИДа (IAVI ).
В результате быстрой мутации генов, вызывающих спайк, у ВИЧ есть миллионы различных штаммов.Из-за этого антитела против одного штамма вряд ли нейтрализуют другие.
«Итак, на самом деле ВИЧ — это не один вирус», — говорит профессор Шиф. «Прямо сейчас во всем мире действительно около 50 миллионов различных вирусов».
Однако исследователям уже давно известно, что есть труднодоступные части шипа, которые не сильно меняются.
Антитела, которые связываются с этими областями, известны как широко нейтрализующие антитела (bnAbs), потому что теоретически они могут быть нацелены на широкий спектр штаммов ВИЧ.
В редких случаях люди с ВИЧ вырабатывают эти антитела естественным путем.
Это натуральное производство дает ученым возможность определить, где антитела связываются с вирусом. Обладая этими знаниями, они могут разработать «иммуногены» для использования в вакцинах.
Загвоздка в том, что только редкий тип незрелых иммунных клеток, известный как наивные В-клетки, может развиваться в циркулирующие В-клетки, способные вырабатывать bnAb против ВИЧ.
По словам проф.Шиф.
Чтобы решить эту проблему, он и его коллеги из Scripps Research и IAVI использовали метод, называемый нацеливанием на зародышевые линии, для создания вакцины, активирующей эти редкие клетки.
В ходе клинических испытаний фазы 1 вакцина оказалась безопасной и оказала желаемый эффект почти на всех добровольцев, которые ее получили.
Исследователи из Университета Джорджа Вашингтона в Вашингтоне, округ Колумбия, и Исследовательского центра рака Фреда Хатчинсона в Сиэтле, штат Вашингтон, набрали 48 здоровых взрослых добровольцев для испытания.
Они дали участникам две дозы вакцины или плацебо.
Ученые сообщают, что вакцина активировала наивные В-клетки у 97% участников, получивших ее.
«Святой Грааль в области вакцин против ВИЧ — это получение широко нейтрализующих антител путем вакцинации. И здесь мы показали на людях, что можем запустить этот процесс », — говорит профессор Шиф.
Он представил результаты на виртуальной конференции Международного общества СПИДа по исследованию ВИЧ в целях профилактики 3 февраля 2021 года.
Стоит отметить, что испытание было небольшим и результаты еще не были опубликованы в научном журнале.
Кроме того, важно отметить, что потребуются дальнейшие исследования и еще несколько клинических испытаний для разработки и тестирования более поздних этапов схемы вакцинации.
Вакцина будет только первой из серии инъекций, которые создадут иммунитет против вируса.
Первый укол «разбудит» наивные В-клетки, а последующие уколы научат их потомков производить bnAb против ВИЧ.
«Мы считаем, что этот подход будет ключом к созданию вакцины против ВИЧ и, возможно, важным для создания вакцин против других патогенов», — говорит профессор Шиф в пресс-релизе Scripps.
Он считает, что исследователи могли бы использовать тот же подход для разработки вакцин против других сложных патогенов, таких как грипп, денге, вирус Зика, гепатит С и малярия.
Теперь команда объединила усилия с биотехнологической компанией Moderna для разработки вакцины на основе мРНК, нацеленной на те же клетки.
Как и при разработке вакцин против COVID-19, технология мРНК должна ускорить процесс разработки вакцин.
Почему так сложно сделать вакцину против ВИЧ?
История разработки вакцины против ВИЧ отмечена многочисленными неудачами и разочарованиями, и каждый очевидный «прорыв» представляет собой еще больше проблем и препятствий, которые необходимо преодолеть. Часто кажется, что на шаг вперед, который делают исследователи, непредвиденное препятствие отбрасывает их на один или даже два шага.
В некотором смысле это справедливая оценка, учитывая, что нам еще предстоит увидеть жизнеспособную вакцину-кандидат. С другой стороны, ученые действительно добились огромных успехов в последние годы, лучше понимая сложную динамику ВИЧ-инфекции и реакцию организма на такую инфекцию. Эти достижения настолько волнуют, что некоторые теперь считают, что вакцина станет возможной в ближайшие 15 лет (среди них лауреат Нобелевской премии и соавтор исследования в области ВИЧ Франсуаза Барре-Синусси).
Еще неизвестно, будет ли такая вакцина доступной, безопасной и простой для введения и распространения среди населения всего мира.Но что мы точно знаем, так это то, что необходимо будет устранить ряд ключевых препятствий, если какой-либо такой кандидат когда-либо выйдет за пределы стадии проверки концепции.
Международная инициатива по вакцине против СПИДа (IAVI)Как ВИЧ препятствует разработке вакцины
С самой фундаментальной точки зрения усилиям по разработке вакцины против ВИЧ препятствует генетическое разнообразие самого вируса. Цикл репликации ВИЧ не только быстр (немногим более 24 часов), но и подвержен частым ошибкам, создавая мутировавшие копии самого себя, которые рекомбинируют в новые штаммы по мере передачи вируса от человека к человеку.Разработка единой вакцины, способной уничтожить более 60 доминантных штаммов, а также множество рекомбинантных штаммов — и на глобальном уровне — становится еще более сложной задачей, когда обычные вакцины могут защитить только от ограниченного числа вирусных штаммов.
Во-вторых, борьба с ВИЧ требует надежного ответа со стороны иммунной системы, и это снова приводит к ее отказу. Традиционно специализированные лейкоциты, называемые Т-лимфоцитами CD4, инициируют ответ, передавая сигнал клеткам-киллерам к месту инфекции.По иронии судьбы, это те самые клетки, на которые нацелена ВИЧ-инфекция. Поступая таким образом, ВИЧ снижает способность организма защищаться, поскольку популяция CD4 систематически истощается, что в конечном итоге приводит к нарушению защиты, которое называется иммунным истощением.
Наконец, искоренению ВИЧ препятствует способность вируса прятаться от иммунной защиты организма. Вскоре после заражения, в то время как другой ВИЧ свободно циркулирует в кровотоке, подмножество вируса (называемого провирусом) внедряется в скрытые клеточные убежища (так называемые скрытые резервуары).Попав внутрь этих клеток, ВИЧ не может быть обнаружен.
Вместо инфицирования и уничтожения клетки-хозяина латентный ВИЧ делится вместе с хозяином с сохранением своего генетического материала. Это означает, что даже если ВИЧ, находящийся в свободном обращении, погибнет, «скрытый» ВИЧ может дать реактивную реакцию и запустить инфекцию заново.
Преодоление препятствий
В последние годы стало ясно, что преодоление этих препятствий потребует многоаспектной стратегии и что единый подход вряд ли приведет к достижению целей, необходимых для разработки стерилизующей вакцины.
Таким образом, основные компоненты этой стратегии должны быть направлены на:
- Способы нейтрализации множества генетических штаммов ВИЧ
- Способы вызвать соответствующий иммунный ответ, необходимый для защиты
- Способы поддержания целостности иммунной системы
- Способы очистки и уничтожения скрытых вирусов
Прогресс достигается по многим из этих предложенных стратегий с разным уровнем эффективности и успеха, и его можно примерно определить следующим образом:
Стимулирующие широко нейтрализующие антитела
Среди людей, живущих с ВИЧ, есть группа людей, известных как элитные контролеры (ЭК), которые, по-видимому, обладают способностью подавлять репликацию вируса без антиретровирусной терапии.
В последние годы ученые начали определять конкретные генетические мутации, которые, по их мнению, обусловливают этот естественный защитный ответ. Среди них — подмножество специализированных защитных белков, известных как широко нейтрализующие антитела (или bNAb).
Антитела защищают организм от конкретного болезнетворного агента (патогена). Большинство из них не являются нейтрализующими антителами широкого спектра действия, что означает, что они убивают только один или несколько типов патогенов.
Некоторые недавно обнаруженные bNAb обладают способностью убивать широкий спектр вариантов ВИЧ — до 95% в некоторых случаях — тем самым ограничивая способность вируса инфицировать и распространяться.
На сегодняшний день ученым еще предстоит определить эффективные средства для индукции ответа bNAb до уровней, при которых он может считаться защитным, и что для развития такого ответа, вероятно, потребуются месяцы или даже годы. Еще больше усложняет ситуацию тот факт, что мы еще не знаем, может ли стимуляция этих bNAb быть вредной — могут ли они действовать против собственных клеток организма и свести на нет какую-либо пользу от лечения.
При этом большое внимание уделяется прямой инокуляции bNAb людям с установленной ВИЧ-инфекцией.Один из таких bNAb, известный как 3BNC117, по-видимому, не только блокирует заражение новых клеток, но также очищает ВИЧ-инфицированные клетки. Такой подход может однажды позволить альтернативный или дополнительный подход к терапии для людей, уже инфицированных вирусом.
Восстановление иммунной целостности
Даже если бы ученые смогли эффективно стимулировать производство bnAbs, это, вероятно, потребовало бы надежного иммунного ответа. Это считается серьезной проблемой, поскольку сам ВИЧ вызывает истощение иммунной системы, активно убивая «вспомогательные» Т-клетки CD4.
Кроме того, способность организма бороться с ВИЧ с помощью так называемых «убийц» Т-лимфоцитов CD8 со временем постепенно ослабевает по мере того, как организм подвергается так называемому иммунному истощению. Во время хронической инфекции иммунная система будет постоянно регулировать себя, чтобы гарантировать, что она не будет ни чрезмерно стимулирована (вызывая аутоиммунное заболевание), ни недостаточно стимулирована (позволяя патогенам беспрепятственно распространяться).
В частности, при длительной ВИЧ-инфекции может происходить недостаточная активация, поскольку клетки CD4 постепенно уничтожаются, и организм становится менее способным идентифицировать патоген (ситуация аналогична ситуации у пациентов с раком).Когда это происходит, иммунная система непреднамеренно «тормозит» соответствующую реакцию, делая ее все менее и менее способной защищаться.
Ученые из Университета Эмори начали исследовать использование клонированных антител под названием ипилимумаб , которые могут «ослабить тормоза» и активизировать производство Т-клеток CD8.
Одно из наиболее восторженно воспринятых исследований, в настоящее время находящихся на испытаниях на приматах, включает использование отключенной «оболочки» обычного вируса герпеса, называемого ЦМВ, в которую вставлены не вызывающие болезни фрагменты SIV (версия ВИЧ для приматов) .Когда субъектам вводят генетически измененный ЦМВ, организм реагирует на «ложную» инфекцию ускорением выработки Т-клеток CD8 для борьбы с тем, что, по их мнению, является ВИО.
Что делает модель ЦМВ особенно привлекательной, так это то, что вирус герпеса не выводится из организма, как вирус простуды, а продолжает размножаться. Приносит ли это долговременную иммунную защиту, еще предстоит определить, но это убедительное доказательство правильности концепции.
Пнуть и убить скрытый ВИЧ
Одно из самых серьезных препятствий на пути разработки вакцины против ВИЧ — это скорость, с которой вирус способен создавать скрытые резервуары, чтобы избежать обнаружения иммунной системой.Считается, что это может произойти всего за четыре часа в случае передачи через анальный секс — быстро от места заражения к лимфатическим узлам — до четырех дней при других типах передачи половым или несексуальным путем.
На сегодняшний день мы не совсем уверены, насколько обширными или большими могут быть эти резервуары, ни с какой их способностью вызывать возврат вируса (то есть возвращение вируса) у тех, кто, как считается, не инфицирован.
Некоторые из наиболее агрессивных аспектов исследования включают в себя так называемую стратегию «пинка-убийство», в которой используются стимулирующие агенты, которые могут «вытолкнуть» латентный ВИЧ из укрытия, тем самым позволяя второстепенному агенту или стратегии «убить» недавно обнаруженный вирус. .
В этом отношении ученые добились определенного успеха, используя препараты, называемые ингибиторами HDAC, которые традиционно использовались для лечения эпилепсии и расстройств настроения. Хотя исследования показали, что новые препараты HDAC способны «разбудить» спящий вирус, ни одному из них еще не удалось очистить резервуары или даже уменьшить их размер. В настоящее время надежды возлагаются на совместное использование HDAC и других новых лекарственных средств (включая PEP005, используемый для лечения одного из видов рака кожи, связанного с солнцем).
Однако более проблематичным является тот факт, что ингибиторы HDAC потенциально могут вызывать токсичность и подавление иммунных ответов.В результате ученые также изучают класс лекарств, называемых агонистами TLA, которые, по-видимому, способны стимулировать иммунный ответ, а не «вытряхивать» вирус из укрытия. Ранние исследования на приматах были многообещающими, не только с измеримым сокращением латентных резервуаров, но и со значительным увеличением активации клеток-киллеров CD8.
Четыре десятилетия поисков вакцины против ВИЧ дают новую надежду
Когда вирусолог Хосе Эспарса начал сотрудничать с Всемирной организацией здравоохранения в борьбе с эпидемией СПИДа в 1980-х годах, он и многие его коллеги были убеждены, что вакцина станет решением. — и что это произойдет быстро.
Их оптимизм основывался на твердой науке: исследователи знали, что люди вырабатывают антитела к вирусу иммунодефицита человека, вызывающему СПИД. И побуждение организма к выработке антител уже было распространенной и успешной стратегией вакцинации, которая резко снизила количество случаев кори, оспы и многих других болезней. Борьба со СПИДом казалась столь же выполнимой.
«Мы думали, что это будет кусок пирога», — говорит Эспарза, бывший старший советник Фонда Билла и Мелинды Гейтс, который теперь связан с Медицинской школой Университета Мэриленда.«Мы не знали сложности ВИЧ». Спустя более трех десятилетий до сих пор не существует жизнеспособной вакцины-кандидата от ВИЧ, даже несмотря на то, что ученые создали несколько эффективных вакцин против вируса SARS-CoV-2, который вызывает COVID-19 менее чем через год после его появления.
Теперь недавние открытия вселяют новую надежду. На международной конференции по СПИДу в феврале исследователи из Scripps Research и IAVI, некоммерческой организации по исследованию вакцин, объявили многообещающие результаты анализа крови первого этапа испытаний новой стратегии вакцины против ВИЧ на людях.Результаты, которые до сих пор не опубликованы, привлекли внимание общественности таким образом, что это было возможно только в эпоху социальных сетей. «ЭТО ОГРОМНО», — написал пользователь Twitter @AugustusRotter. В начале апреля твит получил лайки и тысячи раз ретвитнул.
Реальность гораздо более тонкая, чем предполагает шумиха, говорит Уильям Шиф, иммунолог из Scripps и исполнительный директор по разработке вакцины в Центре нейтрализующих антител IAVI. Хотя иммунный ответ, обнаруженный его командой, является важным подтверждением концепции, по его словам, до производства инъекций, снижающих вероятность заражения ВИЧ-инфекцией, еще далеко.Даже в этом случае возможная вакцина, скорее всего, будет включать в себя несколько прививок, что может оказаться трудной задачей.
«С научной точки зрения это прекрасная концепция», — говорит Эспарса. «Практически реализовать это будет непросто».
Тем не менее, после десятилетий неудач, результаты являются долгожданной новостью — с некоторыми интригующими связями с усилиями по созданию вакцины COVID-19, которые могут помочь ускорить работу по борьбе с ВИЧ.
«Это своего рода маленький шаг к созданию вакцины против ВИЧ, но это также и гигантский шаг», — говорит Шиф, предлагая жизнеспособный путь вперед.«И в самом деле, в этом конкретном случае это сработало на удивление хорошо».
Три волны надеждыПоиск вакцины против ВИЧ начался вскоре после того, как ученые выделили вирус и подтвердили, что он вызывает СПИД в 1984 году. С тех пор научные поиски последовали за тремя волнами исследований, говорит Эспарза, который опубликовал исторический отчет о поисках вакцины против ВИЧ в 2013 году.
Первая волна была сосредоточена на наиболее устоявшейся идее: попытаться стимулировать иммунную систему человека для выработки так называемых нейтрализующих антител, которые инактивируют определенные вирусы.Это стратегия, которую используют многие другие вакцины, в том числе вакцины против COVID-19. В течение многих лет исследователи работали над определением антител, которые люди вырабатывают в ответ на ВИЧ-инфекцию, а затем разрабатывали вакцины, которые индуцировали бы производство аналогичных антител.
Но ВИЧ оказался неуловимым врагом. Антитела нацелены на специфические белки на поверхности вируса. Однако ВИЧ быстро мутирует в варианты, которые антитела не могут распознать, что означает, что он постоянно на шаг впереди иммунной системы.По словам Шифа, в одном классическом исследовании исследователи неоднократно тестировали кровь людей, инфицированных ВИЧ, и обнаружили, что антитела, вырабатываемые их иммунной системой, всегда отставали от вируса примерно на три-шесть месяцев.
«ВИЧ по-прежнему является гораздо более сложной научной целью», чем SARS-CoV-2, — говорит Ларри Кори, эксперт в области вирусологии, иммунологии и разработки вакцин из Онкологического исследовательского центра Фреда Хатчинсона в Сиэтле и главный исследователь вакцины против ВИЧ. Сеть испытаний. «Девяносто восемь процентов людей выздоравливают от SARS-CoV-2, и мы равны нулю из 78 миллионов людей, которые самостоятельно выздоравливают от ВИЧ.
К началу 2000-х годов исследователи преследовали вторую волну вакцин против ВИЧ, основанную на идее нацеливания на «солдатские» Т-клетки организма, а не на стимуляцию антител. Долгосрочный иммунитет человека зависит от двух основных групп клеток: В-клеток и Т-клеток. Оба помогают производить антитела, но Т-клетки также ищут и уничтожают инфицированные клетки. Идея Т-клеточных вакцин заключалась в том, чтобы стимулировать клетки, которые распознают внутренние белки вируса.
В 2007 году эта идея не только не смогла обеспечить защиту в двойном слепом рандомизированном исследовании второй фазы под названием STEP, но и увеличила риск заражения ВИЧ.«Судебный процесс с треском провалился», — говорит Эспарса.
Это была далеко не единственная попытка вакцины провалиться. После десятилетий испытаний на людях только один из них продемонстрировал хоть какую-то степень реальной эффективности. Завершенная в 2009 году в Таиланде комбинация двух вакцин, основанная на стратегии индукции антител первой волны, снизила уровень ВИЧ-инфекции на 31 процент — этого недостаточно, чтобы получить одобрение регулирующих органов.
Ориентация на наивные В-клеткиТретья и текущая волна исследований вакцины против ВИЧ началась в конце 2000-х годов, когда исследователи обнаружили, что небольшое меньшинство людей, инфицированных ВИЧ, вырабатывают особенно мощные антитела, которые могут нейтрализовать многие штаммы ВИЧ одновременно. .На данный момент ученые идентифицировали десятки этих широко нейтрализующих антител, которые нацелены на части вирусной поверхности (во многом как белки-шипы на SARS-CoV-2), которые одинаковы от штамма к штамму.
Люди, вырабатывающие эти белки, по-прежнему не могут бороться с ВИЧ, потому что их тела не вырабатывают эти антитела до тех пор, пока вирусная инфекция не распространится, а вирус тем временем продолжает мутировать, говорит Шиф. Но это открытие породило новую идею: возможно, эффективная вакцина могла бы на шаг опередить вирус, нацелившись на так называемые наивные В-клетки (также известные как клетки-предшественники), которые циркулируют в нашей крови, говорит Шиф.Если вакцина может заставить наивные В-клетки приобретать мутации, которые превращают их в клетки, вырабатывающие широко нейтрализующие антитела перед ВИЧ-инфекцией, организм мог бы бороться с ней, когда впервые был представлен вирусом.
В 2010 году группа Шифа начала работать с классом широко нейтрализующих антител под названием VRC01, первым из которых был обнаружен Исследовательским центром вакцин NIH. Во-первых, они разработали белковые наночастицы, которые, как они сообщили, могут связываться с наивными В-клетками в образцах крови человека.В исследованиях на мышах наночастица могла активировать эти клетки и заставить их размножаться и мутировать в направлении производства антител, подобных VRC01. Новое исследование было направлено на то, чтобы выяснить, может ли то же самое происходить с людьми.
Это было большое «если». По словам Шифа, только одна из каждых 300 000 наивных В-клеток может развиться в клетки, вырабатывающие антитела против VRC01. Но при комплексном анализе крови команда обнаружила, что 35 из 36 человек, получивших вакцину, «инженерные белковые наночастицы», вызвали намеченные В-клеточные реакции.
Результаты, которые все еще проходят анализ и еще не представлены для публикации, далеки от того, чтобы продемонстрировать какой-либо защитный эффект против ВИЧ, говорит Шиф, хотя многие активные пользователи социальных сетей заявили, что это звучит как если вакцина против ВИЧ внезапно не за горами.
«Неделю назад кто-то разослал твит, в котором указывалось, что наше испытание вызывало реакцию, которая могла защитить 97 процентов реципиентов вакцины от ВИЧ», — говорит он.«Это совершенно неправда».
В конце концов, говорит Шиф, люди могут получить серию прививок в течение нескольких недель или лет, начиная с той, которая начинается там, где было проведено новое испытание: взаимодействие с правильными наивными В-клетками, чтобы запустить процесс. Последующие выстрелы будут направлять В-клетки к выработке полностью зрелых нейтрализующих антител широкого спектра действия.
«Мы пытаемся занять место водителя с иммунной системой и постепенно обучать ее с помощью вакцины», — говорит Шиф. Та же идея может когда-нибудь привести к созданию вакцин против вируса Зика, гепатита С, малярии и других болезней, включая универсальную вакцину против гриппа и будущие коронавирусы.
Эта работа также является важным признаком того, что ученые на правильном пути, говорит Кори, добавляя к недавнему исследованию, что введение людям высоких уровней нейтрализующих антител широкого спектра действия может предотвратить ВИЧ.
«Главный прорыв — я буду использовать слово« прорыв »- исследования Скриппса заключается в том, что мы можем дать антиген, у которого эти предшественники широко распространены среди людей, и они не удаляются, — говорит Кори. «Здесь у нас есть прорыв в том, чтобы сделать первый шаг.”
Использование инфраструктуры вакцины от COVID-19Помимо научных проблем, исследованиям вакцины против ВИЧ долгое время препятствовало отсутствие ощущения срочности. В то время как общественная и политическая воля, наряду с крупными инвестициями в промышленность, подтолкнула усилия по COVID-19 продвигаться вперед рекордными темпами, ВИЧ — это болезнь, которая непропорционально поражает маргинальные группы, говорит Эспарса, и фармацевтические компании не хотели вкладывать средства в дорогостоящие испытания на ВИЧ. пока ученые не установили больше фундаментальной науки.
«Если бы общество действительно ценило вакцину против ВИЧ, мы бы проводили несколько испытаний эффективности параллельно, как это было сделано с COVID», — говорит Эспарса. «Дорого, да. Но цена эпидемии ВИЧ огромна ».
Согласно одному исследованию, расходы на здравоохранение в связи с ВИЧ / СПИДом составили более 562 миллиардов долларов в 188 странах с 2000 по 2015 год.
Итак, пока мир наблюдает, как вакцины от COVID-19 поступают с беспрецедентной скоростью, можно надеяться, что энтузиазм вызовет импульс для тех видов долгосрочных усилий по разработке вакцин, которые будут иметь решающее значение для борьбы с ВИЧ.
Оба уже подключены. По словам Кори, усилия по созданию вакцины против COVID-19 были совмещены с клинической, лабораторной и биостатистической инфраструктурой, созданной Сетью испытаний вакцины против ВИЧ. В течение многих лет, добавляет Шиф, его группа сотрудничала с Moderna для тестирования доставки мРНК их белков на животных моделях. Они планируют работать вместе, чтобы быстро создать кандидатуру вакцины против ВИЧ для использования в клинических испытаниях на людях.
Учитывая энтузиазм по поводу вакцин против COVID-19 и новую технологию мРНК, которая может быстро создавать вариации вакцины, возможно, пришло время вызвать новый интерес к поиску вакцин против ВИЧ, что также потребует сотрудничества общественности.
«Если мы создадим вакцину против ВИЧ, — говорит Шиф, — я бы подумал, что мировой опыт применения вакцин COVID может облегчить нам внедрение».
Новая вакцина против ВИЧ может стать одной из следующих историй успеха МРНК компании Moderna
- Технология мРНК Moderna может изменить правила многолетних усилий по разработке вакцины против ВИЧ.
- Компания заявила, что планирует начать два испытания вакцины на людях к концу 2021 года.
- «Воодушевленные» такой перспективой, исследователи ВИЧ предупреждают, что мРНК-вакцинам предстоит еще долгий путь.
- Смотрите больше историй на бизнес-странице Insider.
Moderna в среду были продемонстрированы усилия биотехнологической компании из Массачусетса по разработке вакцин против ВИЧ и восьми других инфекционных заболеваний.
Технология мРНК компании, основанная на десятилетиях исследований, теперь внесет свой вклад в долгие неудачные попытки сдержать глобальную эпидемию ВИЧ / СПИДа.
Работая в сотрудничестве с Национальным институтом здравоохранения, исследованиями Скриппса, Фондом Гейтса и другими партнерами, Moderna заявила, что к концу 2021 года начнет тестирование двух кандидатов на вакцину против ВИЧ на людях.
Долгая работа разработчика вакцины COVID-19 -срочная цель — показать, что вакцина на основе мРНК может вырабатывать широко нейтрализующие антитела, тип иммунного ответа, который, по мнению исследователей, будет защищать от циркулирующих по всему миру штаммов ВИЧ.
«Подумайте о людях, которые умирают от ВИЧ каждый год, о людях, которых нет в живых, потому что у них нет удивительной терапии, доступной в этой стране», — сказал Insider генеральный директор Стефан Бансел в интервью во вторник.В 2019 году 700000 человек умерли от причин, связанных со СПИДом, заболевания, вызванного ВИЧ, и, по оценкам, 1,7 миллиона человек заразились ВИЧ.
Однако два опытных исследователя ВИЧ / СПИДа сообщили Insider, что, хотя они взволнованы перспективой использования технологии мРНК для разработки вакцины против ВИЧ, всем участникам предстоит долгий путь. Технология мРНК Moderna, несомненно, ускорит «тонкую настройку» разработки вакцины против ВИЧ, но только продолжение тестирования покажет, действительно ли конечный результат безопасен и эффективен.
Профессор вирусологии Университета Эмори Рафик-Пьер Секали, который изучал ВИЧ в течение двух десятилетий, сказал, что было бы «безумием не проверять», сможет ли технология мРНК обойти дорогостоящий и медленный процесс создания этих фрагментов белка в лаборатории.
«У нас был такой впечатляющий результат с коронавирусом, что нам абсолютно необходимо встать на эту платформу и протестировать ее», — сказал Секали. «Ни одна из других [ВИЧ] платформ не дала никаких намеков на обнадеживающие результаты».
Подробнее: Moderna делает ставку на то, что ее технология мРНК приведет к новой волне вакцин от таких болезней, как ВИЧ.Вот 5 лучших, над которыми он работает, помимо COVID-19.
Партнерство Moderna будет основываться на новом и недоказанном подходе к вакцинамУильям Шиф, профессор иммунологии Scripps Research и директор по разработке вакцины Международной инициативы по разработке вакцины против СПИДа, представил инвесторам Moderna неопубликованные данные испытаний вакцины против ВИЧ на виртуальной конференции по исследованию СПИДа в феврале.
Испытание, начавшееся в 2018 году, было проведено с 48 ВИЧ-отрицательными взрослыми и послужит предварительной основой, на которой Moderna и ее сотрудники продолжат изучение и тестирование вакцины, нацеленной на нейтрализующие антитела широкого спектра действия.Субъектам давали низкую или высокую дозу вакцины-кандидата на основе белка, которая была разработана для активации определенных «наивных» В-клеток иммунной системы.
При активации В-клетки продуцируют белки, которые в конечном итоге дают начало желанным широко нейтрализующим антителам.
«Важность праймирования этих наивных В-клеток — первый ключевой шаг», — сказал Шиф, отвечая на призыв к инвестору. «Если вы не можете заставить это работать, все это не сработает.
После лечения экспериментальной вакциной 47 из 48 участников показали целевые уровни наивных В-клеток, критически важных для выработки антител, хотя данные остаются предметом экспертной оценки. Последний доброволец исследования выбыл.
Moderna’s По словам Шифа, экономичная и эффективная по времени технология мРНК ускорит процесс проведения клинических испытаний. Условно говоря, обычное производство белков в лаборатории — медленное и дорогое.
«Нам потребовались годы, чтобы провести это одно испытание, много лет «, — добавил он, имея в виду исследование 48 человек.«Нам нужно провести множество клинических испытаний на людях, и мы думаем, что мРНК Moderna — это технология, которая позволит нам это сделать».
Moderna планирует протестировать на людях две вакцины-кандидаты против ВИЧ с доставкой мРНК, каждая из которых будет проверена на безопасность и эффективность. Первый основан на белковом компоненте первоначального исследования, а второй будет определять, могут ли синтетические ВИЧ-подобные антигены спровоцировать желаемый иммунный ответ. Оба испытания начнутся к концу этого года.
Генеральный директор Moderna Стефан Бансель принимает участие в саммите Forbes Healthcare 2019 в Джазе в Линкольн-центре 5 декабря 2019 года в Нью-Йорке. Стивен Фердман / Getty Images По сравнению с вирусом COVID-19, ВИЧ — это «совсем другая игра»Dr.Ян Франк, исследователь вакцины против ВИЧ из Университета Пенсильвании, который участвовал в разработке вакцины против ВИЧ, в том числе вакцины, которая прошла на поздних стадиях испытаний в 2007 году, сказал, что подход с использованием мРНК к разработке вакцины против ВИЧ имеет преимущество в скорости и гибкости. По его словам, без тщательного изучения данных исследования Шифа, которое все еще проходит экспертную оценку, немного сложно понять нюанс.
Однако, если данные покажут, что вакцина вырабатывает широко нейтрализующие антитела, этот подход будет сигнализировать о полном изменении парадигмы в исследованиях вакцины против ВИЧ, сказал Франк.
Несмотря на успех использования мРНК для иммунизации против COVID-19, ВИЧ — это «совсем другая игра», — сказал Секали, исследователь ВИЧ из Университета Эмори. После заражения ВИЧ вирус остается постоянно активным в небольшом количестве клеток организма, если его не лечить, в отличие от вируса, вызывающего COVID-19.
Это означает, что успешная вакцина против ВИЧ должна преодолеть более высокие препятствия, чем любая другая вакцина в истории, сказал Фрэнк.Это должно было бы полностью предотвратить инфекцию или иммунный ответ, лежащий в ее основе. Другие вакцины, включая вакцины COVID-19 Moderna и Pfizer-BioNTech, только предотвращают превращение инфекции в болезнь.
«Чтобы у нас была вакцина против ВИЧ, эффективная и способствующая предотвращению инфекции, необходимо провести некоторую тонкую настройку этой вакцины», — сказал Фрэнк.
Хотя Секали «взволнован» перспективой партнерства Moderna в испытаниях вакцины против ВИЧ, он подчеркнул, что подход к доставке на основе мРНК все еще не доказан, кроме COVID-19, и подчеркнул необходимость обеспечения безопасности пациентов в клинических испытаниях.
И Фрэнк, и Секали заявили, что платформа мРНК компании, вероятно, позволит любым перспективным кандидатам на вакцины перейти от ранних к средним стадиям клинических испытаний в течение года — гораздо более быстрыми темпами, чем исторически развивались вакцины.
Кандидаты в мРНК Moderna обладают прорывным потенциалом в разочаровывающем и дорогостоящем поиске вакцины против ВИЧВ беседе с Insider генеральный директор компании Бансел признал неотъемлемую проблему разработки безопасной и эффективной вакцины против ВИЧ, глобальную проблему здравоохранения, решение которой ускользнуло от исследователей. в течение четырех десятилетий.
Последний кандидат на вакцину против ВИЧ, прошедший поздние исследования в Южной Африке, был остановлен в феврале 2020 года после того, как не было «абсолютно никаких доказательств эффективности», сообщил Science его главный исследователь.
Более ранняя версия вакцины, использованная в южноафриканском исследовании, показала только 31% эффективность в предыдущем испытании в Таиланде. До этого последняя вакцина против ВИЧ, прошедшая клинические испытания на поздней стадии, завершилась в 2007 году.
Два оставшихся клинических испытания вакцин против ВИЧ на поздней стадии, Mosaico и Imbokodo, проводятся Johnson & Johnson и не будут публиковать результаты раньше конец 2021 года.
Подобно южноафриканскому исследованию, которое было остановлено в 2020 году, в обоих испытаниях используется неактивный вирусный вектор, несущий генетический материал на основе многих штаммов ВИЧ со всего мира, а также синтетический белок, имитирующий часть белка оболочки частицы.
Даже без участия Moderna, вакцина против ВИЧ, разработанная командой Шифа, использует другой подход к борьбе с вирусом, чем тот, который использовался в испытаниях J&J. По словам Фрэнка, используя тот же метод доставки, что и вакцины COVID-19 Moderna и Pfizer-BioNTech, исследователи смогут еще более точно настраивать версии своей вакцины.
Палестинский медик демонстрирует флакон с вакциной Moderna COVID-19. AP Photo / Oded Balilty, File Вакцины COVID-19 извлекли выгоду из десятилетий исследований вакцины против ВИЧХотя он находит перспективу создания вакцины на основе мРНК захватывающей, Фрэнк сказал, что Moderna и ее партнерам предстоит долгий путь, чтобы доказать, что их подход с использованием белка с доставкой мРНК является успешным. .
«Эта стратегия потенциально может стать прорывом, но это первый шаг в тяжелом подъеме», — сказал Фрэнк. Технология мРНК Moderna определенно даст исследователям возможность быстро проводить тесты, но это все, что он может сделать.
«Я уверен, что они могут получить вакцину-кандидат», — сказал Фрэнк. «Проблема будет в том, насколько эффективен иммунный ответ, который он вызывает».
COVID-19 стал прорывом для мРНК-вакцин, открыв путь для дальнейших исследований в области ВИЧ и рака.Однако, согласно недавнему докладу Национального бюро экономических исследований, на самом деле это были десятилетия коллективных неудач, и миллиарды долларов, вложенные в исследования вакцины против ВИЧ, заложили основу для вакцины COVID-19.
Опубликованный в марте автор Джеффри Э. Харрис обнаружил, что 86% клинических вакцин против COVID-19 имеют научную основу для прошлых испытаний вакцины против ВИЧ. С этой точки зрения платформа мРНК Moderna на самом деле является всего лишь кратким перерывом от непосредственно ориентированных на ВИЧ научных исследований, ведущих к последним усилиям по сдерживанию эпидемии ВИЧ / СПИДа.
Эндрю Данн предоставил отчеты.
Загрузка Что-то загружается.Прорыв в вакцине против ВИЧ: что на самом деле означают новые результаты исследований
За последний год в общественном сознании произошел резкий сдвиг в количестве космических вакцин. Во время разработки и тестирования текущих вакцин против Covid-19 люди следили за различными фазами клинических испытаний, такими как ранний сезон American Idol .Фактически, многие называли это «гонкой за вакциной». Это, конечно, имеет смысл, учитывая, что с самого начала пандемии официальные лица общественного здравоохранения ясно дали понять, что наличие безопасной и эффективной вакцины — это наш билет назад к некоторому типу нормального состояния.
Спустя несколько месяцев после внедрения вакцины все еще очень важны для нас. Хотя это действительно победа для общественного здравоохранения, на прошлой неделе повсеместно возникла путаница в отношении результатов клинических испытаний, впервые обнародованных в феврале.Согласно нескольким драматическим заголовкам и обильным публикациям в социальных сетях, благодаря технологии, разработанной Moderna для вакцины против Covid-19, высокоэффективная вакцина против ВИЧ находится в пределах досягаемости — как в современной сказке об общественном здравоохранении.
К сожалению, этого не произошло. Но некоторая комбинация неправильного толкования результатов исследования и нашей постоянной жажды новостей о вакцинах привела к тому, что этот приятный рассказ стал вирусным. (Извините)
Между тем, фактические результаты этого исследования действительно представляют собой значительный прорыв, приближающий исследователей на шаг ближе к разработке вакцин не только от ВИЧ, но и от других вирусных инфекций.Вот что нужно знать об этих действительно интересных открытиях.
Если оставить в стороне замешательство и энтузиазм в отношении вакцин, почему мы говорим об этом исследовании?
Вкратце, это было первое клиническое испытание, проведенное на людях, в котором успешно использовался подход, который стимулирует иммунную систему к выработке определенного типа антител — ключевого компонента будущей вакцины против ВИЧ.
В частности, они обнаружили, что 97 процентов участников, получивших вакцину, имели иммунный ответ, на который надеялись исследователи.(И да, этот подход был протестирован с использованием двух доз вакцины, что, возможно, усугубило некоторую путаницу в отношении полученных результатов.)
Известное как IAVI G001, клиническое испытание было доказательством концептуального исследования — это означает, что его цель состояла в том, чтобы определить, достаточно ли перспективен этот конкретный метод, чтобы требовать дальнейших исследований. (Это произошло.) Исследование было результатом сотрудничества Международной инициативы по вакцине против СПИДа (IAVI), которая также была официальным спонсором исследования, и Scripps Research, и финансировалось за счет грантов Фонда Билла и Мелинды Гейтс и Национального института аллергии. и инфекционные заболевания (NIAID), среди прочего.
Как работает эта вакцинация?
Прежде чем вдаваться в подробности этого конкретного клинического испытания, важно иметь некоторый контекст, — говорит доктор Марк Файнберг, президент и генеральный директор IAVI. Хотя он не входил в состав исследовательской группы, проводившей это клиническое испытание, Файнберг имеет более чем 20-летний опыт исследований ВИЧ / СПИДа и биологии других возникающих заболеваний.
«Имунной системе легче создать мощный нейтрализующий ответ антител на SARS-CoV-2 [чем на ВИЧ]», — говорит он Rolling Stone .«С ВИЧ невероятно сложно бороться, и это просто из-за фундаментальных различий в вирусах и видах инфекций, которые они вызывают».
Это помогает объяснить — по крайней мере, с научной точки зрения — почему исследователи смогли разработать несколько эффективных вакцин против Covid-19 менее чем за год, в то время как исследования вакцины против ВИЧ продолжались десятилетиями. На сегодняшний день ни одно исследование вакцины против ВИЧ не смогло вызвать широкие нейтрализующие антитела с помощью вакцинации — что, по мнению Файнберга и его коллег, является неотъемлемой частью разработки эффективной вакцины против ВИЧ.Широко нейтрализующие антитела (bnAbs) — это редкие, но мощные специализированные белки крови, которые могут противодействовать множеству различных штаммов вируса — что особенно важно для ВИЧ, который мутирует гораздо чаще, чем другие вирусы.
«Нас беспокоит Covid [варианты], но то, что Covid делает за два месяца, ВИЧ делает за один день», — говорит доктор Ларри Кори, вирусолог из Онкологического исследовательского центра Фреда Хатчинсона и соучредитель испытаний вакцины против ВИЧ. Сеть (HVTN). Помимо своего вклада в исследования ВИЧ, в том числе в разработку антиретровирусных препаратов, Кори был одним из двух ученых, д-р.Энтони Фаучи наблюдал за более чем 80 центрами клинических испытаний, разрабатывающих вакцины-кандидаты от Covid-19 во время операции Warp Speed.
Как человек, знакомый с обоими вирусами, но не связанный с IAVI G001, Кори объясняет, что, хотя разработка эффективной вакцины против ВИЧ — «гораздо более серьезная задача», чем создание вакцины против Covid-19, «этот прорыв был хорошим».
Что именно это был за прорыв?
Вакцина, испытанная в клинических испытаниях IAVI G001, была специально разработана для активации определенных клеток, которые могут продуцировать bnAb.«Мы должны провести иммунную систему по этому пути, чтобы выработать широко нейтрализующие антитела», — объясняет Файнберг, отмечая, что у 97 процентов участников, получивших вакцину, этот подход «работал в значительной степени именно так, как мы хотели, чтобы он работал».
Теперь, по словам Файнберга, исследователи могут направить свои усилия на достижение следующих шагов, необходимых для создания вакцины против ВИЧ.
Plus, исследователи полагают, что этот метод примирования иммунной системы для производства bnAb может также применяться для создания вакцин от других сложных патогенов, таких как малярия, вирусы Зика и гепатита С.Точно так же Файнберг говорит, что этот подход также может сыграть роль в разработке универсальной вакцины против гриппа — например, вакцины, которая будет работать с большинством штаммов, что сделает нашу ежегодную прививку от гриппа значительно более эффективной.
Каким образом вакцина Moderna и Covid-19 вписывается в общую картину?
Сообщения о том, что прорыв в вакцине против ВИЧ стал возможен только благодаря технологии мРНК, изобретенной Moderna при разработке вакцины против Covid-19, неточны по нескольким причинам.Во-первых, исследование того, могут ли вакцины на основе РНК работать против ВИЧ, началось задолго до того, как кто-либо услышал о SARS-CoV-2. «ВИЧ [исследования вакцины] создали основу и средства, которые позволили нам добиться такого невероятного успеха в борьбе с Covid», — объясняет Кори. Кроме того, несмотря на то, что Moderna в партнерстве с исследовательской группой разработала и протестировала вакцину на основе мРНК, которая использует этот подход для производства bnAb, это следующий шаг в процессе — другими словами, исследования, которых еще не было.
Тем не менее, при переходе к следующим этапам исследования эффективной вакцины против ВИЧ извлеченные уроки и методы, усовершенствованные в ходе разработки вакцины против Covid-19, несомненно, будут полезными. «Возникает надежда, что Covid, который научит нас тому, как мы должны действовать, поможет нам в разработке вакцин против ВИЧ», — говорит Кори.
Например, использование технологии РНК, которая использует мессенджер (мРНК), который действует как часть генетического кода, побуждая организм создавать белок-ловушку, похожий на вирус, в надежде, что иммунная система будет обманом атаковать его. , что в конечном итоге приведет к выработке антител для борьбы с вирусом — ожидается, что ускорит темпы открытия и разработки вакцины против ВИЧ.«Технология РНК сама по себе не решит фундаментальных проблем при создании вакцины против ВИЧ — они будут теми же самыми», — объясняет Файнберг. «Это просто инструмент, предоставляемый технологией РНК, который позволит нам двигаться намного быстрее и применять наши лучшие идеи в исследованиях на людях быстрее, чем мы могли бы это сделать раньше».
Насколько быстрее мы говорим? По словам Файнберга, еще слишком рано устанавливать какие-либо сроки для разработки эффективной вакцины против ВИЧ, но он отмечает, что, в отличие от вакцин Covid-19, этот процесс займет больше года.
Что еще это может означать для исследования вакцины против ВИЧ?
Хотя некоторые из недавних отчетов об этом клиническом испытании включали то, что Файнберг называет «иррациональным энтузиазмом в интерпретации некоторых данных», обнадеживает, что через год нашей карьеры кабинетных вирусологов мы по-прежнему очень рады вакцинам. . «Я думаю, что здесь есть оптимизм, — говорит Кори. «Во-первых, понимание вакцины в стране заметно выросло, поэтому интерес к разработке вакцин есть.”
На протяжении всей пандемии Кори говорит, что его беспокоит, что — как и многое другое — исследования вакцины против ВИЧ будут «похоронены под короной Covid». Но теперь он надеется, что в будущем повышение осведомленности общественности о вакцинах и их разработке благодаря Covid, в конечном итоге, станет благом для исследований вакцины против ВИЧ.
«Я надеюсь, что по мере того, как мы выйдем из эпидемии Covid, мы получим импульс», — говорит он. «И что граждане будут участвовать в вакцинации против ВИЧ, как они это сделали в Covid.Я имею в виду, как они помогли нам в Covid — это просто чудо — все эти люди подошли, засучили рукава и получили критические выстрелы ».
Примечание редактора. Эта статья была обновлена, чтобы уточнить, что ни одна вакцина против ВИЧ еще не способна производить bnAbs.
Компенсация риска после вакцинации против ВИЧ-1 может ускорить вирусную адаптацию и снизить рентабельность: модельное исследование
Фаучи, А.С. Вакцина против ВИЧ необходима для прекращения пандемии ВИЧ / СПИДа. JAMA 318 , 1535–1536. https://doi.org/10.1001/jama.2017.13505 (2017).
Артикул PubMed Google Scholar
Rerks-Ngarm, S. et al. Вакцинация ALVAC и AIDSVAX для предотвращения заражения ВИЧ-1 в Таиланде. N. Engl. J. Med. 361 , 2209–2220. https://doi.org/10.1056/NEJMoa0
2 (2009 г.).
КАС Статья PubMed Google Scholar
Эдлефсен, П. Т., Гилберт, П. Б. и Роллан, М. Ситовой анализ в испытаниях эффективности вакцины против ВИЧ-1. Curr. Opin. ВИЧ СПИД 8 , 432–436. https://doi.org/10.1097/COH.0b013e328362db2b (2013).
КАС Статья PubMed Google Scholar
Rolland, M. et al. Повышенная эффективность вакцины против ВИЧ-1 против вирусов с генетическими сигнатурами в Env V2. Природа 490 , 417–420.https://doi.org/10.1038/nature11519 (2012).
КАС Статья PubMed PubMed Central ОБЪЯВЛЕНИЯ Google Scholar
Herbeck, J. T. et al. Адаптация на уровне популяции с ВИЧ может быстро уменьшить воздействие частично эффективной вакцины. Вакцина 36 , 514–520. https://doi.org/10.1016/j.vaccine.2017.12.004 (2018).
Артикул PubMed Google Scholar
Марчева М., Болкер Б. М. и Холт Р. Д. Индуцированная вакциной замещение штамма патогена: каковы механизмы ?. J. R. Soc. Интерфейс 5 , 3–13. https://doi.org/10.1098/rsif.2007.0236 (2008).
Артикул PubMed Google Scholar
Рид, А. и Маккиннон, М. In Evolution in Health and Disease 2nd edn (eds Stearns, S. C. & Koella, J.) 139–152 (Oxford University Press, 2008).
Google Scholar
Итон, Л. А. и Каличман, С. Компенсация риска в профилактике ВИЧ: последствия для вакцин, микробицидов и других биомедицинских технологий профилактики ВИЧ. Curr. HIV / AIDS Rep. 4 , 165–172 (2007).
Артикул Google Scholar
Уайлд, Г. Дж. С. Целевой риск: устранение опасности смерти, заболевания и ущерба в повседневных решениях (PDE Publications, 1994).
Google Scholar
Newman, P. A. et al. Приемлемость профилактической вакцины против ВИЧ и компенсация поведенческого риска среди случайной выборки взрослых из групп высокого риска в Лос-Анджелесе (LA VOICES). Health Serv. Res. 44 , 2167–2179. https://doi.org/10.1111/j.1475-6773.2009.01039.x (2009 г.).
Артикул PubMed PubMed Central Google Scholar
Ли, С. Дж., Ньюман, П. А., Дуан, Н. и Каннингем, У. Э. Разработка шкалы отношения к вакцине против ВИЧ для прогнозирования приемлемости вакцины против ВИЧ среди уязвимых групп населения: L.A. VOICES. Вакцина 32 , 5013–5018. https://doi.org/10.1016/j.vaccine.2014.07.018 (2014).
Артикул PubMed PubMed Central Google Scholar
Ньюман, П. А., Рунгпрахон, С., Тепджан, С. и Йим, С. Приемлемость профилактической вакцины против ВИЧ и компенсация поведенческого риска среди мужчин из группы высокого риска, практикующих секс с мужчинами, и трансгендеров в Таиланде. Вакцина 28 , 958–964. https://doi.org/10.1016/j.vaccine.2009.10.142 (2010).
КАС Статья PubMed Google Scholar
Талли, С., Кожокару, М. и Бауч, К. Т. Сексуальное поведение, восприятие риска и передача ВИЧ могут реагировать на противовирусные препараты и вакцины против ВИЧ различными путями. Sci. Отчет 5 , 15411. https://doi.org/10.1038/srep15411 (2015).
КАС Статья PubMed PubMed Central ОБЪЯВЛЕНИЯ Google Scholar
Брюер, Н. Т., Куите, К. Л., Херрингтон, Дж. Э. и Вайнштейн, Н. Д. Компенсация риска и вакцинация: может ли вакцинация привести к рискованному поведению людей? Ann. Behav. Med. 34 , 95–99. https://doi.org/10.1007/BF02879925 (2007).
Артикул PubMed Google Scholar
Grant, R. M. et al. Распространенность доконтактной профилактики, сексуальные практики и заболеваемость ВИЧ среди мужчин и трансгендерных женщин, имеющих половые контакты с мужчинами: когортное исследование. Lancet Infect. Дис. 14 , 820–829. https://doi.org/10.1016/s1473-3099(14)70847-3 (2014).
Артикул PubMed PubMed Central Google Scholar
McCormack, S. et al. Доконтактная профилактика для предотвращения заражения ВИЧ-1 (PROUD): эффективность определяется пилотной фазой прагматичного открытого рандомизированного исследования. Ланцет 387 , 53–60.https://doi.org/10.1016/s0140-6736(15)00056-2 (2016).
Артикул PubMed PubMed Central Google Scholar
Lal, L. et al. Приверженность к лечению, использование презервативов и инфекции, передаваемые половым путем, у австралийских пользователей предконтактной профилактики. AIDS (Лондон, Англия) 31 , 1709–1714. https://doi.org/10.1097/qad.0000000000001519 (2017).
Артикул Google Scholar
Hoornenborg, E. et al. Изменение рискованного сексуального поведения после шести месяцев использования предконтактной профилактики: результаты демонстрационного проекта PrEP в Амстердаме. AIDS https://doi.org/10.1097/qad.0000000000001874 (2018).
Артикул PubMed Google Scholar
Montaño, M.A. et al. в Международный союз против ИППП Всемирный и Европейский Конгресс.
Jenness, S. M. et al. Индивидуальный риск ВИЧ в сравнении с воздействием компенсации риска на население после начала предконтактной профилактики ВИЧ среди мужчин, практикующих секс с мужчинами. PLoS ONE 12 , e0169484. https://doi.org/10.1371/journal.pone.0169484 (2017).
КАС Статья PubMed PubMed Central Google Scholar
Ortblad, K. F. et al. Нет доказательств компенсации сексуального риска после начала PrEP среди гетеросексуальных серодискордантных пар в отношении ВИЧ в Кении и Уганде. AIDS Behav. 24 , 1365–1375. https://doi.org/10.1007/s10461-019-02720-4 (2020).
Артикул PubMed Google Scholar
Auvert, B. et al. Рандомизированное контролируемое интервенционное исследование мужского обрезания для снижения риска заражения ВИЧ: исследование ANRS 1265. PLoS Med. 2 , e298. https://doi.org/10.1371/journal.pmed.0020298 (2005).
Артикул PubMed PubMed Central Google Scholar
Gray, R.H. et al. Обрезание мужчин для профилактики ВИЧ-инфекции у мужчин в Ракаи, Уганда: рандомизированное испытание. Ланцет 369 , 657–666. https://doi.org/10.1016/s0140-6736(07)60313-4 (2007).
Артикул PubMed Google Scholar
Bailey, R.C. et al. Мужское обрезание для профилактики ВИЧ у молодых мужчин в Кисуму, Кения: рандомизированное контролируемое исследование. Ланцет 369 , 643–656.https://doi.org/10.1016/s0140-6736(07)60312-2 (2007).
Артикул PubMed Google Scholar
Ortblad, K. F. et al. Приводит ли случайное обрезание к компенсации риска? Данные из когорты населения в Квазулу-Натале, Южная Африка. J. Acquir. Иммунодефицит. Syndr. 1999 (80), 269–275. https://doi.org/10.1097/QAI.0000000000001912 (2019).
Артикул Google Scholar
Agot, K.E. et al. Обрезание мужчин в округах Сиая и Бондо, Кения: проспективное когортное исследование для оценки поведенческого растормаживания после обрезания. J. Acquir. Иммунодефицит. Syndr. 1999 (44), 66–70. https://doi.org/10.1097/01.qai.0000242455.05274.20 (2007).
Артикул Google Scholar
Ши, К. Ф., Ли, М. и Душофф, Дж. Доказательства того, что продвижение мужского обрезания не привело к компенсации сексуального риска в приоритетных странах к югу от Сахары. PLoS ONE 12 , e0175928. https://doi.org/10.1371/journal.pone.0175928 (2017).
КАС Статья PubMed PubMed Central Google Scholar
Auvert, B. et al. Ассоциация проекта мужского обрезания ANRS-12126 с уровнями ВИЧ среди мужчин в южноафриканском городке: оценка эффективности с помощью перекрестных опросов. PLoS Med. 10 , e1001509.https://doi.org/10.1371/journal.pmed.1001509 (2013).
Артикул PubMed PubMed Central Google Scholar
Gray, R. et al. Эффективность мужского обрезания для профилактики ВИЧ и влияние на рискованное поведение в последующем последующем исследовании. AIDS (Лондон, Англия) 26 , 609–615. https://doi.org/10.1097/QAD.0b013e3283504a3f (2012).
Артикул Google Scholar
Westercamp, M. et al. Изменения в распространенности мужского обрезания и компенсации риска среди населения Кисуму, Кения, 2008–2013 гг. J. Acquir. Иммунодефицит. Syndr. 1999 (74), e30 – e37. https://doi.org/10.1097/qai.0000000000001180 (2017).
Артикул Google Scholar
Hontelez, J. A. et al. Потенциальное воздействие вакцин, подобных RV144, в сельских районах Южной Африки: исследование с использованием модели микросимуляции STDSIM. Вакцина 29 , 6100–6106. https://doi.org/10.1016/j.vaccine.2011.06.059 (2011).
Артикул PubMed PubMed Central Google Scholar
Андерссон, К. М., Палтиель, А. Д. и Оуэнс, Д. К. Потенциальное влияние вакцины против ВИЧ с быстро ослабевающей защитой на эпидемию в южной части Африки: изучение результатов испытаний RV144. Вакцина 29 , 6107–6112. https: // doi.org / 10.1016 / j.vaccine.2011.06.076 (2011).
Артикул PubMed PubMed Central Google Scholar
Selinger, C. et al. Целенаправленность и долговечность вакцины являются ключевыми факторами воздействия на население и экономической эффективности схемы вакцинации против оспы и протеина против ВИЧ в Южной Африке. Вакцина 37 , 2258–2267. https://doi.org/10.1016/j.vaccine.2019.02.073 (2019).
Артикул PubMed PubMed Central Google Scholar
Адамсон, Б., Димитров, Д., Девайн, Б. и Барнабас, Р. Потенциальная экономическая эффективность вакцин против ВИЧ: систематический обзор. PharmacoEconomics Открыть 1 , 1–12. https://doi.org/10.1007/s41669-016-0009-9 (2017).
Артикул PubMed PubMed Central Google Scholar
Лонг, Э. Ф. и Оуэнс, Д. К. Экономическая эффективность умеренно эффективной вакцины против ВИЧ в США. Вакцина 29 , 6113–6124.https://doi.org/10.1016/j.vaccine.2011.04.013 (2011).
Артикул PubMed PubMed Central Google Scholar
Нагелькерке, Н. Дж., Хонтелес, Дж. А. и де Влас, С. Дж. Потенциальное влияние вакцины против ВИЧ с ограниченной защитой на заболеваемость ВИЧ в Таиланде: модельное исследование. Вакцина 29 , 6079–6085. https://doi.org/10.1016/j.vaccine.2011.06.048 (2011).
Артикул PubMed Google Scholar
Cotton, L.A. et al. Генотипическое и функциональное влияние адаптации ВИЧ-1 на популяцию хозяина во время эпидемии в Северной Америке. PLoS Genet. 10 , e1004295. https://doi.org/10.1371/journal.pgen.1004295 (2014).
КАС Статья PubMed PubMed Central Google Scholar
Schellens, I. M. et al. Потеря производных от ВИЧ-1 эпитопов цитотоксических Т-лимфоцитов, ограниченных защитными аллелями HLA-B, во время эпидемии ВИЧ-1. AIDS (Лондон, Англия) 25 , 1691–1700. https://doi.org/10.1097/QAD.0b013e32834981b3 (2011 г.).
КАС Статья Google Scholar
Kawashima, Y. et al. Адаптация ВИЧ-1 к человеческому лейкоцитарному антигену I класса. Природа 458 , 641–645. https://doi.org/10.1038/nature07746 (2009 г.).
КАС Статья PubMed PubMed Central ОБЪЯВЛЕНИЯ Google Scholar
Холт, М. и Мерфи, Д. А. Компенсация индивидуального риска по сравнению с компенсацией риска на уровне общины после профилактики ВИЧ до контакта. Am. J. Общественное здравоохранение 107 , 1568–1571. https://doi.org/10.2105/ajph.2017.303930 (2017).
Артикул PubMed PubMed Central Google Scholar
Янг, А. М., Халгин, Д. С., Диклементе, Р. Дж., Стерк, К. Э. и Хавенс, Дж. Р. Изменит ли вакцинация против ВИЧ сети поведения, связанного с риском заражения ВИЧ? Анализ социальной сети ожидаемой компенсации риска потребителям наркотиков. PLoS ONE 9 , e101047. https://doi.org/10.1371/journal.pone.0101047 (2014).
КАС Статья PubMed PubMed Central ОБЪЯВЛЕНИЯ Google Scholar
Шисана, О. и Лейкнесс, С. Нельсон Мандела Исследование HSRC по ВИЧ / СПИДу: полный отчет Национальная распространенность ВИЧ в Южной Африке, поведенческие риски и средства массовой информации. Обследование домохозяйств 2002 г. (HSRC Press, Кейптаун, 2002 г.).
Шисана, О., Рехле, Т., Симбайи, Л., Паркер, В., Зума, К., Бхана, А., Коннолли, К., Джуст, С., Пиллэй, В. (ред.). Национальное исследование распространенности, заболеваемости и поведения ВИЧ в Южной Африке, 2012 г. (HSRC Press, Кейптаун, 2005 г.).
Шисана, О., Рехле, Т., Симбайи, Л.С., Зума, К., Йусте, С., Пиллай-Ван Вик, В., Мбелле, Н., Ван Зил, Дж., Паркер , В., Зунгу, Н.П., Пези, С. и группа внедрения SABSSM III. Национальное исследование распространенности, заболеваемости, поведения и коммуникации в Южной Африке, 2008 г .: поворотный момент среди подростков? (HSRC Press, Кейптаун, 2009 г.).
Шисана, О., Рехле, Т., Симбайи, Л.С., Зума, К., Йусте, С., Зунгу, Н., Лабадариос, Д. и Оноя, Д. Национальная распространенность ВИЧ в Южной Африке, Исследование заболеваемости и поведения, 2012 г. (HSRC Press, Кейптаун, 2014 г.).
Национальные институты здравоохранения. (2017). Основное исследование фазы 2b / 3 ALVAC / бивалентного gp120 / MF59 по профилактике безопасности и эффективности вакцины против ВИЧ в Южной Африке ( HVTN702 ). https://clinicaltrials.gov/ct2/show/NCT02968849.
Хэнкинс, К. А., Глассер, Дж. У. и Чен, Р. Т. Моделирование воздействия вакцин, подобных RV144, на передачу ВИЧ. Вакцина 29 , 6069–6071. https://doi.org/10.1016/j.vaccine.2011.07.001 (2011).
Артикул PubMed PubMed Central Google Scholar
Хьюз, А. Дж., Чен, Ю. Х. и Шеер, С. Анальный секс без презерватива среди ВИЧ-позитивных мужчин, имеющих половые контакты с мужчинами: биомедицинский контекст имеет значение. AIDS Behav. 21 , 2886–2894. https://doi.org/10.1007/s10461-017-1852-0 (2017).
Артикул PubMed Google Scholar
Salomon, J. A. et al. Общие ценности при оценке последствий для здоровья в результате болезней и травм: исследование по измерению весов инвалидности для Глобального исследования бремени болезней 2010. Lancet 380 , 2129–2143. https://doi.org/10.1016/S0140-6736(12)61680-8 (2012).
Артикул PubMed Google Scholar
Статистическое управление Южной Африки. (Претория, 2017).
Meyer-Rath, G., Over, M., Klein, DJ & Bershteyn, A. Стоимость и рентабельность альтернативных стратегий по расширению лечения ВИЧ-позитивных южноафриканцев: экономия на масштабе и охват Стоимость (Центр глобального развития, 2015).
Google Scholar
Всемирная организация здравоохранения. Всемирная организация здравоохранения (Швейцария, 2003 г.).
Google Scholar
вакцин против ВИЧ: новые рубежи в разработке вакцин | Клинические инфекционные болезни
Аннотация
Вакцина против вируса иммунодефицита человека (ВИЧ) является наиболее многообещающей и осуществимой стратегией для предотвращения событий во время острой инфекции, которые одновременно определяют ход эпидемии в обществе и течение болезни для отдельного человека.Поскольку соображения безопасности ограничивают использование живых аттенуированных и инактивированных ВИЧ, исследуются различные альтернативные подходы. Традиционные опосредованные антителами подходы с использованием рекомбинантных белков оболочки ВИЧ не показали эффективности в 2 исследованиях фазы III. Текущие испытания вакцины против ВИЧ сосредоточены в первую очередь на продуктах, опосредованных цитотоксическими Т-лимфоцитами, в которых используются вирусные векторы либо сами по себе, либо в качестве стимуляторов ДНК-плазмид, содержащих вирусные гены. Наиболее иммуногенными из этих продуктов являются рекомбинантные аденовирусные векторные вакцины, 2 из которых в настоящее время находятся на продвинутой стадии клинической разработки.
Пандемия вируса иммунодефицита человека (ВИЧ) продолжается уже третье десятилетие. На сегодняшний день около 20 миллионов человек умерли от СПИДа, и около 14 000 человек заражаются ВИЧ каждый день. Стратегии профилактики, включая поведенческие вмешательства, лечение антибиотиками других заболеваний, передаваемых половым путем, помимо ВИЧ (таких как сифилис), и предварительный скрининг продуктов крови, не смогли контролировать распространение ВИЧ-инфекции во многих группах населения. Антиретровирусная терапия остается крайне недостаточной для удовлетворения потребностей всех, кто нуждается в лечении от ВИЧ-инфекции.Даже если бы можно было использовать антиретровирусную терапию для лечения всех людей с ВИЧ-инфекцией, ее нельзя было бы начать достаточно быстро, чтобы предотвратить критические ранние события, такие как усиление передачи сексуальным партнерам во время всплеска виремии ВИЧ, связанной с острой инфекцией [ 1] и массовое разрушение кишечных CD4 + Т-клеток, которое происходит в первые недели ВИЧ-инфекции [2].
Вакцина против ВИЧ — это наиболее многообещающая и осуществимая стратегия для предотвращения этих событий, которые влияют как на течение заболевания, так и на передачу.Тем не менее, несмотря на первоначальный оптимизм и оценку> 30 продуктов в> 85 испытаниях, поиск вакцины против ВИЧ еще не достиг своей цели по прошествии> 20 лет. Хотя нет установленных коррелятов защиты и нет кандидатов, способных вызывать стерилизующий иммунитет, в последние годы в этой области наблюдается быстрое расширение числа и типов вакцин-кандидатов. Хотя спонтанного исчезновения ВИЧ-инфекции, которое связано с естественным иммунитетом, не наблюдалось, испытания на животных моделях предполагают, что индуцированный вакциной клеточный иммунитет снижает виремию ВИЧ и предотвращает потерю Т-клеток CD4 + .Текущие испытания будут проверять, приводит ли индуцированный вакциной иммунитет к улучшению течения болезни. Хотя разработка безопасной и эффективной вакцины против ВИЧ во всем мире является сложной задачей, это, пожалуй, самый высокий приоритет общественного здравоохранения в мире.
Ключевые биологические аспекты проблемы
Хотя корреляты защиты и животных моделей облегчат поиск вакцины против ВИЧ 3, фундаментальные биологические свойства вируса делают ВИЧ коварным противником.Во-первых, как и все ретровирусы, ВИЧ быстро подвергается обратной транскрипции и интегрируется в ДНК хозяина, тем самым создавая плацдарм для пожизненной инфекции. Результирующий резервуар латентно инфицированных CD4 + Т-клеток означает, что без индукции стойкого стерилизующего иммунитета вакцины против ВИЧ вряд ли смогут предотвратить стойкую инфекцию. Во-вторых, ВИЧ-инфекция постепенно отключает сам иммунный ответ хозяина, необходимый для эффективности вакцины и контроля репликации вируса. Хотя прямое разрушение инфицированных CD4 + Т-хелперных клеток является основным механизмом этой иммунной дисфункции, неинфицированные клетки иммунной системы также могут быть истощены или функционально нарушены в результате.
Постоянно развивающиеся антигенные вариации ВИЧ представляют собой третью серьезную проблему для разработки вакцины. На основе последовательностей полноразмерного генома ВИЧ классифицируется на 3 основные группы: M (основная), O (выбросы) и N (не-M, не-O). Подавляющее большинство подтипов ВИЧ принадлежит к группе M, которая включает 22 циркулирующих генетических формы. Девять из этих форм обозначены как подтипы ВИЧ или «клады» (подтипы A – D, F – H, J – K), которые различаются примерно на 25–35% в последовательностях env и на 15% в последовательностях gag . [3].Идентифицируется все больше новых циркулирующих рекомбинантных форм. Огромная глобальная изменчивость штаммов ВИЧ (рис. 1), которая превосходит вариацию других возбудителей, предотвращаемых с помощью вакцин, таких как вирус гриппа [4], вызывает озабоченность по поводу того, могут ли вакцины-кандидаты эффективно защитить от широкого разнообразия вакцин, циркулирующих в мире. Вероятно, потребуются новые подходы к составлению многовариантных вакцин.
Рисунок 1
Глобальное распределение подтипов и рекомбинантов ВИЧ-1.Воспроизведено с разрешения отчета Международной инициативы по вакцине против СПИДа, опубликованного Международной инициативой по вакцине против СПИДа. (Источник: Ф. Э. Маккатчан и международные коллеги, Фонд Генри М. Джексона, личное сообщение).
Рисунок 1
Глобальное распределение подтипов и рекомбинантов ВИЧ-1. Воспроизведено с разрешения отчета Международной инициативы по вакцине против СПИДа, опубликованного Международной инициативой по вакцине против СПИДа. (Источник: Ф. Э. Маккатчан и международные коллеги Генри М.Фонд Джексона, личное сообщение).
Поскольку клеточные ответы на естественную инфекцию или иммунизацию обычно шире, чем гуморальные ответы, перекрестные цитотоксические Т-лимфоциты (CTL) выявляются у людей, инфицированных одним подтипом ВИЧ [5]. Вакцинация продуктами, направленными против вирусов подтипа B, приводит к ответам CTL, которые распознают несколько подтипов, хотя внутрикладные ответы обычно наиболее сильны [5–13]. Этот перекрестный ответ обусловлен не только генерацией CTL, которые распознают консервативные эпитопы, общие для нескольких клад, но также неразборчивостью рецептора Т-клеток, который может приспособиться к вариабельности в эпитопах, которые он распознает.Однако побег из CTL-опосредованного сдерживания хорошо описан.
Подходы к разработке профилактических вакцин против ВИЧ
Традиционная стратегия: стимуляция нейтрализующих антител. В идеале, все профилактические вакцины против ВИЧ должны предотвращать ВИЧ-инфекцию, обеспечивая стерилизующий иммунитет за счет стимуляции высоких титров широко нейтрализующих антител. Действительно, большинство лицензированных вакцин зависят в первую очередь от таких ответов [14]; в 1990-х годах эксперименты на нечеловеческих приматах показали, что пассивный перенос нейтрализующих антител может защитить от экспериментального заражения лентивирусами приматов [15-17].Поэтому первоначальная стратегия разработки вакцины против ВИЧ использовала рекомбинантные белки оболочки ВИЧ (gp160 или gp120) в попытке вызвать нейтрализующие антитела. Большое разнообразие этих белков вводили с различными адъювантами. Хотя эти продукты оказались очень безопасными [18–20], вызванные ими ответы антител, как правило, имели низкий титр, узкую широту и ограниченную способность нейтрализовать первичные изоляты (т. Е. Вирусы, выделенные от недавно инфицированных лиц) [21 ].Два недавних испытания продуктов rgp120 фазы III оценивали кандидата клады B в США, Канаде и Европе и смесь клады B / E в Таиланде. Ни вакцина, ни вакцина не предотвратили инфекцию или не улучшили течение постинфекции [22–25].
Некоторые особенности оболочки ВИЧ способствуют ее способности уклоняться от эффективного наблюдения со стороны гуморальной иммунной системы. Оболочка ВИЧ представляет собой тример гетеродимеров. Каждый гетеродимер состоит из поверхностной субъединицы (gp120) и трансмембранной субъединицы (gp41), которые нековалентно связаны друг с другом.Поддержание этой нативной тримерной структуры, по-видимому, необходимо для индукции продукции нейтрализующих антител. Напротив, нативная структура оболочки ВИЧ защищает ее от многих потенциально нейтрализующих эпитопов, таких как сайт связывания корецептора, который становится доступным только после связывания CD4 + Т-клеток [26]. Сходным образом исследования мутационных замен сайтов гликозилирования показали, что изменения в этих сайтах влияют на нейтрализацию удаленных эпитопов [27].
Было описано несколько человеческих моноклональных антител, которые обладают широкой нейтрализующей активностью, и их исследование может дать представление о дизайне вакцины.Эти антитела включают F105 и b12, которые специфичны к сайту связывания Т-клеток CD4 + на gp120; 2G12, который распознает сложный эпитоп на gp120; и 2F5 и 4E10, которые распознают линейные эпитопы на gp41 (рисунок 2) [28]. Комбинации этих моноклональных антител обнаруживают сильную нейтрализацию перекрестной клады против клад A, B, C и D in vitro, а также сильную противовирусную защиту у новорожденных макак [29, 30]. Использование этих эпитопов при разработке вакцин является предметом интенсивных исследований.Например, моноклональное антитело b12 имеет необычный протяженный антигенсвязывающий палец, который обращается к обычно утопленному эпитопу на gp120, тем самым блокируя связывание с Т-клетками CD4 + [26]. Более того, антитела, которые нацелены на домены gp41, участвующие в слиянии вируса с клеткой-мишенью, как это делают 2F5 и 4E10, могут быть ограничены стерическими препятствиями и скоростью процесса слияния [26, 31]. Понимание того, как разработать иммуногены, которые могут имитировать эффекты этих моноклональных антител и которые могут вызывать выработку эффективных нейтрализующих антител к широкому спектру циркулирующих штаммов ВИЧ, остается сложной задачей.
Рисунок 2
Схема, показывающая расположение нейтрализующих эпитопов антител на gp120 и gp 41 (показано в нативной форме и временной прешпильчатой форме). Воспроизведено с разрешения из [28].
Фигура 2
Схема, показывающая расположение нейтрализующих эпитопов антител на gp120 и gp 41 (показано в нативной форме и временной прешпильчатой форме). Воспроизведено с разрешения из [28].
Текущая стратегия: стимулирование клеточного иммунитета. Столкнувшись с неэффективностью продуктов, предназначенных для индукции выработки нейтрализующих антител, разработка вакцины против ВИЧ сместила основной акцент на клеточный иммунитет. В большинстве текущих испытаний тестируются вакцины-кандидаты, которые должны индуцировать выработку ВИЧ-специфических CTL. Эти иммунные эффекторные клетки распознают эпитопы ВИЧ, которые отображаются на поверхности клеток вместе с лейкоцитарным антигеном человека, но не распознают свободные вирусы. Они ограничивают распространение ВИЧ-инфекции, уничтожая инфицированные клетки посредством апоптоза или выделяя хемокины и цитокины, которые препятствуют последующим раундам инфекции.
Работа с нечеловеческими приматами показывает, что вакцины, которые вызывают выработку ВИЧ-специфических CTL, вероятно, действуют путем ограничения репликации ВИЧ, тем самым снижая нагрузку ВИЧ у инфицированных людей, а не предотвращая заражение ВИЧ. У некоторых животных репликация вируса, по-видимому, полностью подавляется при использовании этих вакцин, тогда как ограниченная остаточная репликация вируса продолжается у других животных [32–34]. У людей заданная вирусная нагрузка предсказывает последующее течение заболевания [35], тогда как передача половым партнерам коррелирует с вирусной нагрузкой в плазме и может быть полностью предотвращена, когда вирусная нагрузка снижается до <1500 копий / мл [36].Таким образом, ВИЧ-специфические CTL могут смягчить эффекты ВИЧ-инфекции на индивидуальном и популяционном уровне, даже если они не предотвращают заражение самой инфекцией.
Соображения при разработке вакцины. С 1798 года, когда Эдвард Дженнер основал эру вакцины своим трактатом о грызунах вакцины [37], использовались 5 основных подходов к созданию вирусной вакцины (таблица 1). Два наиболее эффективных подхода включают использование живых ослабленных организмов и инактивированных организмов.К сожалению, ни один из них не оказался оптимальным для разработки вакцины против ВИЧ. Живые аттенуированные вирусные вакцины первоначально оказались успешными в предотвращении экспериментального заражения нечеловеческих приматов [38, 39]; однако аттенуированные мутанты ВИЧ, по-видимому, являются патогенными для людей: иммуносупрессия с поздним началом произошла у 3 из 6 индивидуумов, подвергшихся воздействию ВИЧ, несущим делеции как в nef , так и в длинном концевом повторе [38, 39]. Отсроченная патогенность такого вируса с двойной делецией ставит под сомнение безопасность использования живых аттенуированных подходов.
Таблица 1
Возможные преимущества и недостатки основных стратегий разработки вакцины против ВИЧ.
Таблица 1
Возможные преимущества и недостатки основных стратегий разработки вакцины против ВИЧ.
Было протестировано множество убитых вакцин, малоэффективных на моделях нечеловеческих приматов [38, 39]. Интерес к применению этого подхода был ограничен отсутствием индуцируемого Т-клеточного иммунитета и опасениями по поводу безопасности, касающимися потенциальной остаточной инфекционности продукта из-за неполной инактивации (например, той, которая произошла во время инцидента Каттера с вакциной от полиомиелита Солка [40]). .
В других подходах к разработке вакцины использовались вирусные белки, пептиды или субъединицы, плазмиды ДНК, несущие вирусные гены, и другие вирусы или бактерии в качестве векторов «троянского коня» для доставки вирусных генов. Как обсуждалось выше, белки оболочки ВИЧ не доказали свою эффективность в 2-х фазовых испытаниях вакцин [22–24] (таблица 2). Таким образом, основной упор в текущих испытаниях вакцин против ВИЧ сместился на вирусные векторы, отдельно или в комбинации с ДНК-плазмидными вакцинами (таблица 2).
Таблица 2
Вакцины-кандидаты против ВИЧ, проходящие клинические испытания.
Таблица 2
Вакцины-кандидаты от ВИЧ, проходящие клинические испытания.
ДНК-плазмиды, доставляющие вирусные гены, кодирующие эпитопы ВИЧ, не интегрируются в клетки-хозяева вакцинированных лиц. Они остаются эписомальными и действуют как векторы экспрессии, продуцируя пептиды, которые могут индуцировать клеточный иммунитет. В отличие от вирусных или бактериальных векторов, продукция белка в ответ на ДНК-вакцины может сфокусировать иммунный ответ более узко на последовательностях вставки ВИЧ. Хотя иммунизация ДНК-плазмидами, содержащими вставки ВИЧ, вызвала существенные клеточные ответы у мышей и нечеловеческих приматов, эти продукты были слабо иммуногенны для людей.Одна из стратегий усиления иммунного ответа включает генетические адъюванты, в частности, совместное введение ДНК-плазмид, кодирующих цитокины (в первую очередь, IL-12 и IL-15).
Второй подход к усилению иммунного ответа использует ДНК в качестве прайма, за которым следует усиление белка или вирусного вектора. Эксперименты на нечеловеческих приматах дали многообещающие результаты. Например, животные, примированные ДНК, а затем усиленные вакцинами против поксвируса (модифицированная вакцина Анкара или оспа птиц), демонстрировали сильные Т-клеточные ответы CD8 + [41, 42] и контролируемую вирусемию после парентерального введения или заражения слизистой оболочки [43, 44].В настоящее время наиболее многообещающим кандидатом ДНК является мультикладная конструкция, разработанная Центром исследования вакцин (VRC) Национального института здравоохранения, которая экспрессирует клады A, B и C гена env и кладу B гена gag , pol и nef гены [45]. Ранние данные предполагают, что эта вакцина вызывает выработку антител и Т-клеточные ответы CD4 + у большинства вакцинированных, а также Т-клеточные ответы CD8 + у 35% вакцинированных [46].
Хотя при разработке вакцин против ВИЧ изучаются несколько вирусных векторов, наибольшее внимание привлекли поксвирусы и аденовирусы. Самый обширный опыт испытаний был связан с поксвирусными векторами; более десятка в настоящее время проходят клинические испытания. В ранних испытаниях оценивались продукты с вектором вакцины; 2 наиболее часто изучаемых из этих продуктов вызывали клеточные иммунные ответы на антигены вируса иммунодефицита обезьян на моделях приматов, отличных от человека, и на антигены ВИЧ у испытуемых людей [47, 48].Однако опасения по поводу ранее существовавшего иммунитета к поксвирусным векторам и потенциального распространения осповакцины в районах с высокой распространенностью иммунодефицитных людей привели к созданию более аттенуированных поксвирусных векторов [49].
Среди поксвирусов наиболее изучены вектор канареечной оспы и 2 аттенуированных штамма осповакцины, модифицированная осповакцина Анкара и штамм New York. Изначально модифицированная вакцина Анкара использовалась в Турции для производства противооспенной вакцины.
В 1950-х годах этот штамм был завезен в Германию, где он был дополнительно ослаблен путем многократного прохождения через фибробласты куриного эмбриона — процесс, который привел к накоплению множественных мутаций и удалению ~ 15% генома [50].Очень благоприятный профиль безопасности был отмечен у 120 000 вакцинированных, получивших этот продукт в Турции и Германии в рамках кампании против оспы. Модифицированная вакцина Анкара впоследствии использовалась в экспериментальных вакцинах против ВИЧ, малярии и рака [50]. Штамм осповакцины New York был разработан путем делеции 18 открытых рамок считывания и блокируется на ранней стадии репликации [51]. Эти аттенуированные вирусы сохраняют небольшую способность к репликации в человеческих клетках или не имеют ее вообще, но они могут вызывать гуморальные и клеточные ответы на вакцинные вставки и вирусные последовательности.
К сожалению, хотя большинство рекомбинантных вакцин против ВИЧ, использующих поксвирусные векторы, эффективны на моделях нечеловеческих приматов [41, 44, 52, 53], они обладают гораздо более ограниченной иммуногенностью для людей. Например, первоначальные испытания модифицированных векторов осповакцины Анкара на людях были разочаровывающими — только 10–25% участников испытаний режима ДНК / модифицированной осповакцины Анкара показали клеточный ответ против ВИЧ с помощью ELISPOT [54]. Другие прототипы вакцин, в которых используются другие вставки и промоторы, недавно вступили в клинические испытания.Данные, указывающие, проявляют ли эти конструкции повышенную иммуногенность, ожидаются.
Векторы канареечной оспы также широко изучались на людях. Пять различных конструкций канареек, содержащих гены B и E клады ВИЧ-1, были протестированы на> 1500 субъектах. Эти векторы очень хорошо переносятся испытуемыми с уровнями реактогенности, сопоставимыми с таковыми у лицензированных в настоящее время вакцин [19]. Однако, как и большинство поксвирусных векторов, вакцины против канареек не вызвали стойких CTL-ответов.В анализах высвобождения хрома, в которых поствакцинальные PBMC стимулируются ВИЧ-1, около 40–50% вакцинированных демонстрируют Т-клеточные ответы [20, 55, 56]. Однако в более количественных анализах ex vivo уровень иммуногенности намного ниже (<20% вакцинированных) [57]. В январе 2006 г. завершился набор в исследование фазы III в Таиланде вектора оспы канареек (vCP 1521), содержащего гены env клады B ВИЧ-1, gag и протеазы в сочетании с gp120 (клады B и E); наблюдение продолжается.
Рекомбинантные векторы аденовируса типа 5 (Ad5) являются наиболее иммуногенными вирусными векторами при разработке вакцины против ВИЧ на сегодняшний день. Эти вирусные векторы становятся репликационно-дефектными из-за мутаций и делеции гена аденовируса; Гены ВИЧ вставляются вместо удаленного гена аденовируса под контролем экзогенных промоторов и регуляторных элементов, которые управляют экспрессией генов высокого уровня. Аденовирусы, неспособные к репликации, сохраняют способность инфицировать клетки и доставлять свои геномы в ядра этих клеток.Два разных продукта, оба с использованием некомпетентных к репликации основ Ad5, в настоящее время находятся на продвинутой стадии клинической разработки. Первый, произведенный Merck, представляет собой смесь 3 аденовирусов, каждый из которых содержит гены gag подтипа B с оптимизированными кодонами, гены pol или nef . Эти 3 гена ВИЧ являются высококонсервативными (от 80% до> 90%) для всех подтипов. Аденовирусные векторы Merck, которые содержат только ген gag или представляют собой трехвалентный препарат, содержащий гены gag, pol и nef , продуцируют устойчивые ответы CTL CD8 + у макак (500–1000 IFN-γ– продуцирующих клеток / 10 6 PBMC после вакцинации 10 11 вирусных частиц) [58, 59].
Второй кандидат Ad5, разработанный VRC Национального института здравоохранения, представляет собой смесь 4 аденовирусов, 1 из которых содержит слияние гена подтипа B gag — pol . Остальные 3 аденовируса содержат гены оболочки подтипа A, B или C. Эта конструкция VRC также вызвала сильные гуморальные и клеточные ответы у макак; величина и широта ответа были улучшены путем предварительного праймирования продукта плазмидами ДНК, описанными выше [45, 60].
Оба подхода (тригенная аденовирусная вакцина Merck и прайм-вакцина против аденовируса VRC) обеспечивали защиту на животных моделях.Вакцинированных макак внутривенно заражали SHIV 89.6P, патогенным вирусом иммунодефицита обезьян / химерным вирусом ВИЧ. Хотя защиты от инфекции не было, репликация ВИЧ подавлялась; Подопытные животные перенесли легкое течение инфекции, которое не привело к развитию СПИДа в течение периода наблюдения (280 дней в исследовании Merck и 168 дней в исследовании VRC) [34, 45, 61].
Хотя есть споры о том, насколько точно эти эксперименты будут предсказывать результаты на людях, эти результаты многообещающие; с этими продуктами Ad5 было проведено несколько испытаний фазы I [62, 63].Вакцины Merck Ad5 против ВИЧ на сегодняшний день безопасны и хорошо переносятся более чем 2000 участниками исследования [62]. Т-клеточные ответы были вызваны примерно у 70% участников испытаний, с несколько более низкими показателями ответа среди участников с предшествующим аденовирусным иммунитетом [62]. Интересно отметить, что по сравнению с моногенным продуктом Merck их мультигенная вакцина Ad5, по-видимому, увеличивает частоту и широту ответов и снижает несоответствие ответов между участниками с ранее существовавшим иммунитетом Ad5 и без него (таблица 3) [62].Схема вакцины против VRC, состоящая из 3 доз ДНК, усиленных Ad5, также вызывает гуморальные и клеточные ответы у большинства участников испытаний [63]. Следует отметить, что кандидат VRC Ad5, по-видимому, стимулирует более частые ответы CTL на антигены env , чем на продукты структурных генов.
Таблица 3
Сравнение ответов ELISPOT, вызванных только MRK gag и мультигенными вакцинами аденовируса типа 5.
Таблица 3
Сравнение ответов ELISPOT, вызванных только MRK gag и мультигенными вакцинами аденовируса типа 5.
Затупление иммунного ответа на вакцины Ad5 против ВИЧ из-за предшествующего иммунитета к вектору [58–60, 64] представляет потенциальную проблему для использования этого подхода в некоторых регионах, которые больше всего пострадали от пандемии ВИЧ, где высокий Распространенность -titer Ad5 быстро увеличивается с возрастом до 50–80% [65]. В настоящее время исследуется ряд стратегий для решения этой проблемы, включая использование аденовирусных векторов необычных серотипов, производство химерных аденовирусов, праймирование с помощью ДНК или комбинации прайм-буста Ad5 с другими аденовирусными или поксвирусными векторами [58–60].Несмотря на это ограничение, продукт Merck Ad5 проходит испытания на эффективность, и ожидается, что в 2007 году последует этому примеру режим первичной буст-вакцинации VRC. Merck и ВИЧ проводят испытание концепции с участием 3000 человек (исследование STEP). Сеть испытаний вакцин в США, Южной Америке и странах Карибского бассейна для оценки эффективности снижения уровня заражения ВИЧ или вирусной нагрузки [66]. VRC, Сеть испытаний вакцины против ВИЧ, Военная программа исследований ВИЧ в США и Международная инициатива по вакцинам против СПИДа совместно тестируют схему первичной буст-вакцинации ДНК-аденовируса, разработанную VRC, в ходе испытания фазы II в Северной и Южной Америке, а также в восточной и южной частях Африки, чтобы претендовать на ее участие. тестирование эффективности.
Выводы
В прошлом году разработка вакцины против ВИЧ вступила в эру испытаний эффективности вакцины, опосредованных CTL, с началом исследования сети испытаний вакцины против ВИЧ / Merck STEP. Вместе с другими текущими и предстоящими испытаниями это знаковое исследование определит, способны ли существующие вирусные векторные вакцины вызывать количество и качество Т-клеточных ответов, которые могут изменить течение индивидуальной и глобальной инфекции ВИЧ-1.
Благодарности
Мы благодарим Франсин МакКатчен, Робин Исаакс и Международную инициативу по вакцине против СПИДа за щедрый обмен данными для рисунков и таблиц рукописей; и Сесилию Морган, Маргарет Веккер, Ричарда Ньюмана, Эрика Шваба, Бенджамина Шеппарда и Алету Ховард за их выдающуюся помощь в подготовке этой рукописи.
Финансовая поддержка. Национальные институты здравоохранения / Национальный институт аллергии и инфекционных заболеваний UO1 AI-46747 (Сеть испытаний вакцины против ВИЧ).
Возможный конфликт интересов. Все авторы: без конфликтов.
Список литературы
1« и др.Уровень передачи ВИЧ-1 за половой акт, по стадиям ВИЧ-1 инфекции, в Ракаи, Уганда
,J Infect Dis
,2005
, vol.191
(стр.1403
—9
) 2« и др.CD4 + Истощение Т-лимфоцитов на всех стадиях заболевания ВИЧ происходит преимущественно в желудочно-кишечном тракте
,J Exp Med
,2004
, vol.200
(стр.749
—59
) 3,,,,.Молекулярная эпидемиология ВИЧ
,Indian J Med Res
,2005
, vol.121
(стр.333
—44
) 4,,,,,.Эволюционные и иммунологические последствия современной вариации ВИЧ-1
,Br Med Bull
,2001
, vol.58
(стр.19
—42
) 5« и др.Перекрестный цитотоксический Т-клеточный ответ на белки вируса иммунодефицита человека типа 1 среди HLA-несопоставимых североамериканцев и тайцев
,J Infect Dis
,1998
, vol.178
(стр.1040
—6
) 6« и др.Вакцины против ВИЧ-1 на основе Clade B вызывают реактивность перекрестных цитотоксических Т-лимфоцитов у неинфицированных добровольцев
,Proc Natl Acad Sci U S. A
,1997
, vol.94
(стр.1396
—401
) 7,,.Молекулярная эпидемиология генетических форм ВИЧ-1 и ее значение для разработки вакцин и терапии
,Lancet Infect Dis
,2002
, vol.2
(стр.461
—71
) 8« и др.Паттерны кластеризации эпитопов цитотоксических Т-лимфоцитов в белках вируса иммунодефицита человека типа 1 (ВИЧ-1) выявляют отпечатки иммунного уклонения в глобальной вариации ВИЧ-1.
,J Virol
,2002
, vol.76
(стр.8757
—68
) 9« и др.Генетическая изменчивость ВИЧ типа 1: значение межкладовой изменчивости для разработки вакцины
,AIDS Res Hum Retroviruses
,1998
, vol.14
Дополнение 3
(стр.211
—21
) 10« и др.Идентификация высококонсервативных и широко перекрестно-реактивных эпитопов цитотоксических Т-лимфоцитов ВИЧ типа 1 в качестве иммуногенов-кандидатов для включения в вакцины против ВИЧ Mycobacterium bovis BCG-векторные вакцины
,AIDS Res Hum Retroviruses
,2000
, vol.16
(стр.1433
—43
) 11« и др.Распознавание цитотоксическими Т-клетками кросс-кладовых и клад-специфических эпитопов ВИЧ-1 у ВИЧ-1-инфицированных тайских и японских пациентов
,AIDS
,2002
, vol.16
(стр.701
—11
) 12« и др.Кросс-клад-специфические цитотоксические Т-лимфоциты у ВИЧ-1-инфицированных детей
,Virology
,1998
, т.250
(стр.316
—24
) 13« и др.Перекрестный гликопротеин оболочки 160 CD8 + ответы цитотоксических Т-лимфоцитов при ранней инфекции клады B ВИЧ типа 1
,AIDS Res Hum Retroviruses
,1998
, vol.14
(стр.925
—37
) 14.Иммунологические корреляты защиты, индуцированной вакцинацией
,Pediatr Infect Dis J
,2001
, vol.20
(стр.63
—75
) 15« и др.Защита макак от патогенного вируса иммунодефицита обезьян / человека 89.6PD путем пассивного переноса нейтрализующих антител
,J Virol
,1999
, т.73
(стр.4009
—18
) 16« и др.Последствия пассивного введения нейтрализующего моноклонального антитела против вируса иммунодефицита человека типа 1 перед заражением шимпанзе изолятом первичного вируса
,J Virol
,1996
, vol.70
(стр.6751
—8
) 17« и др.Профилактика ВИЧ-1 инфекции у шимпанзе с помощью моноклональных антител к домену gp120 V3
,Nature
,1992
, vol.355
(стр.728
—30
) 18« и др.Долгосрочный анализ безопасности профилактических вакцин против ВИЧ-1, оцениваемых в группе оценки вакцины против СПИДа Клинические испытания фазы I и II, спонсируемые NIAID
,Vaccine
,2003
, vol.21
(стр.2933
—47
) 19« и др.Профиль безопасности рекомбинантных вакцин против ВИЧ от канареек
,Vaccine
,2004
, vol.22
(стр.704
—13
) 20« и др.Безопасность и иммуногенность высокотитровой вакцины против канареек в комбинации с rgp120 в разнообразной популяции взрослых, не инфицированных ВИЧ-1: протокол группы оценки вакцины против СПИДа 022A
,J Acquir Immune Defic Syndr
,2002
, vol.29
(стр.254
—61
) 21« и др.Иммунизация вакцинами на основе субъединиц оболочки выявляет нейтрализующие антитела против лабораторно адаптированных, но не первичных изолятов вируса иммунодефицита человека типа 1: Группа оценки вакцины против СПИДа Национального института аллергии и инфекционных заболеваний
,J Infect Dis
,1996
, vol. .173
(стр.340
—8
) 22« и др.Корреляция между иммунологическими ответами на вакцину с рекомбинантным гликопротеином 120 и заболеваемостью ВИЧ-1 в фазе 3 испытания превентивной вакцины против ВИЧ-1
,J Infect Dis
,2005
, vol.191
(стр.666
—77
) 23,.Уроки неудач: подготовка к будущим испытаниям эффективности вакцины против ВИЧ-1
,J Infect Dis
,2005
, vol.191
(стр.647
—9
) 24,,,,,.Плацебо-контролируемое испытание фазы 3 рекомбинантной вакцины гликопротеина 120 для предотвращения ВИЧ-1 инфекции
,J Infect Dis
,2005
, vol.191
(стр.654
—65
) 25.Эффективность вакцин AIDSVAX B / E при употреблении инъекционных наркотиков [аннотация 107]
,Программа и тезисы 11-й конференции по ретровирусам и оппортунизитным инфекциям (Сан-Франциско)
,2004
Александрия, Вирджиния
Фонд ретровирологии и Здоровье человека
стр.115
26,,.Перспективы вакцины против СПИДа: три больших вопроса, на которые нет простых ответов
,Lancet Infect Dis
,2004
, vol.4
(стр.397
—413
) 27« и др.Нейтрализация антител и ускользание с помощью ВИЧ-1
,Nature
,2003
, vol.422
(стр.307
—12
) 28,.Нейтрализующие антитела против ВИЧ: снова в высшей лиге?
,Curr Opin Immunol
,2002
, т.14
(стр.495
—502
) 29« и др.Полная защита новорожденных макак-резус от перорального воздействия патогенного вируса иммунодефицита обезьян и человека с помощью человеческих моноклональных антител против ВИЧ.
,J Infect Dis
,2004
, vol.189
(стр.2167
—73
) 30« и др.Эффективная кросс-групповая нейтрализация изолятов первичного вируса иммунодефицита человека моноклональными антителами: значение для вакцины от синдрома приобретенного иммунодефицита
,J Infect Dis
,2004
, vol.189
(стр.71
—4
) 31« и др.Дизайн вакцины против ВИЧ и проблема нейтрализующих антител
,Nat Immunol
,2004
, vol.5
(стр.233
—6
) 32« и др.Иммунизация модифицированным вирусом осповакцины, экспрессирующим вирус иммунодефицита обезьян (SIV) gag-pol , вводит анамнестический gag -специфический цитотоксический ответ Т-лимфоцитов и ассоциируется с уменьшением виремии после заражения вирусом иммунодефицита человека
2000
, т.74
(стр.2502
—9
) 33« и др.Контроль виремии и профилактика клинического СПИДа у макак-резусов с помощью цитокин-усиленной ДНК-вакцинации
,Science
,2000
, vol.290
(стр.486
—92
) 34« и др.Неспособный к репликации вектор аденовирусной вакцины вызывает эффективный иммунитет против вируса иммунодефицита
,Nature
,2002
, vol.415
(стр.331
—5
) 35« и др.Вирусная нагрузка в плазме и лимфоциты CD4 + как прогностические маркеры ВИЧ-1 инфекции
,Ann Intern Med
,1997
, vol.126
(стр.946
—54
) 36« и др.Вирусная нагрузка и гетеросексуальная передача вируса иммунодефицита человека типа 1: Rakai Project Study Group
,N Engl J Med
,2000
, vol.342
(стр.921
—9
) 37. ,Исследование причин и последствий вакцины против натуральной оспы
,1798
Лондон
Низкая
38,,,.Обновленная информация о длительной бессимптомной инфекции ВИЧ типа 1 у реципиентов продуктов крови от одного донора
,AIDS Res Hum Retroviruses
,1995
, vol.11
(стр.1
—0000
) 39« и др.Длительная бессимптомная инфекция ВИЧ-1 у реципиентов продуктов крови от одного донора
,Ланцет
,1992
, т.340
(стр.863
—7
) 40,.Инцидент с резаком: полиомиелит после формального заболевания
,Am J Hyg
,1963
, т.78
(стр.29
—60
) 41« и др.Эффективная индукция цитотоксических Т-лимфоцитов, специфичных к вирусу обезьяньего иммунодефицита, у макак с использованием многоэпитопного гена и первично модифицированного ДНК вируса осповакцины Режим буст-вакцинации Анкара
,J Virol
,1999
, vol.73
(стр.7524
—32
) 42« и др.Индукция специфической активности CTL вируса СПИДа в свежих нестимулированных лимфоцитах периферической крови от макак-резус, вакцинированных первичной ДНК / модифицированным режимом буста вируса осповакцины Анкара
,J Immunol
,2000
, vol.164
(стр.4968
—78
) 43« и др.Нейтрализующее независимое от антител сдерживание заражения вирусом иммунодефицита путем прайминга ДНК и бустерной иммунизации рекомбинантным вирусом оспы
,Nat Med
,1999
, vol.5
(стр.526
—34
) 44« и др.Контроль заражения слизистых оболочек и профилактика СПИДа с помощью мультибелковой ДНК / MVA вакцины
,Science
,2001
, vol.292
(стр.69
—74
) 45« и др.Мультикладные иммуногены оболочки вируса иммунодефицита человека типа 1 вызывают широкий клеточный и гуморальный иммунитет у макак-резусов
,J Virol
,2005
, vol.79
(стр.2956
—63
) 46.Обновленная информация о клинических испытаниях VRC вакцин с многокладной ДНК и rAd5 [аннотация X8 041]
,Keystone симпозиумы Патогенез ВИЧ / вакцины против ВИЧ (Банф, Альберта, Канада)
,2005
стр.21
47« и др.Рекомбинантный вирус, вакцина-индуцированный SIV-специфический CD8 + цитотоксические Т-лимфоциты
,Science
,1991
, vol.252
(стр.440
—3
) 48« и др.Безопасность и иммунологический ответ на рекомбинантную вакцину против вируса осповакцины, экспрессирующую гликопротеин оболочки ВИЧ
,Lancet
,1991
, vol.337
(стр.567
—72
) 49,,,,,.Распространенная осповакцина у призывника с вирусом иммунодефицита человека (ВИЧ)
,N Engl J Med
,1987
, vol.316
(стр.673
—6
) 50,.MVA как вектор для вакцин против ВИЧ-1
,Expert Rev Vaccines
,2004
, vol.3
(стр.89
—97
) 51« и др.NYVAC: высокоаттенуированный штамм вируса осповакцины
,Virology
,1992
, т.188
(стр.217
—32
) 52« и др.Усиление Т-клеточного ответа CD4 (+) и CD8 (+), специфичного к вирусу иммунодефицита обезьян (SIV), с помощью режима прайма / буста DNA-SIV и NYVAC-SIV
,J Immunol
,2001
, vol.167
(стр.7180
—91
) 53« и др.Сдерживание инфекции вируса обезьяньего иммунодефицита у вакцинированных макак: корреляция с величиной вирус-специфических CD4 + и CD8 + до и после заражения Т-клеточными ответами
,J Immunol
,2002
, vol.169
(стр.4778
—87
) 54« и др.Безопасность и иммуногенность ДНК и MVA вакцин против ВИЧ в фазе I испытаний вакцины против ВИЧ-1 в Найроби, Кения [аннотация 54]
,Программа и выдержки из публикации «Вакцина против СПИДа 2004» (Лозанна, Швейцария)
,2004
Швейцария
стр. .33
55Группа оценки вакцины против СПИДа 022 Группа протокола
Клеточные и гуморальные иммунные ответы на вакцину против канареек, содержащую вирус иммунодефицита человека типа 1 env, gag и pro в сочетании с rgp120
,J Infect Dis
,2001
, т.183
(стр.563
—70
) 56« и др.NIAID Группа оценки вакцины против СПИДа. Индукция иммунных ответов на ВИЧ-1 с помощью рекомбинантных вакцин вируса оспы канареек (ALVAC) ВИЧ-1 и gp120 SF-2 у неинфицированных добровольцев
,AIDS
,1998
, vol.12
(стр.2407
—15
) 57,,,,.Вакцины-кандидаты против ВИЧ на основе поксвируса: два десятилетия опыта с особым вниманием к векторам оспы канареек
,Expert Rev Vaccines
,2004
, vol.3
(стр.75
—88
) 58« и др.Сравнительная иммуногенность ДНК-плазмиды, рекомбинантного вируса осповакцины и репликационно-дефектных аденовирусных векторов, экспрессирующих вирус иммунодефицита человека типа 1 gag , ген
,J Virol
,2003
, vol.77
(стр.6305
—13
) 59,.Последние достижения в разработке вакцин против ВИЧ-1 с использованием аденовирусных векторов, неспособных к репликации
,Annu Rev Med
,2004
, vol.55
(стр.355
—72
) 60« и др.Репликационно-дефектные векторы аденовируса серотипа 5 вызывают стойкие клеточные и гуморальные иммунные ответы у нечеловеческих приматов.
,J Virol
,2005
, vol.79
(стр.6516
—22
) 61« и др.Гетерологические иммуногены оболочки вносят вклад в защиту вакцины против СПИДа у макак-резусов
,J Virol
,2004
, vol.78
(стр.7490
—7
) 62.Оценка эффективности трехвалентной вакцины MRKAd5 на основе аденовируса 5 серотипа 5 gag / pol / nef [аннотация 42]
,Программа и выдержки из вакцины против СПИДа 2005 (Монреаль, Квебек, Канада)
,2005
стр.11
63.Безопасность и иммуногенность иммуноферментной вакцины с многократным рекомбинантным аденовирусом ВИЧ-1 у предыдущих реципиентов ДНК-вакцины против ВИЧ-1 с многократным использованием [аннотация 15]
,Программа и выдержки из публикации «Вакцины против СПИДа 2005» (Монреаль, Квебек, Канада)
,2005
стр.9
64« и др.Нейтрализующие антитела, вызванные иммунизацией обезьян ДНК-плазмидами и рекомбинантными аденовирусными векторами, экспрессирующими белки вируса иммунодефицита человека типа 1
,J Virol
,2005
, vol.79
(стр.771
—9
) 65« и др.Международная серологическая распространенность нейтрализующих антител против аденовируса [аннотация 301P]
,Программа и выдержки из вакцины против СПИДа 2005 (Монреаль, Квебек, Канада)
,2005
66.ВИЧ / СПИД: хеджируемая ставка: необычное испытание вакцины против СПИДа
,Наука
,2005
, т.309
(стр.1003
—0000
) 67Бюллетень вакцины против СПИДа
,Том 1, вып.1 января 2006 г.
© 2006 Американское общество инфекционных болезней
.