Микроспория у детей — причины, симптомы, диагностика и лечение микроспории у детей в Москве в детской клинике «СМ-Доктор»
ПОЛУЧИТЬ КОНСУЛЬТАЦИЮ Содержание:Описание заболевания
Симптомы
Причины
Диагностика
Лечение
Профилактика Микроспория (лишай) – инфекционное заболевание кожи грибковой природы, вызываемое грибками рода Microspirum. Лечением заболевания занимается врач-дерматолог.
Описание заболевания
Микроспория признана наиболее часто встречаемым среди детей грибковым заболеванием. Пик заболеваемости приходится на конец лета и начало осени. Источниками инфекции являются больные люди и животные (чаще кошки). Существует 2 вида возбудителей микроспории – антропонозные и зооантропонозные штаммы. Первые опасны только для человека, вторые – заражают человека и животных.У детей существует естественная склонность к микроспории.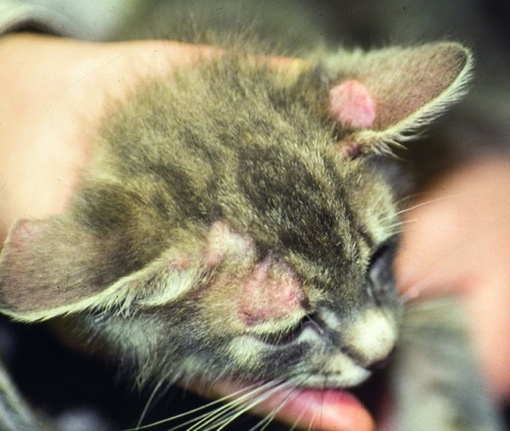 Это связано с тем, что в детском возрасте отличается состав секретов потовых и сальных желез. У взрослых в секрете присутствует много жирных кислот, которые губительны для грибка. У детей защитная функция кожи слабая, поэтому они больше подвержены дерматофитиям.
Это связано с тем, что в детском возрасте отличается состав секретов потовых и сальных желез. У взрослых в секрете присутствует много жирных кислот, которые губительны для грибка. У детей защитная функция кожи слабая, поэтому они больше подвержены дерматофитиям.
Грибок микроспорум способен поражать гладкую кожу, волосы, крайне редко прорастает в ногти. Продукты его жизнедеятельности обладают токсическими свойствами, поэтому провоцируют воспаление на коже, шелушение, зуд. При поражении волосистых частей тела грибок вторгается в луковицы, затем поражает волос по всей длине, провоцирует ломкость, выпадение.
Профилактика заболевания осуществляется на государственном уровне. Заболевшего необходимо изолировать от здоровых людей на 35 дней. Грибок распространяется вместе с чешуйками, отслоившимися от кожи. Риск развития микроспории выше для детей следующих категорий:
- слабый иммунитет;
- ссадины, царапины, ранки на коже;
- авитаминоз;
- патологии эндокринной системы;
- неблагополучная семейная обстановка.

Симптомы микроспории
Главным симптомом микроспории являются характерные высыпания на коже. В зоне проникновения в кожу грибка появляется красное пятно с приподнятыми краями. По мере размножения возбудителя оно расширяется, внешне напоминает кольцо. Внутри высыпания кожа обычного или бледно-розового цвета, покрыта мучнистым налетом или шелушится с отслоением корочек. По периметру пятна могут быть красноватые пузырьки или узелки. Возможен умеренный зуд кожи в области высыпания. При массивном обсеменении появляется сразу несколько пятен, которые со временем сливаются между собой. Чаще всего высыпания появляются на руках, предплечьях, плечах, шее, ногах.При заражении от животных поражаются волосистые участки кожи на голове. Пораженные волосы обламываются на расстоянии 3-5 мм от поверхности кожи, оставляя после себя «пеньки». По мере распространения грибка на голове ребенка образуются округлые участки облысения. Пораженная грибком зона может зудеть. Местный иммунитет здесь нарушен, поэтому возможно вторичное инфицирование очагов с развитием воспаления, в т.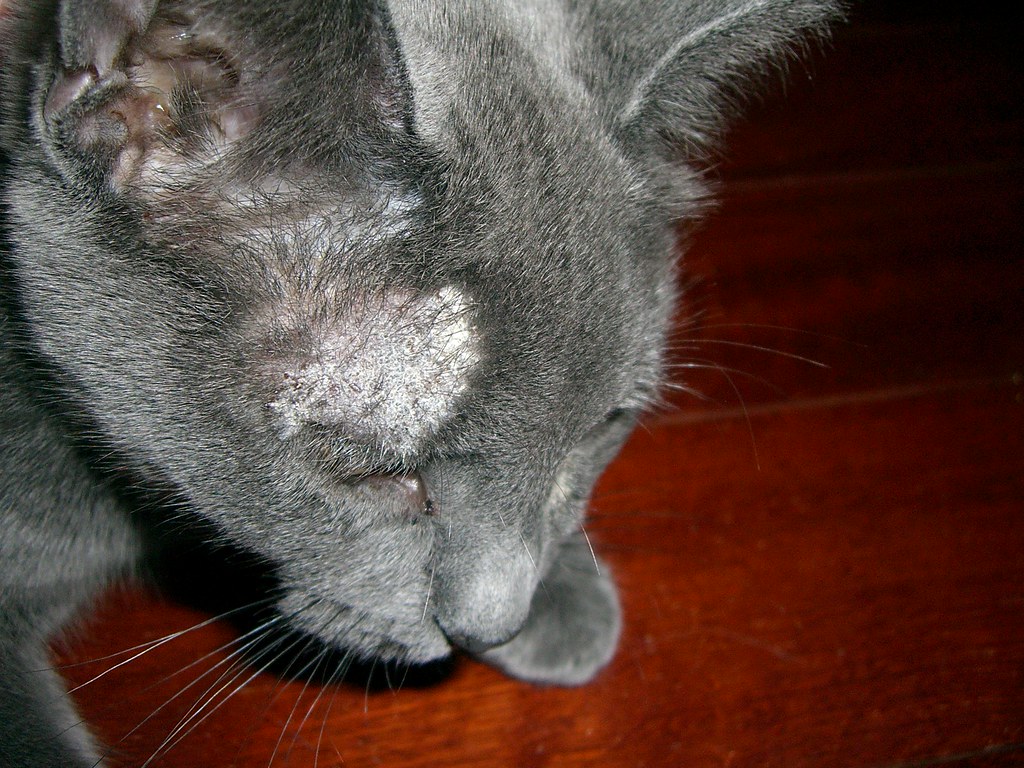
Причины микроспории
Ребенок может столкнуться с возбудителем где угодно. Инфицирование зооантропонозными штаммами происходит при контакте с бездомными животными. Кошки переносят микроспорию чаще собак. Высыпания появляются в зоне прямого контакта с больным животным (там, где кошка потерлась). Антропонозные штаммы переносят люди. Достаточно, чтобы инфицированные чешуйки попали на кожу здорового малыша. Заразиться можно в детском саду, общественном транспорте. Грибок передается через бытовые предметы. Чаще всего дети заражаются от взрослых, при использовании общего полотенца.Диагностика микроспории
Врачи-дерматологи «СМ-Доктор» имеют огромный опыт в диагностике и лечении микроспории у детей. Специалисты много внимания уделяют общему состоянию здоровья маленького пациента, чтобы выявить предрасполагающие к болезни факторы. При комплексном подходе от микроспории можно быстро избавиться.
Диагноз ставит врач-дерматолог, опираясь на данные клинической картины. Как правило, в анамнезе имеются сообщения о пребывании в деревне или контакте с бездомным животным на улице. Подтвердить диагноз позволяет обследование с лампой Вуда (очаги светятся зеленым). Для оценки общего состояния организма назначают общий и биохимический анализы крови. Для уточнения вида грибка проводят исследование соскоба и посев на питательную среду.
Лечение микроспории
Микроспория у одного ребенка может привести к настоящей вспышке заболевания внутри семьи или детского коллектива, поскольку патология очень заразная. К лечению нужно приступать незамедлительно. Важно, чтобы его подобрал врач, поскольку терапия отличается от случая к случаю. Врачи «СМ-Доктор» подбирают лечение в индивидуальном порядке, учитывая общее состояние маленького пациента и имеющиеся у него сопутствующие заболевания. Обработку наружными антимикотиками чередуют со смазыванием раствором йода.
Обработку наружными антимикотиками чередуют со смазыванием раствором йода.При поражении пушковых или длинных волос только наружными средствами не обойтись. Назначают противогрибковые препараты системного действия (в виде таблеток или капсул). Лечение дополняют мазями. Показано сбривание волос и мытье головы противогрибковыми шампунями. Лечение длится от 2 до 6 недель.
На время лечения ребенок должен быть изолирован. Все личные и бытовые предметы подлежат дезинфекции. После выздоровления пациент должен проходить диспансерное наблюдение, поскольку микроспория может рецидивировать.
Профилактика микроспории
Чтобы предотвратить микроспорию у детей, необходимо с раннего детства приучать их мыть руки по приходу домой, после туалета, после посещения общественных мест, перед приемом пищи, после контакта с животными. Необходимо ограничить контакты малыша с бездомными животными. При наличии кошек и собак дома, следует регулярно их консультировать у ветеринара. Если дома появился больной микроспорией, нужно ежедневно проводить дезинфекцию (стирать вещи, полотенца, покрывала, протирать поверхности раствором хозяйственного мыла и соды).
Врачи «СМ-Доктор» специализируются на лечении детских патологий. Заботливое отношение, комплексный подход и профессиональный контроль всех этапов лечения позволит вашему малышу выздороветь в самые короткие сроки!
Врачи:
Детская клиника м.Марьина Роща Записаться на прием Детская клиника м.Войковская Детская клиника м.Новые Черемушки Записаться на прием Детская клиника м. Текстильщики
ТекстильщикиБозунов Алексей Викторович
Детский дерматолог, детский миколог
Зуева Ксения Михайловна
Детский дерматолог II категории, детский миколог, детский трихолог
Смолева Мария Борисовна
Детский дерматолог высшей категории, детский миколог, детский трихолог, детский косметолог
Королькова (Симонович) Полина АскольдовнаДетский дерматолог, детский трихолог, детский миколог
Чекрыгина Марина Вячеславовна
Детский дерматолог, детский миколог, врач высшей категории. Заместитель главного врача по медицинской части в детском отделении на Волгоградском проспекте
Заместитель главного врача по медицинской части в детском отделении на Волгоградском проспекте
 ВДНХ
ВДНХСимакова (Мухина) Екатерина Сергеевна
Детский дерматолог, детский миколог, детский косметолог, к.м.н.
Уварова Елена Анатольевна
Детский дерматолог, детский трихолог
Антонова Ольга Александровна
Детский дерматолог, детский миколог, детский трихолог
Стражников Руслан Андреевич
Детский дерматолог, детский миколог, детский трихолог, детский косметолог, врач высшей категории
Быханова Ольга Николаевна
Детский дерматолог, детский миколог
Записаться на прием Детская клиника в г.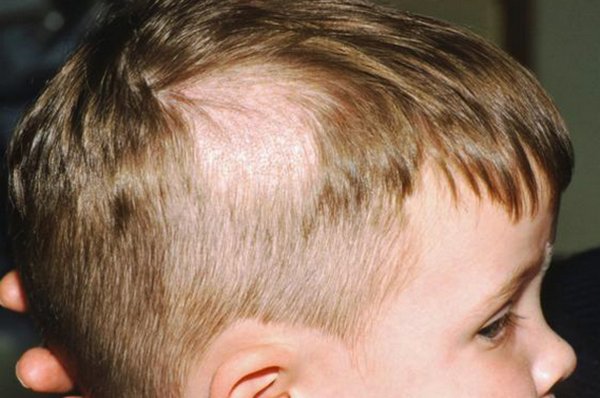 Солнечногорск, ул. Красная
Солнечногорск, ул. КраснаяЖукова Кристина Игоревна
Детский дерматолог
Записаться на приемЗаписаться на прием
Мы гарантируем неразглашение персональных данных и отсутствие рекламных рассылок по
указанному вами телефону. Ваши данные необходимы для обеспечения обратной связи и
организации записи к специалисту клиники.
Ваши данные необходимы для обеспечения обратной связи и
организации записи к специалисту клиники.
Микроспория у детей — Братский областной кожно-венерологический диспансер
Микроспория у детей — как можно заразиться?
Микроспорией называют самое распространенное грибковое заболевание, особенно часто встречающееся у детей. При этом заболевании поражаются либо кожа, либо волосы, в редких случаях ногтевая пластина. На 100 тыс. человек микроскопией болеют 50-60. По статистике, заболевание чаще подхватывают мальчишки, вероятно из-за своей повышенной активности. Наука различает два вида микроспории — зооантропонозную и антропонозную. Возбудители первой из них «живут» в волосах и роговом слое эпидермиса больных детей. Они не всегда передаются от человека к человеку. Заражаются чаще от животных. Заражение детей происходит при контакте с больными кошками или собаками, предметами, которые были инфицированы шерстью или чешуйками.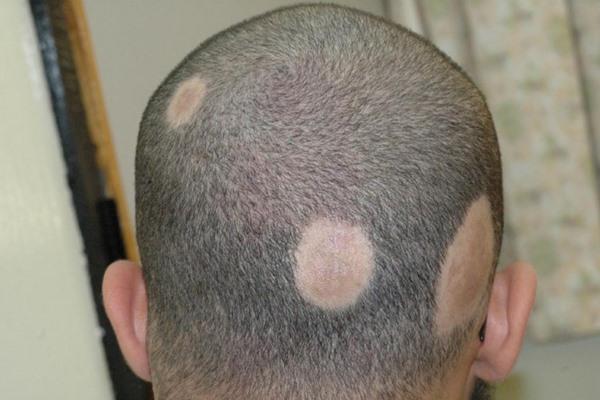 Поэтому профилактика микроспории у детей состоит в первую очередь в соблюдении правил гигиены и уходе за домашними животными. Кроме того, что вашему малышу необходимо усвоить правило всегда мыть руки, будь то после прогулки или после того, как погладил любимого кота, объясните ему, что нельзя пользоваться чужой щеткой или расческой, надевать чужие вещи. Антропонозная микроспория – редкое заболевание. Ее причиной является передача заразных грибков при контакте с больным человеком или вещами, находящимися в его употреблении. Инкубационный период заболевания продолжается от двух недель до трех месяцев. Затем у ребенка появляется лихорадка, а лимфоузлы увеличиваются. На коже появляются явные покраснения, шелушения и прочие неприятные вещи.
Поэтому профилактика микроспории у детей состоит в первую очередь в соблюдении правил гигиены и уходе за домашними животными. Кроме того, что вашему малышу необходимо усвоить правило всегда мыть руки, будь то после прогулки или после того, как погладил любимого кота, объясните ему, что нельзя пользоваться чужой щеткой или расческой, надевать чужие вещи. Антропонозная микроспория – редкое заболевание. Ее причиной является передача заразных грибков при контакте с больным человеком или вещами, находящимися в его употреблении. Инкубационный период заболевания продолжается от двух недель до трех месяцев. Затем у ребенка появляется лихорадка, а лимфоузлы увеличиваются. На коже появляются явные покраснения, шелушения и прочие неприятные вещи.
Микроспория гладкой кожи у детей
У новорожденных и детей раннего возраста, воспалительные явления особенно выражены. То место, где пророс грибок, воспаляется и становится красным пятном с четкими границами. Постепенно увеличиваясь, покрывается мелкими пузырьками, корочками. Очаг или очаги приобретают форму кольца. При микроскопии гладкой кожи они поражают лицо, шею, предплечья, плечи. Ощущается умеренный зуд.
Постепенно увеличиваясь, покрывается мелкими пузырьками, корочками. Очаг или очаги приобретают форму кольца. При микроскопии гладкой кожи они поражают лицо, шею, предплечья, плечи. Ощущается умеренный зуд.
Микроспория волосистой части головы
Заражение волосяного покрова микроспорией бывает в основном у детей от 5 до 12 лет. При поражении этой части головы волосы в пораженных местах отсекаются на расстоянии 5 мм от корня. Так же можно увидеть напыление похожее на муку в таких местах или основание волоса будет покрыто корочкой, манжетой. Если сдать анализы, в них точно будет видно наличие воспалительного процесса.
Как вылечить микроспорию у ребенка?
Диагностику и лечение микроспории у детей осуществляет врач-дерматолог. Лечение занимает в среднем от 3 до 6 недель. Микроспория у детей предполагает карантин. Заболевшего ребенка следует немедленно изолировать от окружающих. Предметы, которыми малыш пользуется, храните отдельно и сразу же займитесь их дезинфекцией.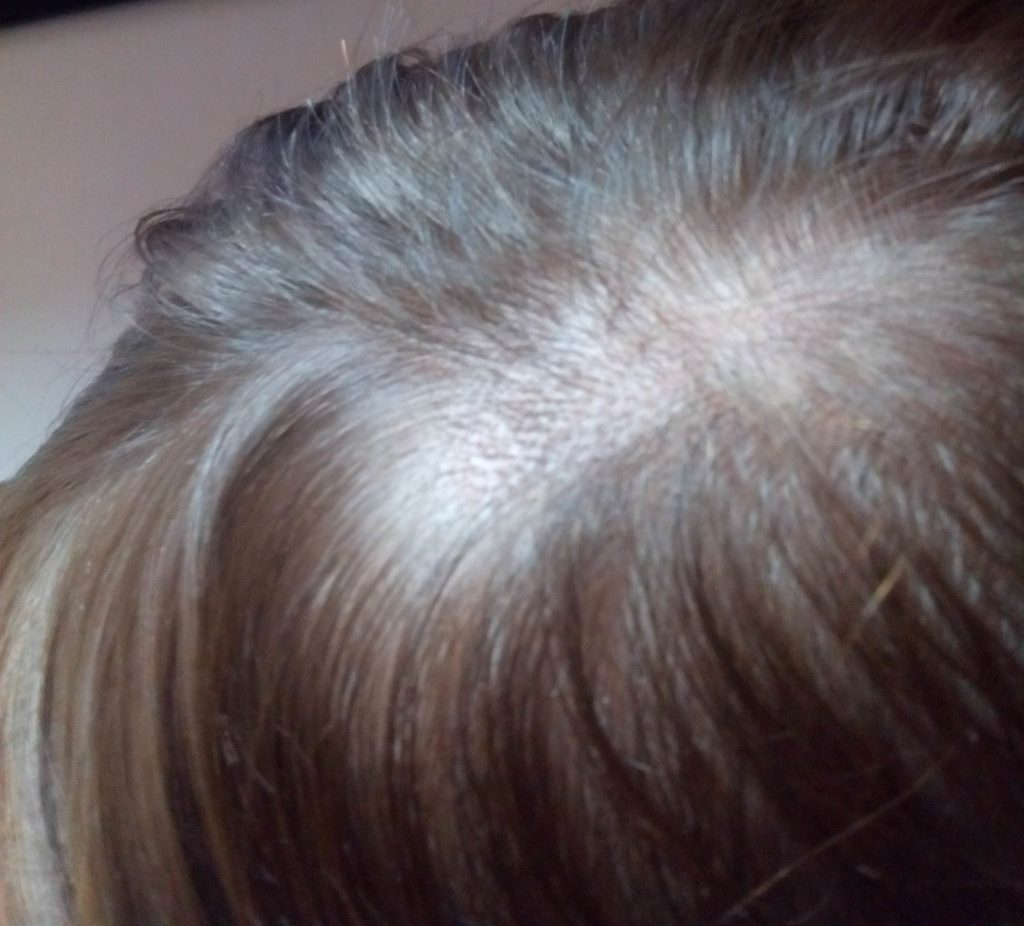 Устройте генеральную уборку дома, перестирайте все покрывала, протрите раствором из хозяйственного мыла и соды все поверхности и пол. Если у вас есть еще дети, не позволяйте им играть с заболевшим, пока тот не выздоровеет.
Устройте генеральную уборку дома, перестирайте все покрывала, протрите раствором из хозяйственного мыла и соды все поверхности и пол. Если у вас есть еще дети, не позволяйте им играть с заболевшим, пока тот не выздоровеет.
При лечении микроспории необходимо:
1. В зависимости от степени поражения применять местную или общую противогрибковую терапию: мази, кремы и эмульсии.
2. Без приема внутрь противогрибковых препаратов вылечить заболевание практически невозможно.
3. Если реакция ярко выражена и есть воспаление, нужно применять комбинированные препараты, в которых содержится противогрибковый и гормональный компонент.
4. Для достижения терапевтического эффекта чередовать аппликации с мазями, обработкой йодом.
5. Давать такие препараты только по назначению лечащего врача.
Профилактикой микроспории занимаются на государственном уровне, устраивая регулярные осмотры детей в детских учреждениях для выявления зараженных.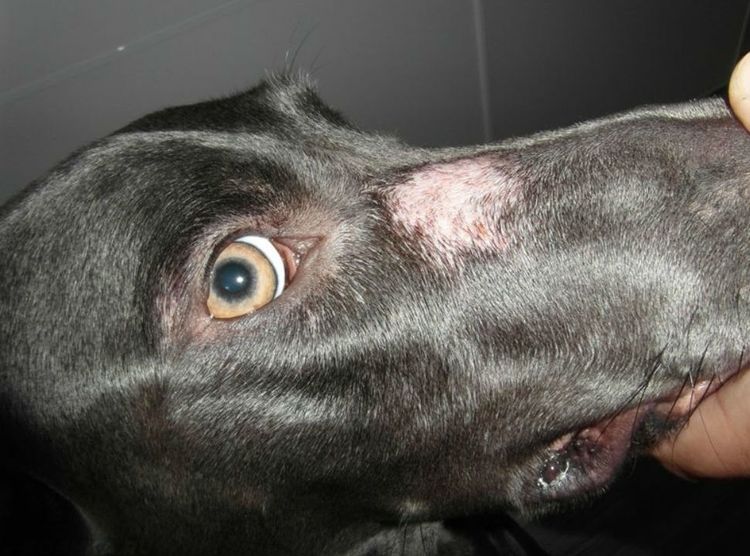 Родителям необходимо ограничить контакт детей с бродячими животными, следить за соблюдением личной гигиены.
Родителям необходимо ограничить контакт детей с бродячими животными, следить за соблюдением личной гигиены.
Перспективное и безопасное лечение микроспории у детей – МедИнфо
По данным Всемирной организации здравоохранения, каждый пятый житель нашей планеты страдает каким-либо грибковым заболеванием. Невзирая на очевидные успехи и достижения медицины, количество таких больных ежегодно увеличивается. Актуальность проблемы грибковых заболеваний в Донецкой области обусловлена высоким уровнем и неуклонным ростом дерматофитий среди населения. Особое место в структуре дерматофитий занимает микроспория. Учитывая социальную значимость этого заболевания, управление здравоохранения Донецкой областной государственной администрации разработало пилотный проект по безопасному лечению микроспории у детей и при поддержке фармакологической компании «Гедеон Рихтер» реализовало в Донецкой области в 2005 году. В 2004 году показатель заболеваемости микозамии, в частности, микроспорией в Украине составил 36,6, а в Донецкой области — 57,1 на 100 тыс. населения (один из высоких показателей по стране). За последние 10 лет самый низкий уровень заболеваемости в области отмечен в 1996 году — 28,9 на 100 тыс. населения (рис. 1). Это определило необходимость изучения причин роста заболеваемости и разработку соответствующих терапевтических мероприятий. Так, при анализе социального статуса пациентов установлено, что 68% больных детей — это дети с неполных, асоциальных семей и беспризорники. Наибольший уровень заболеваемости зарегистрирован в больших промышленных городах — Донецке, Мариуполе, Макеевке, а также в так называемых депрессивных — Харцызске, Дебальцево, Шахтерске. По данным Института дерматологии и венерологии АМН Украины (Харьков), микроспория относится к наиболее распространенным дерматофитиям и занимает второе место после микозов стоп и кистей, а в некоторых регионах составляет 80—90% от всех зарегистрированных дерматомикозов.
В 2004 году показатель заболеваемости микозамии, в частности, микроспорией в Украине составил 36,6, а в Донецкой области — 57,1 на 100 тыс. населения (один из высоких показателей по стране). За последние 10 лет самый низкий уровень заболеваемости в области отмечен в 1996 году — 28,9 на 100 тыс. населения (рис. 1). Это определило необходимость изучения причин роста заболеваемости и разработку соответствующих терапевтических мероприятий. Так, при анализе социального статуса пациентов установлено, что 68% больных детей — это дети с неполных, асоциальных семей и беспризорники. Наибольший уровень заболеваемости зарегистрирован в больших промышленных городах — Донецке, Мариуполе, Макеевке, а также в так называемых депрессивных — Харцызске, Дебальцево, Шахтерске. По данным Института дерматологии и венерологии АМН Украины (Харьков), микроспория относится к наиболее распространенным дерматофитиям и занимает второе место после микозов стоп и кистей, а в некоторых регионах составляет 80—90% от всех зарегистрированных дерматомикозов.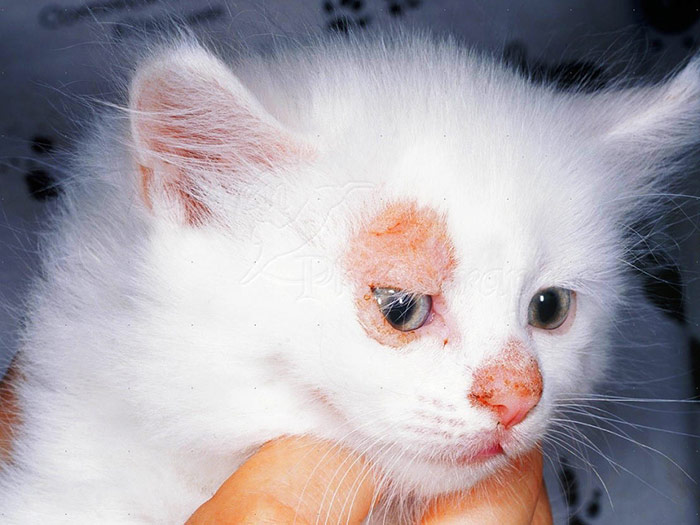 Среди всех зарегистрированных случаев микроспории более 72% относятся к детям, в том числе и новорожденным.
Среди всех зарегистрированных случаев микроспории более 72% относятся к детям, в том числе и новорожденным.
Микроспория — высококонтагиозное, грибковое заболевание из группы дерматофитий, при котором поражаются кожа, волосы и изредка ногтевые пластинки. Отмечается преимущественно у детей в возрасте до 14—15 лет; взрослые болеют редко. Заболеваемость микроспорией колеблется в течение года и во многом зависит от приплода котят, представляющих собой основной источник инфекции. По данным статистической отчетности, в году бывает два пика заболеваемости. Первый приходится на май — июнь и связан не только с рождением котят, притягательных для детей, но и с их большей свободой в летнее время, контактом с животными в деревне, на даче, в оздоровительных, спортивных и трудовых лагерях. Другой подъем заболеваемости наблюдается в сентябре — ноябре, когда дети возвращаются в город: их тщательно осматривают не только родители, но и медработники при поступлении в школы, детские сады.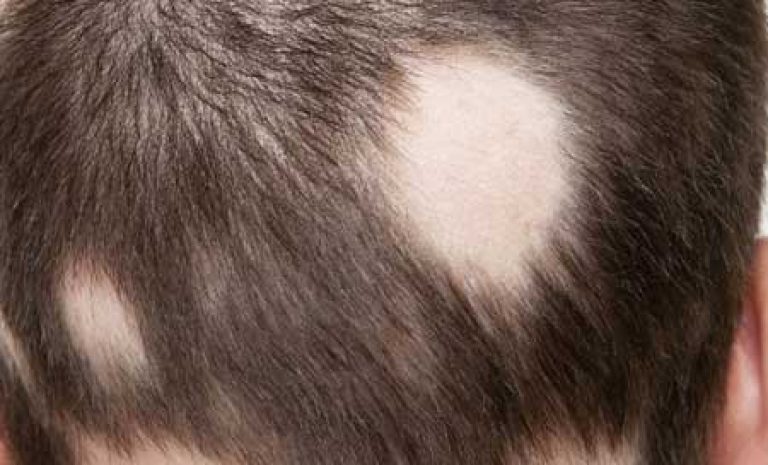 Выявляются как свежие, так и стертые, прежде нераспознанные формы микроспории.
Выявляются как свежие, так и стертые, прежде нераспознанные формы микроспории.
Возбудителем заболевания являются грибы рода Microsporum. В настоящее время известно более двадцати их видов. Из них в качестве патогенов выделяют следующие:
- антропофильная группа — M. ferrugineum, M. audouinii, M. distorum, M. rivalieri, M. langeronii;
- зоофильная группа — M. canis, M. nanum, persicolor;
- геофильная группа — M. gypseum, M. cookeii, Keratynomyces ajelloii.
Из перечисленных видов M. canis в последние годы стал практически единственным возбудителем микроспории. В Донецкой области — в 100% случаев. Инкубационный период при микроспории составляет в среднем 5—7 дней. Клиническая картина заболевания зависит от глубины проникновения возбудителя и от локализации очагов поражения. Выделяют микроспорию гладкой кожи и микроспорию волосистой части головы. При микроспории гладкой кожи (рис. 2) в месте внедрения гриба появляется отечное, возвышающееся эритематозное пятно с четкими границами, постепенно пятно увеличивается в диаметре с развитием явлений инфильтрации. По периферии пятна формируется возвышающийся валик, представленный мелкими узелками, пузырьками и корочками. В центральной части происходит разрешение воспалительных явлений, вследствие чего она приобретает бледно-розовую окраску, с отрубевидным шелушением на поверхности, очаг приобретает вид кольца. В результате аутоинокуляции гриба в центральной части и повторного развития воспалительного процесса образуются причудливые очаги типа «кольцо в кольце». Количество очагов при микроспории гладкой кожи, как правило, от 1 до 5—7. Их диаметр колеблется от 0,5 до 3,5 см. При микроспории волосистой части головы (рис. 3) очаги микроспории в количестве от 1 до 3—5 чаще располагаются на макушке, в теменной и височной областях, размерами от 2 до 5 см, с округлыми очертаниями и четкими границами. По периферии крупных очагов могут быть мелкие очажки (отсевы) диаметром 0,5—1,5 см. В начале заболевания образуется участок шелушения, на 6—7й день в процесс вовлекаются волосы, которые обламываются над уровнем кожи на 4—6 мм и выглядят подстриженными (отсюда название «стригущий лишай»).
По периферии пятна формируется возвышающийся валик, представленный мелкими узелками, пузырьками и корочками. В центральной части происходит разрешение воспалительных явлений, вследствие чего она приобретает бледно-розовую окраску, с отрубевидным шелушением на поверхности, очаг приобретает вид кольца. В результате аутоинокуляции гриба в центральной части и повторного развития воспалительного процесса образуются причудливые очаги типа «кольцо в кольце». Количество очагов при микроспории гладкой кожи, как правило, от 1 до 5—7. Их диаметр колеблется от 0,5 до 3,5 см. При микроспории волосистой части головы (рис. 3) очаги микроспории в количестве от 1 до 3—5 чаще располагаются на макушке, в теменной и височной областях, размерами от 2 до 5 см, с округлыми очертаниями и четкими границами. По периферии крупных очагов могут быть мелкие очажки (отсевы) диаметром 0,5—1,5 см. В начале заболевания образуется участок шелушения, на 6—7й день в процесс вовлекаются волосы, которые обламываются над уровнем кожи на 4—6 мм и выглядят подстриженными (отсюда название «стригущий лишай»). Кожа в очаге поражения, как правило, слегка гиперемирована, отечна и умеренно инфильтрирована, поверхность ее покрыта серовато-белыми мелкими чешуйками. К атипичным относятся инфильтративная, нагноительная (глубокая), экссудативная, трихофитоидная и себорейная формы микроспории. При инфильтративной форме микроспории очаг на волосистой части головы возвышается над уровнем кожи, в очаге отмечается гиперемия, волосы чаще обломаны на уровне 3—4 мм. При этой разновидности микроспории слабо выражен чехлик из спор гриба у корня обломанных волос. При нагноительной форме (рис. 4) микроспории на фоне выраженного воспаления и инфильтрации формируются мягкие узлы синюшно-красного цвета, поверхность которых покрыта пустулами. При экссудативной форме микроспории отмечается выраженная гиперемия и отечность с наличием мелких пузырьков. Вследствие постоянного пропитывания чешуек серозным экссудатом и склеивания их образуются плотные корки, при удалении которых обнажается влажная эрозированная поверхность очага.
Кожа в очаге поражения, как правило, слегка гиперемирована, отечна и умеренно инфильтрирована, поверхность ее покрыта серовато-белыми мелкими чешуйками. К атипичным относятся инфильтративная, нагноительная (глубокая), экссудативная, трихофитоидная и себорейная формы микроспории. При инфильтративной форме микроспории очаг на волосистой части головы возвышается над уровнем кожи, в очаге отмечается гиперемия, волосы чаще обломаны на уровне 3—4 мм. При этой разновидности микроспории слабо выражен чехлик из спор гриба у корня обломанных волос. При нагноительной форме (рис. 4) микроспории на фоне выраженного воспаления и инфильтрации формируются мягкие узлы синюшно-красного цвета, поверхность которых покрыта пустулами. При экссудативной форме микроспории отмечается выраженная гиперемия и отечность с наличием мелких пузырьков. Вследствие постоянного пропитывания чешуек серозным экссудатом и склеивания их образуются плотные корки, при удалении которых обнажается влажная эрозированная поверхность очага. Инфильтративная, нагноительная и экссудативная формы микроспории волосистой части головы зачастую осложняются регионарными лимфаденитами, могут наблюдаться также явления интоксикации.
Инфильтративная, нагноительная и экссудативная формы микроспории волосистой части головы зачастую осложняются регионарными лимфаденитами, могут наблюдаться также явления интоксикации.
При трихофитоидной форме микроспории (рис. 5) на волосистой части головы видны многочисленные мелкие очаги с нечеткими границами со слабым отрубевидным шелушением, островоспалительных явлений в очагах нет, волосы обломаны на уровне 1—2 мм над уровнем кожи. Наряду с обломанными встречаются здоровые волосы. При себорейной микроспории волосистой части головы (рис. 6) отмечается, главным образом, поредение волос. Очаги разрежения обильно покрыты желтоватыми чешуйками, при удалении которых можно обнаружить незначительное количество обломанных волос. В результате несвоевременной диагностики и неадекватной терапии атипичных форм микроспории происходит дальнейшее изменение клинической симптоматики, диссеминации высыпаний и хронизации процесса. Для подтверждения клинического диагноза микроспории применяют микроскопическое, культуральное и люминесцентное исследования.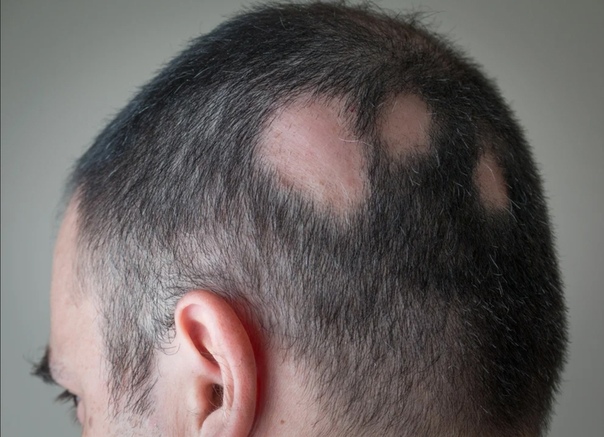 Микроскопическому исследованию подвергают чешуйки из очагов при поражении гладкой кожи, а при вовлечении в процесс волосистой части головы — обломки волос. В чешуйках из очагов на гладкой коже обнаруживаются извитые нити септированного мицелия. При микроскопическом изучении пораженного волоса выявляется множество мелких спор (2—3 мкм) на его поверхности (поражение по типу ectothrix). В связи с этим границы волоса выглядят как бы размытыми. Споры, окружающие волос, располагаются хаотично, наподобие мозаики. Проведение культуральной диагностики требуется для идентификации гриба возбудителя. Метод позволяет определить род и вид возбудителя и, следовательно, проводить адекватную терапию и профилактику заболевания. Патологический материал (чешуйки, волосы) помещают на среду Сабуро. Рост колоний Microsporum canis (основного возбудителя микроспории) отмечается на 3-й день после посева. К 10-му дню колония достигает диаметра 4—5 см и представлена плоским диском, покрытым беловатым, нежным пушком, который лучиками стелется по стенкам пробирки. Обратная сторона колонии имеет желтую окраску. Люминесцентное исследование основано на выявлении ярко-зеленого свечения волос, пораженных грибами рода Micrоsporum, при обследовании под лампой Вуда. Светятся как длинные, так и пушковые волосы. Этот метод служит для:
Микроскопическому исследованию подвергают чешуйки из очагов при поражении гладкой кожи, а при вовлечении в процесс волосистой части головы — обломки волос. В чешуйках из очагов на гладкой коже обнаруживаются извитые нити септированного мицелия. При микроскопическом изучении пораженного волоса выявляется множество мелких спор (2—3 мкм) на его поверхности (поражение по типу ectothrix). В связи с этим границы волоса выглядят как бы размытыми. Споры, окружающие волос, располагаются хаотично, наподобие мозаики. Проведение культуральной диагностики требуется для идентификации гриба возбудителя. Метод позволяет определить род и вид возбудителя и, следовательно, проводить адекватную терапию и профилактику заболевания. Патологический материал (чешуйки, волосы) помещают на среду Сабуро. Рост колоний Microsporum canis (основного возбудителя микроспории) отмечается на 3-й день после посева. К 10-му дню колония достигает диаметра 4—5 см и представлена плоским диском, покрытым беловатым, нежным пушком, который лучиками стелется по стенкам пробирки. Обратная сторона колонии имеет желтую окраску. Люминесцентное исследование основано на выявлении ярко-зеленого свечения волос, пораженных грибами рода Micrоsporum, при обследовании под лампой Вуда. Светятся как длинные, так и пушковые волосы. Этот метод служит для:
- идентификации возбудителя;
- выявления пораженных волос;
- оценки результатов терапии;
- контроля за лицами, контактировавшими с больным;
- выявления инфекции у животных.
Цель исследования — изучение эффективности применения системного противогрибкового препарата «Тербизил» (тербинафина) в лечении детей, больных микроспорией волосистой части головы и гладкой кожи. Изучена эффективность «Тербизил» в терапии пациентов зоонозной микроспорией. Под наблюдением в микологических отделениях Донецкого областного и городского кожно-венерологических диспансеров находилось 26 пациентов (9 девочек и 17 мальчиков) в возрасте от 3 до 15 лет. Длительность заболевания микроспорией до поступления в стационар составляла от 1 до 8 нед. Одновременное поражение волосистой части головы и гладкой кожи отмечено в 22 случаях, в 4 — поражение только волосистой части головы. Атипичные формы заболевания были у 4 детей, из них у3 — трихофитоидная форма и у 1 — экссудативная. Единичные воспалительные очаги поражения на волосистой части головы размером от 1 до 5 см в диаметре, правильной округлой формы с четкими границами и обломанными волосами выявлены у 17 больных. От 2 до 5 очагов поражения на голове имели 6 детей, от 6 до 10 очагов — 3. На гладкой коже типичные округлые, эритематозные, шелушащиеся воспалительные пятна размером от 0,5 до 2,5 см в диаметре, окруженные периферическим валиком, состоящим из папул, везикул и корочек, отмечены (с одновременным поражением волосистой части головы) у 22 пациентов. Клинический диагноз у всех больных подтвержден микроскопическим анализом, культуральным выделением Microsporum canis и люминесцентным исследованием в лучах лампы Вуда. Всем пациентам до начала и в процессе лечения были проведены следующие исследования: общий развернутый анализ крови, анализ крови на сахар, общий анализ мочи, биохимический анализ крови
(общий белок, креатенин крови, мочевина, АСТ, АЛТ, билирубин), анализ крови на антитела к лямблиям (IgМ), соскоб на энтеробиоз. При культуральном исследовании у всех наблюдаемых выделен Microsporum canis. Широкую распространенность этого зоофильного гриба в Украине и в других странах Восточной Европы подтверждают многие авторы. В литературе приводятся многочисленные данные о сравнительной эффективности различных методов системной терапии микроспории с применением топических антимикотических препаратов. Базисным в лечении микроспории волосистой части головы в Украине является гризеофульвин. Анализ литературных данных свидетельствует о том, что при терапии этим препаратом достаточно часто (8—15%) регистрируют тяжелые побочные эффекты. У детей чаще, чем у взрослых, бывают высыпания коревидного, скарлатиноподобного, уртикарного характера, нередко сопровождающихся зудом, отеком, диспепсическими явлениями. Сыпь появляется, как правило, на 7—11й день лечения и в некоторых случаях требует отмены препарата. У некоторых больных в первые дни приема гризеофульвина возможны головная боль, головокружение, тошнота, общая слабость. Имеются сообщения о гепатотоксическом, тератогенном действии гризеофульвина. Особо следует отметить, что в последние годы участились случаи резистентности к терапии гризеофульвином. Многочисленные исследования отечественных и зарубежных авторов доказывают, что частота микологического и клинического излечения в случае приема «Тербизила» значительно превосходит таковую при лечении гризеофульвином даже в отдаленные сроки после лечения. По данным разных авторов, эффективность терапии гризеофульвином при поражении волосистой части головы составляет 75—88%, а тербинафином — 98%. Исходя из этого, мы разработали комплексный метод лечения микроспории волосистой части головы и гладкой кожи, включивший безопасный системный и топический антимикотический препарат, гепатопротектор и иммуномодулятор. Для достижения максимального терапевтического эффекта доза системного антимикотическогопрепарата «Тербизил» была повышена на 50% от рекомендованной компанией производителем. Основанием для этого послужили многочисленные исследования отечественных и зарубежных авторов, а также Института дерматологии и венерологии АМН Украины. Всем пациентам с микроспорией волосистой части головы и гладкой кожи был назначен «Тербизил» в следующих дозировках: 94 мг/сут (3/4 таблетки в 125 мг) для детей с массой тела 10—20 кг,187 мг/сут (1,5 таблетки в 125 мг) — для детей с массой тела 20—40 кг и 250 мг/сут свыше 40 кг. «Тербизил» не требует каких-то определенных условий приема, быстро всасывается в пищеварительном канале. Его уровень в крови стабилен. Препарат практически не взаимодействует с различными медикаментозными средствами, а также ферментными системами, включая цитохром Р450. Действие «Тербизила» избирательно, направлено, главным образом, на грибковую клетку. В кожу и ее придатки препарат поступает путем простой диффузии, а также экскреции сальными железами. С целью оптимизации работы гепатобилиарной системы всем пациентам был назначен «Карсил»по 1/2 таблетки трижды в день в течение всего времени приема «Тербизила». Кроме того, больные принимали иммуномодулирующий препарат «Гропреназин» по 1/2 таблетки трижды в день. Всем больным микроспорией волосистой части головы и гладкой кожи была назначена топическая антимикотическая терапия. Так, еженедельно проводились бритье очагов поражения на волосистой части головы, обработка очагов 5% настойкой йода и смазывание их 1% кремом «Тербизил», один раз в три дня на очаги поражения делали компресс 5%салициловой мази. Длительность лечения пациентов с применением системной и топической антимикотической терапии составляла от 4 до 9 недель. Переносимость системной и топической терапии у всех больных была хорошей, ни в одном из наблюдаемых случаев непереносимости лечения и побочных эффектов не отмечено. Этот факт является убедительным доказательством безопасности предложенного нами комплексного метода лечения микроспории. Клинико-этиологический контроль эффективности терапии проводили во время лечения 1 раз в неделю до получения трех отрицательных микроскопических анализов и под контролем люминесцентной диагностики под лампой Вуда (отсутствие свечения), при культуральной диагностике после окончания лечения — отсутствие гриба M. canis. Анализ ближайших результатов лечения показал, что клинико-микологическое излечение достигнуто у всех наблюдавшихся детей. Средняя длительность лечения препаратом «Тербизил» составила 6,5 нед. При микроспории волосистой части головы микологическое излечение наступило у 3 детей через 4 нед и у одного — на 5-й неделе терапии. При микроспории волосистой части головы и гладкой кожи микологическое излечение отмечено у 9 детей через 4 нед приема препарата, у 6 — через 5 нед, у 4 — через 6 нед, у 2 — через 7 нед, у одного ребенка — на 9-й неделе. Отклонения в лабораторных показателях во время приема «Тербизила» не были зарегистрированы ни у одного больного, получавшего препарат. Профилактика микроспории заключается в своевременном выявлении, изоляции и лечении больных микроспорией. В детских учреждениях следует периодически проводить медицинские осмотры. Ребенка с микроспорией необходимо изолировать и направить на лечение в специализированный микологический стационар. На каждого заболевшего заполняется экстренное извещение. Вещи, принадлежащие больному, подлежат дезинфекции. Обязательно обследуются родственники и контактировавшие с больным лица. Особое внимание следует уделять домашним животным, поскольку именно они чаще всего служат источником инфекции.
Выводы
По результатам пилотного проекта в Донецкой области по эффективному и безопасному лечению микроспории у 26 детей, больных микроспорией, достигнуто клиническое и этиологическое выздоровление. Отмечена хорошая переносимость препарата «Тербизил» без изменений общих и биохимических анализов крови, мочи после окончания курса терапии. Увеличение дозы препарата на 50% по сравнению с рекомендациями компании производителя позволило получить клинико-микологическое излечение у всех наблюдаемых пациентов в среднем через 6,5 нед после начала лечения. Необходимы дальнейшие наблюдения за отдаленными результатами лечения и на большем количестве больных в сравнительном исследовании.
Организаторы пилотного проекта выражают благодарность за оказание содействия в реализации проекта сотрудникам областного кожно-венерологического диспансера и лично главному врачу ОКВД к. мед. н. Юхименко В.В.
Микроспория у детей — как долго ее надо лечить и в чем заключается профилактика этого заболевания
Микроспория — заболевание, вызываемое микроскопическими грибками, которые размножаются в поверхностных слоях кожи. Болезни кожных покровов, вызванные патогенными грибами, называют “дерматомикозами”.По распространенности микроспория уступает только грибковым поражениям стоп, а у детей она занимает первое место среди всех микозов. В первую
очередь ею страдают дети дошкольного и младшего школьного возраста, взрослые практически не болеют, за исключением молодых женщин. Это связано с тем, что кожа взрослых выделяет ряд органических кислот, которые подавляют развитие патогенных грибков. По этой причине в период полового созревания часто происходит самоизлечение от микроспории.Основными клиническими проявлениями этого заболевания являются очаговые поражения кожи и волосистой части головы. Волосы обламываются на уровне 4—8 мм над кожей и выглядят сероватыми, как бы припудренными, на каждом волоске виден беловатый “чехол”. Место поражения на коже представляет собой красноватое пятно с неровными, но довольно четкими краями. Вокруг пораженного участка образуется возвышающийся валик из мелких узелков. Пятно постепенно увеличивается в размерах и может принимать причудливые формы, к примеру, в виде кольца в кольце. Очагов поражения, как правило, не более трех-четырех, но могут быть и множественные, их размер обычно не превышает 3—4 см. Чаще сыпь локализуется на предплечьях, коже лица и шеи, иногда страдают другие участки тела.
Диагностикой и лечением этой болезни занимаются дерматологи. Обычно постановка диагноза не вызывает затруднения, однако существуют и атипичные формы, отличающиеся от классической клинической картины. Особая сложность в поставке диагноза может быть у детей, страдающих аллергическими реакциями, в частности, атопическим дерматитом. В этом случае микроспория маскируется под проявлением основного процесса и не всегда своевременно диагностируется, а используемые для лечения дерматита
гормональные мази только способствуют распространению микоза. Для постановки точного диагноза необходимы микробиологические исследования (микроскопия и посев на специальные среды). Существует и экспресс-метод — использование лампы “черного света” (лампы Вуда). Это люминесцентная лампа, стекло которой практически не пропускает видимый спектр лучей, только ультрафиолет. Пораженные участки в ее лучах светятся ярко-зеленым светом. Подобные устройства применяются не только в дерматологии, но и в криминалистике — для выявления следов биологических жидкостей и проверки подлинности документов.При лечении микроспории используют наружные противогрибковые препараты, а при поражении волосистой части головы обязательно назначаются специальные антибиотики для приема внутрь в таблетках или суспензиях. После двухнедельного курса проводят повторное микробиологическое исследование, при отрицательном результате анализа лечение продолжают, однако врач меняет схему лечения этим же препаратом. Общий курс лечения составляет полтора-два месяца, прерывать его нельзя ни в коем случае. Каждые две недели требуется лабораторный контроль. В ходе лечения необходимо еженедельно сбривать волосы и регулярно мыть голову.
Поскольку основным источником этого заболевания являются молодые животные (котята, щенки), прежде всего бездомные, необходимо ограничить контакт детей с ними. Но и домашний питомец может заразиться микроспорией, если он находится на улице без присмотра. Представляет опасность и любой человек с этим заболеванием, поэтому обязательно обследуются все родственники и контактировавшие с больным люди. Основа профилактики — правила личной гигиены: нельзя пользоваться чужими расческами и головными уборами.
Юрий Кузьменков, врач РНПЦ “Кардиология”.
Сфера интересов доктора — терапия, кардиология, эндокринология.
Ждем ваших вопросов, друзья!
Заметили ошибку? Пожалуйста, выделите её и нажмите Ctrl+Enter
Микроспория у детей
Микроспория — это грибковое заболевание, при котором поражаются кожа или волосы.
Различают микроспорию гладкой кожи и волосистой части головы (стригущий лишай).
При микроспории гладкой кожи в месте внедрения возбудителя болезни гриба появляется отечное пятно, бледно-розовой окраски с четкими границами в виде возвышающегося валика ярко-красного цвета, имеет вид кольца или овала. Наиболее часто эти очаги располагаются на коже лица, шеи, предплечий и плеч. Может беспокоить умеренный зуд.
При микроспории кожи волосистой части головы очаги располагаются главным образом на макушке, в теменной и височной областях. Обычно это 1-2 крупных очага от 2 до 5 см с округлыми очертаниями и четкими границами. По периферии крупных очагов могут быть отсевы – мелкие очажки диаметром 0,5-1,5 см. В начале заболевания на месте поражения образуется участок шелушения. Через неделю поражаются волосы головы, которые становятся хрупкими, обламываются над уровнем кожи на 4-6 мм и выглядят как бы подстриженными (отсюда второе название болезни «стригущий лишай»). Болеют в основном дети 5-12 лет.
Как происходим заражение детей?
Источник заболевания кошки (обычно котята), реже собаки. Особенно распространена микроспория у бездомных, безнадзорных кошек и собак.
Основной путь заражения – это прямой контакт с больными кошками и собаками, когда дети их гладят, берут на руки, ласкают их, играют с ними. Можно заразится через и предметы обихода – расчески, белье и др. При заболевании животных участки облысения располагаются на мордочке, ушных раковинах, лапах, чаще на передних.
Как предупредить заражение микроспорией?
Необходимо выполнять несколько правил:
- исключить контакты с бездомными животными;
- следить за тщательным мытьем с мылом рук детьми после игры на улице или обязательно после игр с животными;
- ни в коем случае не играть с безнадзорными и чужими животными;
- обратится в ветеринарную станцию для обследования и регистрации вашего нового домашнего питомца;
- не выбрасывать на улицу кошек или собак, что приведет их к заболеванию, от которых заражаются в первую очередь дети;
- следить за чистотой кожи тела, волос, ногтей у детей;
- не пользоваться чужими головными уборами, расческами, полотенцем, одеждой;
- мыть голову горячей водой с моющим средством сразу после стрижки волос в парикмахерской.
Микроспория и её профилактика
Любовь к животным, особенно у детей, несомненно, похвальное чувство, оно вырабатывает доброту и сердечность. Увидев на улице бездомное животное, многие стремятся приласкать и погладить его. К сожалению, такое общение с животными не всегда является безобидным и безопасным. Животные могут быть причиной различных заболеваний человека. Ярким примером служит такое заразное кожное заболевание, как микроспория, от которого, прежде всего, страдают дети дошкольного и младшего школьного возраста.
Ежегодно в городе Минске регистрируется до 500 случаев заболеваний микроспорией. В народе эту болезнь называют «лишай». Она вызывается микроскопическими грибками-дерматофитами, «гнездящимися» в поверхностных слоях кожи и волосах.
Основным источником заболевания являются кошки, реже собаки, от которых и заражаются люди. Так же микроспорией могут болеть кролики, мыши, крысы, хомяки, морские свинки. У животных микроспория нередко протекает бессимптомно, с поражением отдельных волосков и поэтому трудно выявляется.
Грибы, вызывающие микроспорию, характеризуются высокой устойчивостью во внешней среде, переносят морозы до 25 градусов и летнюю жару, не боятся высушивания и могут сохранять свою жизнеспособность в чешуйках кожи, в обломках волос и шерсти животных в течение многих месяцев и даже лет.
В 80–85% случаев заражение людей происходит при непосредственном контакте с больным животным или через предметы загрязненные их шерстью. В редких случаях так же возможна передача микроспории от больного человека к здоровому через зараженные грибками предметы обихода: головные уборы, одежда, расчески, полотенца и другие.
С момента заражения до появления первых признаков болезни проходит обычно от 5 до 45 дней. На местах внедрения грибков (чаще всего это открытые участки тела − лицо, шея, руки, реже ноги и туловище) появляются бледно-розовые пятна округлой или овальной формы, размером 0,5 — 3 см, с четко выраженными границами. Поверхность их покрыта чешуйками, пузырьками и тонкими корочками по периферии. При поражении волосистой части головы появляются очаги облысения, волосы в местах поражения обломаны и выступают над уровнем кожи на 4-8 мм, у основания покрыты беловатым рыхлым чехлом.
Микроспория излечима, но процесс лечения занимает длительное время (иногда до 1 месяца и более) и требует строгого и аккуратного выполнения всех врачебных назначений. Лечением микроспории занимается врач-дерматолог. Диагноз устанавливается на основании внешних признаков болезни и специальных методов обследования.
На период лечения детям запрещается посещать детские учреждения, школы, спортивные секции. Лица, бывшие в контакте с больным, должны в обязательном порядке пройти обследование у врача.
Как известно, любое заболевание лучше предотвратить, чем лечить. Это в полной мере касается и микроспории, её профилактика у человека особых усилий не требует.
Прежде всего, необходимо ограничить контакт с безнадзорными животными. Не берите в руки бездомных кошек и собак!
Приобретая животное, не поленитесь проконсультироваться у ветеринарного врача. Подумайте, сможете ли вы создать животному отдельные условия в квартире без ущерба для себя. Не выпускайте животных без присмотра из квартир.
Тщательно следите за чистотой своих питомцев. Если ваш «дружок» заболел, поспешите доставить его в клинику для осмотра и лечения.
Ни в коем случае нельзя выбрасывать больное животное на улицу, его необходимо доставить на ближайший ветеринарный пункт или пункт приема животных (ул. Гурского,42).
Строго соблюдайте правила личной гигиены. Не пользуйтесь чужой одеждой, расческами, щетками, головными уборами.
При малейшем подозрении на грибковое заболевание немедленно обращайтесь к врачу. Не занимайтесь самолечением, так как это помешает установить правильный диагноз. Чем раньше начато лечение, тем оно успешнее.
Тщательное соблюдение рекомендаций врача поможет быстро справиться с заболеванием, а соблюдение мер профилактики предотвратит заражение.
Энтомолог государственного учреждения «Центр гигиены и эпидемиологии Фрунзенского района г. Минска»
Мамчуровская Алла Николаевна
Микроспория или стригущий лишай: причины, проявления и диагностика
Растущий малыш воспринимает окружающий мир, как большую игровую площадку, полной удивительных приключений. Он стремиться, как можно быстрее узнать много нового: распробовать «на зуб» предметы или потрогать чужие вещи, погладить мурлыкающего котёнка или забавного щенка, покопаться в песочнице или земле. Как же иначе? Ведь вокруг столько всего интересного!
Во время столь увлекательного и близкого знакомства с окружающим миром ребёнок уязвим — в силу незрелости иммунной системы. Чем это опасно? Легко может произойти заражение грибками, вирусами или бактериями.
Мы поговорим о довольно распространённом грибковом заболевании — микроспории, поражающей кожные покровы, волосистую часть головы и ногтевые пластины (редко).
Термин «стригущий лишай» не является диагнозом, а лишь отражает течение недуга.
Когда и как может заразиться ребёнок?
Микроспория является высоко-контагиозным (очень заразным) заболеванием и вызывается грибками-дерматофитами (дословно — растущими на коже) рода Microsporum.
Имеется несколько видов этого грибка, которые вызывают развитие трёх форм заболевания.
На территории России распространены антропофильная и зоофильная формы микроспории.
Заболевание встречается в течение всего года. Однако для зоофильной характерна сезонность: наибольшее количество случаев регистрируется в конце лета и осенью.
Кто находится в группе риска?
Наиболее часто болеют дети дошкольного и школьного возраста.
Тогда как у взрослых заболевание встречается редко. Обусловлено это тем, что после периода полового созревания сальными железами кожи вырабатывается больше жирных кислот, губительно действующих на грибок.
Кроме того, заболевание чаще встречается у больных с предрасполагающими факторами:
• Нарушение работы иммунной системы
• Эндокринные заболевания: сахарный диабет, пониженная функция щитовидной железы
• Недостаток витаминов
• Плохие жилищно-коммунальные и бытовые условия проживания
• Высокая влажность и жаркая погода
• Наличие на коже ссадин, трещин или царапин
• Склонность к повышенному потоотделению
Обусловлено тем, что при этих состояниях местный иммунитет на коже снижается, что облегчает проникновение грибка.
На заметку
У малышей с кожными аллергическими проявлениями микроспория может «маскироваться» под основное заболевание — например, при атопическом дерматите. Что происходит? Грибок внедряется на месте уже имеющихся высыпаний, значительно затрудняя диагностику и лечение.
Кроме того, местное применение гормональных мазей снижает защитную способность кожи, что способствует лёгкому проникновению и распространению грибка.
Как быстро развивается заболевание?
С момента заражения и до возникновения первых симптомов болезни проходит определённое время — инкубационный период:
• При зоофильной форме — 5-14 дней
• При антропонозной — 4-6 недель
Каковы симптомы микроспории?
Зависят от формы заболевания и области поражения, но имеются и общие признаки.
Проявления, присущие для всех форм микроспории:
• На месте проникновения грибка появляется небольшое красноватое пятно. Если процесс затронул волосистую часть головы, то в него могут вовлекаться брови, ресницы (редко) или лицевая растительность у мужчин/подростков.
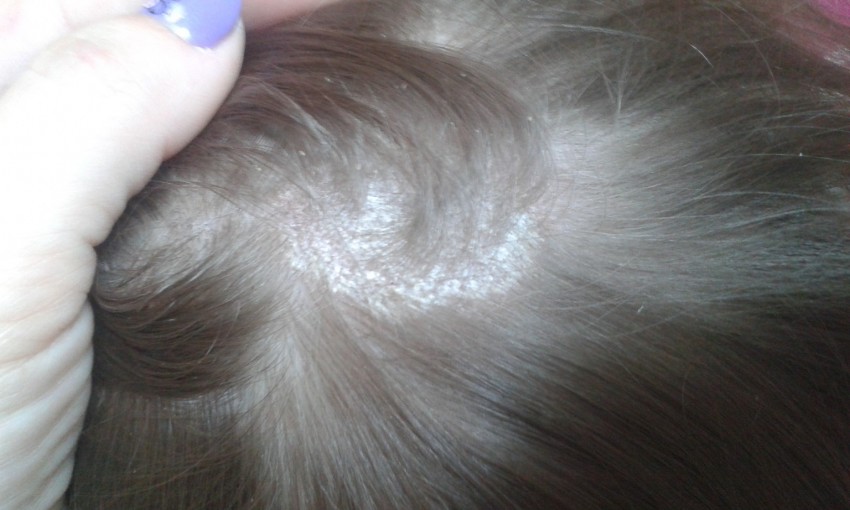
• Спустя несколько дней очаги бледнеют, а на их поверхности образуются белесоватые чешуйки, которые слущиваются. При поражении волосистой части головы из-за большого количества чешуек иногда создается впечатление, что у малыша появилась перхоть.
• Возникает умеренный или сильный зуд. Будьте внимательны, чтобы ошибочно не принять этот симптом за наличие у ребёнка педикулёза или экземы.
Фото: микроспория с момента появления и по истечении трех недель.
Проявления в зависимости от формы заболеванияПоверхностная микроспория кожи
«Любимые» места: кожа лица, шеи и верхних конечностей.
Проявления в области поражения:
1. На месте внедрения грибка возникает один или несколько очагов правильной круглой или овальной формы с четкими краями. Размеры — от 0,5 до 2 – 4 см в диаметре.
2. Затем постепенно очаги увеличиваются, уплотняются и немного набухают.
3. На границе очага со здоровой кожей образуется небольшой валик, покрытый пузырьками. После того как пузырьки разрешаются (лопаются), появляются корочки или чешуйки. При повторном заражении уже внутри инфицированного очага образуется ещё один валик — возникает причудливая фигура по типу «кольца в кольце».
Очаги между собой могут сливаться, если находятся близко друг к другу. Без лечения процесс распространяется и на другие участки кожи.
Особенности течения поверхностной микроспории у малышей до трёх лет: появляются воспалённые и отёчные очаги в виде пятен ярко-красного цвета.
Поверхностная микроспория волосистой части головы
Наиболее часто встречается у детей от 5 до 12 лет.
«Любимые» места: кожа волосистой части головы в области макушки, темени или висков.
Обычно возникает один-два крупных очага до 2-5 см в диаметре круглой или овальной формы с чёткими краями. Вокруг них имеются мелкие очажки — отсевы размером от 0,5 до 1,5 см в диаметре.
Проявления в области поражения:
1. На месте проникновения грибка образуются шелушащиеся участки кожи, а вокруг корней волос — чешуйки в виде муфты.
2. Спустя одну неделю в области поражения волосы истончаются и тускнеют, приобретают серовато-белый цвет и обламываются на расстоянии 4-6 мм от поверхности кожи. На месте очагов волосы выглядят подстриженными — образуется «ёжик». Отсюда и название заболевания — «стригущий лишай».
3. Под «ёжиком» кожа красного цвета, несколько отечна и покрыта пузырьками. После того, как пузырьки разрешаются, на поверхности кожи образуются корки.
4. Рядом с очагами волосы истончаются и выпадают даже при небольшом прикосновении.
Инфильтративно-нагноительная микроспория
Грибок, проникая в кожу, открывает доступ различным бактериям, которые живут у нас на коже постоянно.
Проявления в области поражения — развивается острое воспаление:
1. Инфильтративная форма. Очаги становятся ярко-красного цвета и уплотняются.
2. Нагноительная форма. Очаги покрываются пузырьками с гноем, а после того как они лопаются, образуются корочки. При надавливании на кожу из волосяных луковиц или из под корочек выделяется гной. Возможно образование абсцессов — полостей, заполненных гноем.
3. Нередко повышается температура тела.
4. Иногда увеличиваются и становятся болезненными лимфатические узлы, которые ближе всего находятся к очагам.
Течение и проявления заболевания зависят от состояния иммунной системы и наличия того или иного основного заболевания.
При хорошем иммунитете микроспория протекает довольно легко и быстро наступает выздоровление.
Как выставляется диагноз?
На основании внешнего осмотра (признаки описаны выше) и проведения специальных исследований.
Использование лампы Вуда
Основано на том, что она излучает ультрафиолетовые волны, которые вызывают яркое свечение разных оттенков у некоторых микроорганизмов.
Как проводится процедура? В тёмной комнате врач при помощи лампы Вуда исследует поражённые участки кожных покровов и волосистой части головы. Для микроспории характерно зелёное свечение: при поражении антропофильным видом грибка — изумрудное, зоофильным — бледно-зеленоватое.
Осмотр при помощи лампы Вуда выполняется на первом этапе. Остальные дополнительные исследования проводятся при появлении специфического свечения в очагах — признак микроспории.
Примечательно, что метод применяется не только для диагностики, но и для контроля над эффективностью лечения.
Выявление грибка
Под микроскопом изучаются соскобы из очагов (корочки, чешуйки) и/или поражённые волосы.
Посев материала
Чешуйки и поражённые волосы из очага помещаются на специальные питательные среды. Если в материале имеются грибки, спустя несколько дней вырастают его колонии — используется для определения вида возбудителя и подбора наиболее оптимального препарата для лечения.
Важно!
Перед посещением врача не смазывайте мазями поражённые участки — затрудняет правильную и своевременную диагностику.
P.S. Микроспория по симптомам нередко схожа с другими заболеваниями — например, псориазом, экземой или плоским лишаем. Поэтому обращайтесь к врачу при появлении на коже у ребёнка любых высыпаний. И помните, что неправильное и поздно начатое лечение значительно затягивает наступление выздоровления при любом заболевании.
В следующем материале — основные принципы лечения микроспории и ответы на часто задаваемые вопросы.
Автор: Корецкая Валентина Петровна, педиатр,
врач-ординатор детского отделения
фото: http://globallookpress.com/
Микроспоридиоз — Инфекционные болезни — Справочник Merck Professional Edition
Для пациентов со СПИДом: начало или оптимизация антиретровирусной терапии (АРТ)
Для лечения желудочно-кишечного, кожного, мышечного или диссеминированного микроспоридиоза — пероральный прием альбендазола или фумагиллина (при наличии), в зависимости от вида инфекции
Для лечения кератоконъюнктивита, пероральный альбендазол и фумагиллин для местного применения
Для пациентов со СПИДом важно начало или оптимизация АРТ.Продолжительность антимикробной терапии и результат зависят от уровня восстановления иммунитета при АРТ.
Антимикробное лечение микроспоридиоза зависит от вида заражающих микроспоридий, иммунного статуса человека-хозяина и задействованных органов. Данные о вариантах лечения ограничены. Рекомендуется консультация специалиста.
Альбендазол (400 мг перорально 2 раза в день для взрослых или 7,5 мг / кг 2 раза в день для детей в течение 2–4 недель) часто эффективен для контроля диареи у пациентов с кишечными инфекциями, вызванными E.кишечник и другие чувствительные микроспоридии. Инфекции у иммунокомпетентных пациентов могут исчезнуть спонтанно или через неделю лечения. Альбендазол имеет минимальную эффективность при лечении E. bieneusi . Альбендазол (400 мг 2 раза в день для взрослых или 7,5 мг / кг 2 раза в день для детей в течение 2-4 недель) также использовался для лечения кожного, мышечного или диссеминированного микроспоридиоза, вызванного E. виды микроспоридий.
Фумагиллин перорально по 20 мг 3 раза в день в течение 14 дней использовался для лечения кишечника E.bieneusi , но она имеет потенциально серьезные побочные эффекты, включая тяжелую обратимую тромбоцитопению у половины пациентов. Фумагиллин для перорального применения недоступен в США.
Глазной микроспоридиальный кератоконъюнктивит можно лечить с помощью альбендазола 400 мг перорально 2 раза в день и глазных капель фумагиллина. Местные фторхинолоны, а также местный вориконазол были эффективны у некоторых пациентов. Когда местная и системная терапия неэффективны, может быть полезна кератопластика.Результат обычно очень хороший у иммунокомпетентных пациентов; у пациентов со СПИДом это зависит от уровня восстановления иммунитета при АРТ.
микроспоридий — EyeWiki
Микроспоридии с вытянутой полярной нитью. [1]Микроспоридии — облигатные внутриклеточные спорообразующие паразитические грибы. Они способны заразить многие виды животных. У человека они могут инфицировать многие органы, в том числе глаз. Они широко распространены по всему миру и считаются новой причиной инфекционных заболеваний, особенно среди пациентов с ослабленным иммунитетом.
Организм
Микроспоридии — это тип микроорганизмов, состоящий примерно из 1200 видов, способных заражать множество различных животных, особенно рыб и насекомых. 15 видов были связаны с инфекциями у людей. К ним относятся Anncaliia (ранее Barachiola ), algerae, A. connori, A. vesicularum, Encephalitozoon cuniculi, E. hellem, E. кишечник, Enterocytozoon biuneusi, Mircosporidium ceylonensis, M. africanum, Nosema ocularum, Plendis., Trachipleistophora hominis, T anthropophthera, Vittaforma corneae и Tubulinosema acridophagus . E. cuniculi, E. Кишечник и E. bieneusi были обнаружены у некоторых домашних и диких животных, а E. hellem — у птиц. E. bieneusi и V. corneae виды были связаны с инфекцией человека.
Жизненный цикл микроспоридий [2]В последние десятилетия микроспоридии привлекли к себе большее внимание из-за их связи со стойкой диареей и системным заболеванием у пациентов со СПИДом. [3] Повышение осведомленности и развитие генетических технологий позволили лучше классифицировать и изучать несколько видов патогенных микроспоридий. [4]
Микроспоридии — облигатные внутриклеточные паразитические грибы, первоначально классифицируемые как простейшие. [5] В микроспоридиях отсутствуют типичные митохондрии, поэтому изначально считалось, что они разветвились до эндосимбиотического развития митохондрий на эволюционном древе. Это ставится под сомнение, поскольку генетическое секвенирование выявило гены, кодирующие митохондриальные белки, и дальнейшую идентификацию того, что считается митохондриальными остатками в ультраструктуре клетки.Полное секвенирование генов микроспоридиального вида Encephalitozoon cuniculi предоставило важные доказательства, подтверждающие гипотезу о том, что микроспоридии являются исключительно специализированными атипичными грибами, которые эволюционно утратили свои митохондрии, сохранив при этом полученные из митохондрий органеллы, называемые митосомами. [6] [7] [8] Экологически устойчивые споры — это инфекционная форма микроспоридий. Заражение клетки-хозяина достигается за счет использования специальной спиральной органеллы, уникальной для микроспоридий, называемой полярным канальцем.Эта структура может быть продемонстрирована при визуализации ультраструктуры спор. Изменения осмотического давления внутри споры заставляют полярную трубку или полярную нить разворачиваться и расширяться в направлении эукариотической клетки-хозяина с последующим переносом клеточного содержимого микроспоридий (спороплазмы). Попав в хозяина, паразитические микроспоридии размножаются внутриклеточно, заполняя цитоплазму. В конце концов, когда споры достигают зрелости, клетка-хозяин лизирует их и выпускает в окружающую среду. [4]
Клинические особенности
Впервые выявленная при ВИЧ-1-инфекции в условиях хронической диареи, микроспоридии с тех пор были обнаружены как вызывающие множество системных и глазных инфекций как у лиц с ослабленным иммунитетом, так и у иммунокомпетентных лиц.
Первый хорошо задокументированный случай поражения глаз у людей произошел в 1973 году, когда Эштон и Вирашина описали 11-летнего мальчика со стромальным кератитом, вызванным микроспоридиями. [9] В целом, существует два довольно разных клинических проявления глазного микроспоридиоза.Стромальный кератит характерен для инфекции у здоровых людей, в то время как с ослабленным иммунитетом, особенно у пациентов со СПИДом, чаще развиваются кератоконъюнктивит и эпителиальная кератопатия. Однако клиническое проявление может быть различным и может включать переднюю или среднюю инфильтрацию, передний увеит или даже грубый некроз и перфорацию роговицы.
Острота зрения варьируется от 20/20 до 20/100, часто без потери остроты зрения после разрешения болезни. Симптомы обычно включают покраснение, ощущение инородного тела, снижение остроты зрения и светобоязнь.Атипичный точечный эпителиальный кератит, связанный с конъюнктивитом, также может возникать у здоровых людей с удовлетворительными результатами лечения. Одно исследование 4822 пациентов с микробным кератитом в Индии показало, что у 19 (0,4%) из них был подтвержден микроспоридиальный кератит. У всех этих пациентов были отмечены мультифокальные, конечно, точечные, приподнятые эпителиальные поражения. Во всех случаях также отмечался негнойный конъюнктивит от легкой до умеренной степени, часто с папиллярными и / или фолликулярными реакциями. [10] [11] Эпителиальные изменения могут перерасти в центральный нуммулярный или дискообразный кератит до разрешения. [12] Одно исследование также задокументировало диффузный эндотилиит с отеком роговицы и лимбитом как дополнительные клинические признаки инфекции, которая исчезла с помощью местного лечения стероидами. [12]
Передача нечеткая. Микроспоридии могут оставаться в латентном состоянии в организме хозяина, и реактивация может происходить во время иммунного нарушения. Передача может быть возможна от хозяев, не подозревающих, что они являются носителями микроспоридий. Сообщалось о случае передачи микроспоридиального кератоконъюнктивита через донорский трансплантат роговицы, что подтверждает эту возможность. [13] О микроспоридиозе все чаще сообщается у реципиентов солидных трансплантатов органов. Тем не менее, остается неясным, передается ли инфекция донорской тканью или приобретается хозяином в течение следующего периода подавления иммунитета. [14]
| Клинические проявления микроспоридий | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Источник: CDC DPDx Microsporidiosis
Изображение на трансмиссионном электронном микроскопе паразитов Encephalitozoon Кишечник , содержащихся в паразитофорной вакуоли (ПВ). Вы можете увидеть как развивающиеся, формы E.interstinalis , так и зрелые споры (черные стрелки). Источник CDC Public Health Image Library (PHIL) [15]Просвечивающая электронная микроскопия
Золотым стандартом идентификации микроспоридий является просвечивающая электронная микроскопия (ПЭМ).ТЕА может также использоваться для идентификации видов конкретного организма. Однако TEM не является широко доступным и непрактичным для рутинной диагностики. Кроме того, это непомерно дорого и требует много времени. [16]
Образец глазных микроспоридий с окраской трихромом. [17]Микроскопия
Существует множество гистохимических методов диагностики с помощью исследования образцов жидкости (моча, кал, слизь и т. Д.) При диссеминированных инфекциях. Флуоресцентные отбеливатели, такие как Calcofluor white, можно использовать для воздействия на стенки хитиновых спор.Модифицированное (концентрированное) окрашивание трихромом также можно использовать отдельно или в сочетании с окрашиванием по Граму или окрашиванием серебром Вартина-Старри для идентификации организмов. [16] [12] Метод Chromotrope 2R — широко используемая техника окрашивания, при которой стенка спор окрашивается в ярко-красный цвет, часто с периферийной полосой, напоминающей пояс, который также окрашивает розово-красный цвет. Выполнение этого метода может занять около 90 минут, и была разработана «техника быстрого горячего хромотропа по Граму», позволяющая окрашивать менее чем за 10 минут с адекватным цветовым контрастом.Эти споры окрашены в темно-фиолетовый цвет, а также демонстрируют более темную центральную полосу. Споры микроспоридий, ассоциированные с инфекцией человека, имеют размер от 1 до 4 мкм в зависимости от вида. [16] Препарат КОН со соскобами роговицы также проводился для идентификации микроспоридий с 1% кислотоустойчивым окрашиванием, используемым в качестве подтверждающего метода. [10] [11]
Иммунофлуоресцентный анализ (IFA)
IFA доступны для микроспоридий с использованием моноклональных и / или поликлональных антител. [16]
Молекулярные методы (ПЦР)
CDC предлагает молекулярную идентификацию Enterocytozoon bieneusi, Encephalitozoon Кишечник, Encephalitozoon hellem и Encephalitozoon cuniculi с использованием анализа видоспецифической полимеразной цепной реакции (ПЦР). Эти методы обычно выполняются в исследовательских лабораториях, но не в клинико-диагностических учреждениях. [4] Эти четыре вида микроспоридий теперь можно идентифицировать с помощью одного микрочипа с использованием клинических образцов. [18]
Инфекция среди людей происходит во всем мире с наибольшей распространенностью среди ВИЧ-инфицированных лиц с диареей и менее 100 CD4 + Т-клеток на мм крови. 3 крови. Большинство микроспоридиальных инфекций, связанных со СПИДом, связано с Enterocytozoon bieneusi, , что связано с хронической диареей и истощением. Менее 50 CD4 + Т-клеток на мм. 3 крови связано с инфекциями как E. bieneusi , так и E. кишечника . [19] [20] [21]
Источник инфекции остается неясным, но инфекционные генотипы человека были идентифицированы у домашних, сельскохозяйственных и диких животных, что позволяет сделать вывод о возможной зоонозной этиологии. [22] Остается сильная связь с воздействием почвы, ношением контактных линз и местным лечением стероидами при глазных инфекциях. [12]
Идентификация микроспоридий в водных источниках привела к их включению в Список кандидатов на загрязняющие вещества 2 Агентства по охране окружающей среды (EPA), [23] , а также классификации Национальных институтов здравоохранения (NIH) как Патогены биозащиты категории B. [24]
Описаны различные возможные методы лечения микроспоридиального кератита. У пациентов с ослабленным иммунитетом из-за ВИЧ восстановление их иммунного статуса с помощью антиретровирусных препаратов было связано с исчезновением клинических симптомов. [4] Было также зарегистрировано, что ингибиторы аспартил-протеазы ВИЧ напрямую ингибируют рост Encephalitozoon Кишечник в культуре ткани. [25] Альбендазол, который ингибирует сборку микротрубочек, также эффективен против нескольких микроспоридий, включая Encephalitozoon spp.при системном заболевании. [26] Системные противогрибковые препараты также использовались для лечения микроспоридных инфекций у больных СПИДом. [27]
Фумагиллин, антибиотик и антиангиогенный агент, полученный из Aspergillus fumigatus , оказался эффективным против Encephalitozoon sp. и Enterocytozoon bieneusi . Несмотря на токсичность при системном применении, местное применение хорошо переносится и эффективно лечит кератоконъюнктивит. [28]
Местные фторхинолоны (ципрофлоксацин 0,3%, моксифлоксацин 0,5%, гатифлоксацин 0,5%, левофлоксацин 0,5% и норфлоксацин 0,3%) в качестве монотерапии или в комбинации с местным фумагиллином и / или системным лечением альбендазолом изучались. микроспоридиального кератита. Разрешение произошло в 99% случаев при местной монотерапии фторхинолоном. [12]
Медицинское лечение может быть долгосрочным, и после прекращения лечения может возникнуть рецидив.В случаях сильного истончения и некроза роговицы проникающая кератопластика может быть единственным надежным методом лечения. [29]
- ↑ https://www.cdc.gov/dpdx/microsporidiosis/index.html
- ↑ https://www.cdc.gov/dpdx/microsporidiosis/index.html
- ↑ Desportes I, Le Charpentier Y, Galian A, et al. Возникновение нового микроспоридиана: Enterocytozoon bieneusi n.g., n. sp., в энтероцитах человека, больного СПИДом. J Protozool. 1985; 32: 250-254.[PubMed: 4009510]
- ↑ 4,0 4,1 4,2 4,3 Дидье, Элизабет С. и Луи М. Вайс. «Микроспоридиоз: текущее состояние». Current Opinion in Infectious Diseases, Vol. 19, нет. 5, 2006, стр. 485–492., DOI: 10.1097 / 01.qco.0000244055.46382.23.
- ↑ Vossbrinck, C. R., et al. «Последовательность рибосомной РНК предполагает, что микроспоридии являются чрезвычайно древними эукариотами». Природа, т. 326, нет. 6111, 1987, стр. 411–414., DOI: 10.1038 / 326411a0.
- ↑ Thomarat, Fabienne, et al.«Филогенетический анализ полной последовательности генома Encephalitozoon Cuniculi подтверждает грибковое происхождение микроспоридий и выявляет высокую частоту быстро развивающихся генов». Журнал молекулярной эволюции, т. 59, нет. 6, 2004, стр. 780–791., DOI: 10.1007 / s00239-004-2673-0.
- ↑ Катинка, Майкл Д. и др. «Последовательность генома и уплотнение генов паразита эукариот Encephalitozoon Cuniculi». Природа, т. 414, нет. 6862, 2001, стр. 450–453., DOI: 10.1038 / 35106579.
- ↑ Гилл, Эрин Э., и Наоми М. Фаст. «Оценка взаимосвязи микроспоридий и грибов: комбинированный филогенетический анализ восьми генов». Джин, т. 375, 2006, стр. 103–109., DOI: 10.1016 / j.gene.2006.02.023.
- ↑ Эштон Н., Вирашина П.А. 1973. Энцефалитозооноз (нозематоз) роговицы. Br J Ophthalmol 57: 669-674.
- ↑ 10,0 10,1 Joseph, Joveeta, et al. «Клинический и микробиологический профиль микроспоридиального кератоконъюнктивита в Южной Индии». Офтальмология, т.113, нет. 4, 2006 г., стр. 531–537., DOI: 10.1016 / j.ophtha.2005.10.062.
- ↑ 11,0 11,1 Sharma, S, et al. «Микроспоридии: новые глазные патогены». Индийский журнал медицинской микробиологии, вып. 23, нет. 2, 2005, с. 80., DOI: 10.4103 / 0255-0857.16045.
- ↑ 12,0 12,1 12,2 12,3 12,4 Ло, Раймонд С. и др. «Растущая распространенность микроспоридиального кератита в Сингапуре». Офтальмология, т. 116, нет.12, 2009, стр. 2348–2353., DOI: 10.1016 / j.ophtha.2009.05.004.
- ↑ Kakrania, R, et al. «Микроспоридический кератоконъюнктивит в трансплантате роговицы». Глаз, т. 20, нет. 11, 2005, стр. 1314–1315., DOI: 10.1038 / sj.eye.6702178.
- ↑ Шварц Б. С. и С. Д. Мохортер. «Паразитарные инфекции при трансплантации твердых органов». Американский журнал трансплантологии, т. 13, вып. s4, 2013, стр. 280–303., DOI: 10.1111 / ajt.12120.
- ↑ https://phil.cdc.gov/Details.aspx?pid=142
- ↑ 16.0 16,1 16,2 16,3 «DPDx — Лабораторная идентификация паразитов, вызывающих озабоченность в области общественного здравоохранения». Центры по контролю и профилактике заболеваний, Центры по контролю и профилактике заболеваний, 29 декабря 2017 г., www.cdc.gov/dpdx/microsporidiosis/index.html.
- ↑ https://www.cdc.gov/dpdx/microsporidiosis/index.html
- ↑ Wang, Z., et al. «Одновременное обнаружение четырех видов патогенных микроспоридий человека из клинических образцов с помощью олигонуклеотидного микрочипа.Журнал клинической микробиологии, вып. 43, нет. 8, 2005, стр. 4121–4128., DOI: 10.1128 / jcm.43.8.4121-4128.2005.
- ↑ Морпет, Сьюзен К. и Натан М. Тильман. «Диарея у больных СПИДом». Современные варианты лечения в гастроэнтерологии, т. 9, вып. 1, 2006, стр. 23–37., DOI: 10.1007 / s11938-006-0021-8.
- ↑ Шварц, Дэвид А. и др. «Патологические особенности и демонстрация иммунофлуоресцентных антител при глазном микроспоридиозе (Encephalitozoon Hellem) у семи пациентов с синдромом приобретенного иммунодефицита».»Американский журнал офтальмологии, вып. 115, нет. 3, 1993, стр. 285–292., DOI: 10.1016 / s0002-9394 (14) 73577-9.
- ↑ Вебер Р. и Р. Т. Брайан. «Микроспоридиальные инфекции у иммунодефицитных и иммунокомпетентных пациентов». Клинические инфекционные болезни, т. 19, нет. 3, 1994, стр. 517–521., DOI: 10.1093 / Clinids / 19.3.517.
- ↑ Mathis, A., et al. «Зоонозный потенциал микроспоридий». Обзоры клинической микробиологии, т. 18, нет. 3, 2005, стр. 423–445., DOI: 10.1128 / cmr.18.3.423-445.2005 г.
- ↑ «Список кандидатов на загрязняющие вещества 2 — CCL 2». EPA, Агентство по охране окружающей среды, 29 сентября 2016 г., www.epa.gov/ccl/contaminant-candidate-list-2-ccl-2#microbial-list.
- ↑ «NIAID Emerging Infective Infectious Diseases / Pathogens». Национальный институт аллергии и инфекционных заболеваний, Министерство здравоохранения и социальных служб США, 23 мая 2018 г., www.niaid.nih.gov/research/emerging-infectious-diseases-pathogens.
- ↑ Menotti, J., et al. «Ингибирующая активность ингибиторов аспартил-протеазы вируса иммунодефицита человека против Encephalitozoon Intestinalis, оцениваемая с помощью количественного ПЦР-анализа на культуре клеток.”Противомикробные препараты и химиотерапия, т. 49, нет. 6, 2005, стр. 2362–2366., DOI: 10.1128 / aac.49.6.2362-2366.2005.
- ↑ Tremoulet, Adriana H., et al. «Терапия альбендазолом от микроспоридиозной диареи у иммунокомпетентных детей Коста-Рики». Журнал детских инфекционных болезней, вып. 23, нет. 10, 2004, стр. 915–918., DOI: 10.1097 / 01.inf.0000141724.06556.f9.
- ↑ Йи, Ричард В. и др. «Разрешение микроспоридиальной эпителиальной кератопатии у пациента со СПИДом». Офтальмология, т.98, нет. 2, 1991, стр. 196–201., DOI: 10.1016 / s0161-6420 (91) 32331-5.
- ↑ Champion, L., et al. «Фумагиллин для лечения микроспоридиоза кишечника у реципиентов почечного трансплантата». Американский журнал трансплантологии, т. 10, вып. 8, 2010, стр. 1925–1930., DOI: 10.1111 / j.1600-6143.2010.03166.x.
- ↑ Вт EY. Акантамеба и другие паразитарные инфекции роговицы. В: Krachmer JH, Mannis MH, Holland EJ. Роговица. 3-е изд. Том 1. Филадельфия: Эльзевьер / Мосби; 2011.
Микроспоридиоз: предпосылки, патофизиология, эпидемиология
Loignon M, Labrecque LG, Bard C, Robitaille Y, Toma E.Церебральный микроспоридиоз, проявляющийся в виде прогрессирующей мультифокальной лейкоэнцефалопатии у ВИЧ-инфицированного — случай из истории болезни. AIDS Res Ther . 2014. 11:20. [Медлайн]. [Полный текст].
Ladapo TA, Nourse P, Pillay K, Frean J, Birkhead M, Poonsamy B и др. Микроспоридиоз у детей, перенесших трансплантацию почки в Кейптауне, Южная Африка: два сообщения о случаях. Педиатр-трансплант . 2014 18 ноября (7): E220-6. [Медлайн].
Hocevar SN, Paddock CD, Spak CW, Rosenblatt R, Diaz-Luna H, Castillo I, et al.Микроспоридиоз, приобретенный в результате трансплантации твердых органов: исследование общественного здравоохранения. Энн Интерн Мед. . 2014 18 февраля. 160 (4): 213-20. [Медлайн].
Букреева И., Ангулвант А., Бендиб И., Гагнар Дж. К., Бурхис Дж. Х., Даржер С. и др. Микроспоридиоз Enterocytozoon bieneusi у реципиентов трансплантата стволовых клеток, обработанных фумагиллином. Emerg Infect Dis . 2017 июня 23 (6): 1039-1041. [Медлайн].
Coyle CM, Weiss LM, Rhodes LV, et al.Смертельный миозит, вызванный микроспоридиями Brachiola algerae, возбудителем комаров. N Engl J Med . 2004 г., 1. 351 (1): 42-7. [Медлайн].
Aikawa NE, Twardowsky Ade O, Carvalho JF, Silva CA, Silva IL, Ribeiro AC, et al. Кишечный микроспоридиоз: скрытый риск у пациентов с ревматическими заболеваниями, получающих терапию противоопухолевым фактором некроза в сочетании с модифицирующими болезнь противоревматическими препаратами? Клиники (Сан-Паулу) . 2011. 66 (7): 1171-5. [Медлайн].[Полный текст].
Didier ES, Weiss LM. Микроспоридиоз: не только у больных СПИДом. Curr Opin Infect Dis . 2011 24 октября (5): 490-5. [Медлайн].
Чан СМ, Тенг Дж. Т., Ли Л. и др. Микроспоридиальный кератоконъюнктивит у здоровых лиц: серия случаев. Офтальмология . 2003 июл.110 (7): 1420-5. [Медлайн].
Шрифт RL, Su GW, Matoba AY. Микроспоридиальный стромальный кератит. Арочный офтальмол .2003 июль 121 (7): 1045-7. [Медлайн].
Анане С., Аттучи Х. Микроспоридиоз: эпидемиология, клинические данные и терапия. Гастроэнтерол Клин Биол . 2010 сентябрь 34 (8-9): 450-64. [Медлайн].
Бах А.С., Бабаян В.К. Триглицериды со средней длиной цепи: обновленная информация. Am J Clin Nutr . 1982, ноябрь 36 (5): 950-62. [Медлайн].
Wanke CA, Pleskow D, Degirolami PC, et al. Диета на основе триглицеридов со средней длиной цепи у пациентов с ВИЧ и хронической диареей уменьшает диарею и мальабсорбцию: проспективное контролируемое исследование. Питание . 1996 ноябрь-декабрь. 12 (11-12): 766-71. [Медлайн].
Отт М, Фишер Х, Полат Х и др. Анализ биоэлектрического импеданса как предиктор выживаемости у пациентов с инфекцией вируса иммунодефицита человека. J Синдр иммунодефицита Acquir Ретровирол человека . 1995 May 1. 9 (1): 20-5. [Медлайн].
Sharpstone D, Rowbottom A, Francis N, et al. Талидомид: новый способ лечения микроспоридиоза. Гастроэнтерология .1997 июн.112 (6): 1823-9. [Медлайн].
Bartlett JG, Belitsos PC, Sears CL. Энтеропатия СПИДа. Клиническая инфекция . 1992 15 октября (4): 726-35. [Медлайн].
Карр А., Марриотт Д., Филд А и др. Лечение ВИЧ-1-ассоциированного микроспоридиоза и криптоспоридиоза комбинированной антиретровирусной терапией. Ланцет . 1998 24 января. 351 (9098): 256-61. [Медлайн].
Conteas CN, Berlin OG, Ash LR, et al.Терапия микроспоридиоза желудочно-кишечного тракта человека. Ам Дж. Троп Мед Хиг . 2000 сен-окт. 63 (3-4): 121-7. [Медлайн].
Каннингем Э. Глазные осложнения ВИЧ-инфекции. Медицинское лечение СПИДа . Филадельфия, Пенсильвания: У. Б. Сондерс, Ко; 1999. 171-84.
DeGirolami PC, Ezratty CR, Desai G, et al. Диагностика микроспоридиоза кишечника путем исследования кала и аспирата двенадцатиперстной кишки с использованием модифицированного трихрома Вебера и штаммов Uvitex 2B. Дж. Клин Микробиол . 1995 Апрель, 33 (4): 805-10. [Медлайн].
Дидье ES. Микроспоридиоз. Клиническая инфекция . 1998, 27 июля (1): 1-7; викторина 8. [Medline].
Дидье ES. Микроспоридиоз: возникающая оппортунистическая инфекция у людей и животных. Acta Trop . 2005 апр. 94 (1): 61-76. [Медлайн].
Diesenhouse MC, Wilson LA, Corrent GF, et al. Лечение микроспоридиального кератоконъюнктивита местным фумагиллином. Ам Дж. Офтальмол . 1993 15 марта. 115 (3): 293-8. [Медлайн].
Dore GJ, Marriott DJ, Hing MC и др. Диссеминированный микроспоридиоз, вызванный Septata Кишечник, у девяти пациентов, инфицированных вирусом иммунодефицита человека: ответ на терапию альбендазолом. Клиническая инфекция . 1995 21 июля (1): 70-6. [Медлайн].
Дунанд В.А., Хаммер С.М., Росси Р. и др. Паразитарный синусит и отит у пациентов, инфицированных вирусом иммунодефицита человека: отчет о пяти случаях и обзор. Клиническая инфекция . 1997 25 августа (2): 267-72. [Медлайн].
Данн JP, Голландия GN. Вирус иммунодефицита человека и оппортунистические глазные инфекции. Инфекция Dis Clin North Am . 1992 Декабрь 6 (4): 909-23. [Медлайн].
Eeftinck Schattenkerk JK, van Gool T, et al. Клиническое значение микроспоридиоза тонкого кишечника у ВИЧ-1-инфицированных. Ланцет . 1991, 13 апреля. 337 (8746): 895-8. [Медлайн].
Гарсия Л., Брукнер Д.Кишечные простейшие (кокцидии, микроспоридии) и водоросли. Диагностическая медицинская паразитология . 3-е изд. Вашингтон, округ Колумбия: ASM Press; 1997. 54-89.
Gunnarsson G, Hurlbut D, DeGirolami PC, et al. Мультиорганный микроспоридиоз: отчет о пяти случаях и обзор. Клиническая инфекция . 1995 21 июля (1): 37-44. [Медлайн].
Общество инфекционных болезней Америки. 1999 г. Рекомендации USPHS / IDSA по профилактике оппортунистических инфекций у лиц, инфицированных вирусом иммунодефицита человека.Рабочая группа USPHS / IDSA по предотвращению оппортунистических инфекций. Американское общество инфекционных болезней. Энн Интерн Мед. . 1999, 7 декабря. 131 (11): 873-908. [Медлайн].
Карталия M, Sande MA. Диарея и СПИД в эпоху высокоактивной антиретровирусной терапии. Клиническая инфекция . 1999 Apr, 28 (4): 701-5; викторина 706-7. [Медлайн].
Кестер К.Е., Турьянский Г.В., МакЭвой пл. Узловой кожный микроспоридиоз у пациента со СПИДом и успешное лечение длительной пероральной терапией клиндамицином. Энн Интерн Мед. . 1 июня 1998 г. 128 (11): 911-4. [Медлайн].
Котлер Д.П. Недоедание при ВИЧ-инфекции и СПИДе. СПИД . 1989. 3 Прил. 1: S175-80. [Медлайн].
Котлер Д.П. Питание и истощение при ВИЧ-инфекции. MEDSCAPE HIV Clinical Management Series . 1999. 8: 1-33. [Полный текст].
Лью EA, Poles MA, Dieterich DT. Диарейные заболевания, связанные с ВИЧ-инфекцией. Гастроэнтерол Clin North Am .1997 июн. 26 (2): 259-90. [Медлайн].
Lowder CY, McMahon JT, Meisler DM, et al. Микроспоридиальный кератоконъюнктивит, вызванный Septata gastinalis, у пациента с синдромом приобретенного иммунодефицита. Ам Дж. Офтальмол . 1996 июнь 121 (6): 715-7. [Медлайн].
Маркелл Э. Простейшие, обитающие в люменах. Медицинская паразитология Маркелла и Фоге . 8-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс, Ко; 1999. 24-89.
Медицинское письмо о лекарствах и терапевтических средствах.Лекарства от паразитарных инфекций. Med Lett Drugs Ther . 1998 2 января. 40 (1017): 1-12. [Медлайн].
Micromedex. Альбендазол. Доступно на: http://www.micromedex.com. 2000. [Полный текст].
Micromedex. Фумагиллин. Доступно на: http://www.micromedex.com. 2000. [Полный текст].
Молина Дж. М., Турнер М., Сарфати С. и др. Фумагиллин для лечения микроспоридиоза кишечника. N Engl J Med .2002 20 июня. 346 (25): 1963-9. [Медлайн].
Moon TD, Оберхельман, РА. Противопаразитарная терапия у детей. Педиатрическая клиника North Am . 2005 июн. 52 (3): 917-48, viii. [Медлайн].
Патель Р. Инфекции у реципиентов трансплантатов почек. Инфекция Dis Clin North Am . 2001 Сентябрь 15 (3): 901-52, xi. [Медлайн].
PDR. Справочная служба врачей . Монтвейл, Нью-Джерси: Медицинская Экономическая Компания, Инк; 2000 г.
Raynaud L, Delbac F, Broussolle V, et al. Идентификация Encephalitozoon Кишечника у путешественников с хронической диареей с помощью специфической ПЦР-амплификации. Дж. Клин Микробиол . 1998, январь, 36 (1): 37-40. [Медлайн].
Rosenblatt JE. Противопаразитарные средства. Mayo Clin Proc . 1999 ноябрь 74 (11): 1161-75. [Медлайн].
Sandfort J, Hannemann A, Gelderblom H, et al. Инфекция Enterocytozoon bieneusi у иммунокомпетентного пациента с острой диареей, не инфицированного вирусом иммунодефицита человека. Клиническая инфекция . 1994 Сентябрь 19 (3): 514-6. [Медлайн].
Шварц Д.А., Висвесвара Г.С., Дизенхаус М.С. и др. Патологические особенности и демонстрация иммунофлуоресцентных антител к микроспоридиозу глаз (Encephalitozoon hellem) у семи пациентов с синдромом приобретенного иммунодефицита. Ам Дж. Офтальмол . 1993 15 марта. 115 (3): 285-92. [Медлайн].
Страна А, Кали А, Нефи Р. Микроспоридиоз. Патология тропических и экстраординарных болезней .Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 1976. Vol 1: 336-9.
Talal A, Dieterich D. Желудочно-кишечные и печеночные проявления ВИЧ-инфекции. Медицинское лечение СПИДа . 6-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс, Ко; 1999. 195-216.
Томсон МИКРОМЕДЭКС. Альбендазол. MICROMEDEX Healthcare Серия . 2007. 131:
Вебер Р., Брайан РТ. Микроспоридиальные инфекции у иммунодефицитных и иммунокомпетентных пациентов. Клиническая инфекция . 1994 Сентябрь 19 (3): 517-21. [Медлайн].
Вебер Р., Шварц Д., Брайан Р. Microsporidia. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . Филадельфия, Пенсильвания: Черчилль Ливингстон; 2000. 2920-29.
Weiss L. Микроспоридиоз. Принципы и практика инфекционных заболеваний Манделла, Беннета и Долина . 2005. 2: 3237-54.
Веллер, Питер.Протозойные, кишечные инфекции и трихомониаз. Принципы внутренней медицины Харрисона . 17-е. 2008. 1314/208.
Wittner M, Tanowitz HB, Weiss LM. Паразитарные инфекции у больных СПИДом. Криптоспоридиоз, изоспориаз, микроспоридиоз, циклоспориаз. Инфекция Dis Clin North Am . 1993 Сентябрь 7 (3): 569-86. [Медлайн].
Tinea capitis | DermNet NZ
Страница создана в 2003 году. Адъюнкт A / Проф. Аманда Окли, дерматолог, Гамильтон, Новая Зеландия.Обновлено: д-р Харриет Белл, дежурный, больница Миддлмор, Окленд, Новая Зеландия. Копия отредактирована Гасом Митчеллом. Сентябрь 2020.
Что такое опоясывающий лишай на голове?
Tinea capitis — грибковая инфекция кожи головы, поражающая как кожу, так и волосы. Он также известен как стригущий лишай кожи головы. Симптомы тинеи на голове включают выпадение волос, сухие чешуйчатые участки, покраснение и зуд. Tinea barbae — это, по сути, то же заболевание, связанное с областью бороды.
Tinea capitis
Кто болеет опоясывающим лишаем головы?
Tinea capitis преимущественно поражает детей младшего школьного возраста, причем пик заболеваемости приходится на возраст от трех до семи лет.Он также может поражать взрослых, особенно людей с ослабленным иммунитетом. Tinea capitis встречается в большинстве частей мира, хотя распространенность определенных видов грибов, вызывающих tinea capitis, варьируется географически. Факторы риска включают контакт с животными, тесноту в доме, более низкий социально-экономический статус, теплую влажную среду и контактный спорт. Внедрение противогрибковых препаратов, перемещение населения и улучшение гигиенических практик связаны с изменяющимися моделями инфекции.
Что вызывает тинеу на голове?
Tinea capitis вызывается дерматофитными грибами, способными проникать в ороговевшие ткани, такие как волосы и ногти.Хотя известно, что существует более 40 различных видов дерматофитов, лишь небольшое их количество связано с дерматофитией. Дерматофиты можно разделить на три широкие категории в соответствии с предпочтениями хозяев: антропофильные виды (люди), зоофильные виды (животные) и геофильные виды (почва).
В Новой Зеландии, Европе и Азии наиболее распространенным возбудителем является зоофильный вид Microsporum canis , который происходит от кошек.
Примеры других зоофильных грибов, вызывающих тинеу на голове, включают:
- M.nanum (хозяин — свиньи)
- M. distortum (вариант M. canis)
- T. equinium (хозяин — лошади)
- T. verrucosum (хозяин — крупный рогатый скот).
Trichophytontonsurans — это антропофильный дерматофит, который является наиболее частой причиной дерматофитии головного мозга в Соединенных Штатах. T. violaceum — антропофильный гриб, обнаруженный в Новой Зеландии у пациентов, мигрировавших из Африки или Ближнего Востока.
Примеры других антропофильных грибов, вызывающих опоясывающий лишай на голове, включают:
- T. soudanese
- T. schoenleinii
- Т. rubrum
- М. audouinii .
Геофильные грибы, такие как M. gypseum , происходят из почвы и являются редкими причинами опоясывающего лишая.
Как распространяется опоясывающий лишай на голове?
Tinea capitis — заразная инфекция. Антропофильные виды распространяются при контакте с инфицированными людьми, включая бессимптомных носителей, или зараженными объектами (фомитами).Фомиты, которые могут содержать антропофильные дерматофиты, включают расчески, головные уборы, полотенца, постельное белье, кушетки и игрушки; грибковые споры могут оставаться на них в течение нескольких месяцев. Зоофильные виды передаются от инфицированных животных, включая домашних животных (особенно котят) или бездомных кошек и собак. Зоофильные виды могут передаваться от человека к человеку.
Как возникает инфекция опоясывающего лишая?
После инвазии ороговевшего рогового слоя кожи головы (см. Структуру нормальной кожи) грибок прорастает вниз в волосяной фолликул и стержень волоса.Он проникает в кутикулу волоса и обычно проникает в стержень волоса одним из трех способов:
- Инфекция Ectothrix: дерматофит растет внутри волосяного фолликула и покрывает поверхность волоса. Споры грибов видны на внешней стороне стержня волоса, а кутикула разрушена. M. canis — дерматофит эктотрикса.
- Инфекция Endothrix: дерматофит проникает в стержень волоса и растет внутри него. Споры грибов задерживаются внутри стержня волоса, а кутикула не разрушается. T.tonsurans — дерматофит эндотрикс.
- Инфекция Favus: хроническая дерматофитная инфекция, вызываемая T. schoenleinii и характеризующаяся скоплениями гиф у основания волос и воздушными пространствами в стержнях волос. Клинически вокруг стержня волоса имеется желтая корка.
Каковы клинические признаки дерматомикоза на голове?
Клинические особенности варьируются в зависимости от вида дерматофита, типа инвазии волос и степени воспалительной реакции хозяина.Для всех типов характерно частичное выпадение волос с некоторой степенью воспаления.
Клинические признаки можно в целом разделить на невоспалительные и воспалительные варианты.
Невоспалительные варианты
Невоспалительные варианты инфекции tinea capitis включают следующее.
- Серое пятно: мелкие чешуйки на коже черепа и участки облысения, которые кажутся серыми из-за спор, покрывающих пораженные волосы. Может наблюдаться переменная эритема; это обычно минимально для антропофильных видов, но может быть отмечено для зоофильных или геофильных видов.
- Черная точка: мелкие чешуйки с пятнами облысения, которые кажутся испещренными черными точками. «Точки» — это сломанные стержни волос, вызванные инфекцией эндотрикс.
- Диффузная чешуя: напоминает генерализованную перхоть; алопеция незаметная или отсутствует.
Воспалительный
Воспалительные варианты инфекции tinea capitis включают следующее.
- Диффузная пустулезная: пятнистая алопеция с сопутствующими пустулами или фолликулитом. Может произойти вторичное заражение бактериями или другими грибами.
- Керион: тяжелая воспалительная реакция, возникающая в результате замедленного иммунного ответа на грибок. Этот узор прогрессирует, образуя болезненный, эритематозный, болотный налет с сопутствующей алопецией и рассеянными пустулами. Обычно это вызвано зоофильными видами и может привести к стойкой алопеции.
- Favus: редкая хроническая воспалительная инфекция, вызываемая T. schoenleinii . Для него характерны спутанные волосы и образование желтых, покрытых коркой чашевидных поражений (щитков) вокруг основания волос.Щитки содержат гифы и кератиновый мусор и могут сливаться, образуя большую массу.
Грибковая инфекция может распространяться на другие участки с волосами, включая брови и ресницы, а также может присутствовать региональная лимфаденопатия.
Клинические типы дерматомикоза головы
Какие осложнения при дерматомикозе головы?
Алопеция может привести к психологическому стрессу у пациента, особенно если рубцевание алопеции после воспалительного дерматомикоза на голове приводит к образованию постоянных залысин.Вторичная сыпь может возникнуть при воспалительном дерматомикозе головы, особенно после начала противогрибкового лечения; это известно как дерматофитидная или id-реакция. Известно, что узловатая эритема возникает редко. Может развиться вторичная бактериальная инфекция.
Как диагностируется опоясывающий лишай на голове?
Tinea capitis обычно подозревают клинически, но должны быть подтверждены с помощью микроскопии и посева (см. Лабораторные тесты на грибковые инфекции).
Лампа Вуда
Осмотр с помощью лампы Вуда является диагностическим, когда наблюдается флуоресценция волос, хотя некоторые грибы вызывают флуоресценцию инфицированных волос.Ярко-зеленая флуоресценция инфицированных волос наблюдается при дерматомикозе головы, вызванном Microsporum видов ( M. ferruginium , audouinii , canis и distorum ). Выявление пораженных волос таким способом может помочь в получении подходящего образца для микроскопии и посева. Исследование с помощью лампы Вуда не имеет значения при нефлуоресцентной инфекции endothrix Trichophyton , за исключением T. schoenleinii , который может флуоресцировать тусклым серо-зеленым цветом.
Tinea capitis: Флуоресценция лампы Вуда
Дерматоскопия и трихоскопия
Дермоскопия — это быстрая и неинвазивная процедура, полезная для подтверждения опоясывающего лишая на голове, так что лечение можно начинать в ожидании результатов посева.
Дермоскопические данные, характерные для дерматомикоза головы с высокой прогностической ценностью, но наблюдаемые не во всех случаях, включают:
- Волосы в виде запятой (короткие волосы, которые изгибаются и отрастают к коже черепа, напоминающие запятую)
- Волосы штопора (короткие волосы, свернутые в спираль, как штопор)
- Волосы зигзагообразные (короткие волосы с несколькими загибами в виде зигзагообразного узора)
- Волосы, похожие на штрих-код (код Морзе)
- Волосы загнутые.
Волосы штопора типичны для инфекции Trichophyton и реже встречаются при инфекции, вызванной M. canis .
Признаки, обычно наблюдаемые при дерматоскопии опоясывающего лишая на голове, но не являющиеся диагностическими, включают:
- Масштаб, фолликулярный кератоз и корки
- Эритема
- Сломанные волосы
- Черные точки.
Дерматоскопия дерматомикоза головы
Микроскопия
Микроскопия соскобов кожи головы или выщипанных волос может быстро подтвердить диагноз опоясывающего лишая на голове.Образцы помещают в гидроксид калия и исследуют под световым микроскопом на наличие гиф и спор.
Культура
Культура грибов позволяет идентифицировать возбудителя и, следовательно, возможный источник инфекции. Однако это происходит медленно, до 4 недель, и обычно требуется лечение, прежде чем станет известен результат.
Микроскопия эндотрикса и эктотрикса
Методы молекулярной диагностики
Скрининг с помощью полимеразной цепной реакции (ПЦР) может привести к более быстрым и чувствительным способам выявления дерматофитной инфекции, но пока еще не получил широкого распространения.
Биопсия кожи головы
Иногда диагноз дерматомикоза головы ставится на основании биопсии кожи, когда видны характерные изменения (см. Патологию дерматомикоза головы).
Какой дифференциальный диагноз для опоясывающего лишая на голове?
Список дифференциальной диагностики обширен и включает любые состояния, которые могут проявляться очаговой алопецией, воспалением или шелушением кожи головы. Примеры включают:
Как лечить опоясывающий лишай на голове?
Tinea capitis всегда требует не менее 4 недель системного приема лекарств, поскольку местные средства не могут проникнуть в корень волосяного фолликула.Гризеофульвин ранее был наиболее широко используемым лекарством для лечения опоясывающего лишая, но он больше не доступен в некоторых странах, включая Новую Зеландию. Новые противогрибковые средства, такие как тербинафин, итраконазол и флуконазол, по крайней мере так же эффективны, как гризеофульвин, для инфекций трихофитона, но менее эффективны для видов микроспорум.
Местные агенты, такие как повидон-йод, кетоконазол и шампуни с сульфидом селена, могут использоваться для уменьшения передачи спор.
Все члены домохозяйства должны пройти скрининг на опоясывающий лишай головы и лечиться одновременно, если обнаружено заболевание.Совместное использование потенциальных фомитов, таких как расчески, головные уборы и подушки, не рекомендуется, и их следует тщательно очищать.
В случае зоофильной инфекции домашние животные должны быть проверены ветеринаром и обработаны соответствующим образом.
Каковы исходы дерматомикоза на голове?
Невоспалительный дерматофития головы при соответствующем и своевременном лечении имеет отличный прогноз. Тяжелый воспалительный дерматит головы может привести к образованию стойкой алопеции.
Первое выявление генотипов Enterocytozoon bieneusi (микроспоридий) среди детей с симптомами и бессимптомно в Мозамбике
Abstract
Enterocytozoon bieneusi — патоген человека, вызывающий широкий круг животных-хозяев.Изначально E . bieneusi считался новым условно-патогенным микроорганизмом у пациентов с ослабленным иммунитетом, в основном ВИЧ-инфицированных, но во всем мире о нем все чаще сообщалось у практически здоровых людей. Как и в других африканских странах, молекулярная эпидемиология E . bieneusi в Мозамбике остается полностью неизвестным. Поэтому мы предприняли исследование для изучения встречаемости и генетического разнообразия E . bieneusi инфекции у детей с желудочно-кишечными симптомами, а также у бессимптомных детей в Мозамбике.Отдельные образцы стула были взяты у 1247 детей в возрасте от 0 до 14 лет, проживающих в городских и сельских районах в провинциях Замбезия ( n = 1097) и Мапуту ( n = 150) в период с 2016 по 2019 год. E . bieneusi с помощью вложенной ПЦР, нацеленной на область внутреннего транскрибируемого спейсера (ITS) гена рРНК. Все положительные ампликоны были подтверждены и генотипированы. Для оценки ассоциаций риска использовалась штрафная логистическая регрессия (Ферт).Общая распространенность E . bieneusi в этой детской популяции составили 0,7% (9/1247). Распространенность была в 10 раз выше в Мапуту (4,0%; 6/150), чем в Замбезии (0,3%; 3/1097). Все E . bieneusi -положительные образцы были от детей старше 1 года, и большинство (8/9) от детей без симптомов. Анализ нуклеотидной последовательности ITS-области выявил наличие четырех генотипов, трех из которых сообщалось ранее (Перу11, n = 1; Тип IV, n = 2 и S2, n = 2) и нового генотипа (названного HhMzEb1, n = 4).Новый генотип HhMzEb1 был идентифицирован как у бессимптомных (75%, 3/4), так и у детей с симптомами (25%, 1/4) из сельской местности в провинции Мапуту на юге Мозамбика. Генотипы HhMzEb1, Peru11, S2 и Тип IV принадлежали к Группе 1, которая включает генотипы с низкой специфичностью к хозяину и возможностью зоонозной и межвидовой передачи. Инфицирование кишечными простейшими паразитами и отсутствие мытья рук были определены как ассоциации риска для E . bieneusi инфекция.Это исследование сообщает о первом исследовании E . bieneusi генотипов в Мозамбике с идентификацией трех ранее зарегистрированных генотипов у людей, а также нового генотипа (HhMzEb1). Полученные данные подчеркивают необходимость проведения дополнительных исследований для выяснения эпидемиологии E . bieneusi в стране, особенно в сельской местности, где все еще преобладают плохие гигиенические условия. Особое внимание следует уделять выявлению подходящих резервуаров этого паразита в животных и окружающей среде, а также характеристике путей передачи.
Информация об авторе
Enterocytozoon bieneusi — облигатный внутриклеточный паразит, поражающий широкий круг позвоночных-хозяев. Это важнейший этиологический агент микроспоридиоза человека. Большинство клинических и эпидемиологических исследований, проведенных на сегодняшний день, были сосредоточены на лицах с иммунодефицитом или иммуносупрессией, включая ВИЧ-положительных пациентов и реципиентов трансплантатов твердых органов, как в исследовании E . Инфекция bieneusi вызывает опасную для жизни хроническую диарею.Напротив, скрытым инфекциям микроспоридий у иммунокомпетентных людей уделялось гораздо меньше внимания. Молекулярно-эпидемиологические исследования на людях и животных показали, что E . bieneusi включает очень большое разнообразие генетических вариантов (генотипов) с заметными различиями в специфичности хозяина и даже географическом распределении. В Мозамбике, как и во многих других африканских странах, эпидемиология E . bieneusi полностью неизвестно.Поэтому для выявления встречаемости и генетического разнообразия этого патогена в Мозамбике образцы стула были получены от детей, в том числе явно здоровых и имеющих симптомы, в провинциях Замбезия и Мапуту и протестированы на предмет E . bieneusi молекулярными методами. Результаты продемонстрировали присутствие E . bieneusi генотипа впервые в Мозамбике. Было идентифицировано четыре генотипа, три генотипа, о которых ранее сообщалось у людей (Перу11, Тип IV и S2), и новый генотип (HhMzEb1).Два генотипа Peru11, Type IV также часто выявлялись у животных, что указывает на потенциально зоонозный E . bieneusi генотипов случайно циркулируют в обследованных популяциях. Необходимы дополнительные популяционно-генетические исследования для выяснения фактических масштабов эпидемиологии и динамики передачи E . bieneusi в Мозамбике.
Образец цитирования: Муадика А.С., Месса А.Е. мл., Дашти А., Баласегарам С., Сантин М., Манджате Ф. и др.(2020) Первое выявление генотипов Enterocytozoon bieneusi (Microsporidia) среди детей с симптомами и бессимптомного характера в Мозамбике. PLoS Negl Trop Dis 14 (6): e0008419. https://doi.org/10.1371/journal.pntd.0008419
Редактор: Туи Ле, Duke Global Health Institute, США
Получено: 23 января 2020 г .; Принято к печати: 23 мая 2020 г .; Опубликовано: 30 июня 2020 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, модифицировать, надстраивать или иным образом использовать в любых законных целях.Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: DC получил финансирование от Института здравоохранения Карлоса III Министерства экономики и конкурентоспособности (Испания) в рамках проекта PI16CIII / 00024. TN получила финансирование от Fundo Nacional de Investigação Министерства здравоохранения (Мозамбик) в рамках проекта 245-INV.Дополнительное финансирование было получено от странового офиса USAID в Мозамбике в рамках гранта фиксированной суммы № AID-656-F-16-00002 (IM) и Центров по контролю и профилактике заболеваний (CDC, США) через Альянс ГАВИ при субподрядчике. договор МОА № 870-15 ГК (JM). Спонсоры не играли никакой роли в дизайне исследования, сборе и анализе данных, решении опубликовать или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Microsporidia включает 200 родов и почти 1500 видов спорообразующих паразитов, повсеместно встречающихся в окружающей среде и способных колонизировать / инфицировать большое количество беспозвоночных и позвоночных-хозяев [1,2]. Среди 17 видов Microsporidia, инфицирующих людей, наиболее часто регистрируется Enterocytozoon bieneusi, вызывающая желудочно-кишечные инфекции во всем мире [3]. Заражение E . bieneusi у лиц с ослабленным иммунитетом (например,грамм. пациенты со СПИДом, раком, реципиенты трансплантатов органов и пожилые люди) обычно связаны с хронической диареей, синдромом истощения и потерей веса. Инфекции у иммунокомпетентных субъектов часто протекают бессимптомно или приводят к самоограниченной диарее и мальабсорбции [4,5]. Сообщалось также о внекишечных расстройствах и патологиях, в основном в легких [6]. Кроме того, E . bieneusi Инфекция в раннем детстве была недавно связана с задержкой роста у детей в условиях ограниченных ресурсов, включая африканские страны, такие как Малави, Южная Африка или Танзания [7,8]. Enterocytozoon bieneusi обладает высоким генетическим разнообразием и способен колонизировать / инфицировать широкий спектр видов млекопитающих и птиц. Между этими генотипами наблюдаются заметные различия в специфичности хозяина и зоонозном потенциале [9–11]. Инфекции передаются при приеме внутрь пищи и воды, загрязненной E . bieneusi спор, или через прямой контакт с фекалиями инфицированных людей и животных или с зараженной почвой [2,12,13].
Высокополиморфный рибосомный внутренний транскрибируемый спейсер (ITS) гена рибосомной рРНК (рРНК) является наиболее широко используемым маркером для оценки генетического разнообразия в пределах E . bieneusi [11]. На основе нуклеотидных последовательностей ITS было подтверждено около 500 генотипов в соответствии с действующими стандартами номенклатуры, которые разделены на 11 различных филогенетических групп [10,14]. Группы 1 и 2 включают генотипы, способные инфицировать широкий спектр видов млекопитающих, включая человека, и поэтому считаются потенциально зоонозными. С другой стороны, группы 3-11 обладают сильной специфичностью к хозяевам и, как считается, представляют небольшой или нулевой зоонозный риск [11].
Глобальное многоцентровое исследование кишечника (GEMS) предоставило важную информацию об этиологии и популяционном бремени детских диарейных заболеваний в странах Африки к югу от Сахары и Южной Азии.GEMS включила в свое исследование кишечных простейших паразитов Giardia duodenalis , Cryptosporidium spp. И Entamoeba histolytica , но не микроспоридии E . bieneusi [15]. Однако в последние годы наблюдается устойчивый рост исследований, направленных на улучшение нашего понимания эпидемиологии E . bieneusi в Африке, поскольку этот паразит часто встречается у лиц с ослабленным иммунитетом в африканских странах (таблица 1 и рис. S1).Важно отметить, что ранние исследования, основанные на микроскопии, документально подтвердили E . bieneusi распространенность достигает 40-67% среди практически здоровых людей в Камеруне [16] и Нигерии [17]. Эти данные указывают на то, что бессимптомный, хронический E . bieneusi инфекции могут быть более частыми, чем предполагалось. Несмотря на несомненный прогресс, достигнутый за последние годы, реальная эпидемиологическая ситуация E . bieneusi в большинстве африканских стран, включая Мозамбик, остается в значительной степени неизвестным.Чтобы восполнить этот пробел, настоящее исследование направлено на изучение встречаемости и генетического разнообразия E . bieneusi в педиатрических группах с симптомами и бессимптомно в двух наиболее густонаселенных провинциях Центрального (Замбезия) и Южного (Мапуту) Мозамбика.
Таблица 1. Enterocytozoon bieneusi случаев инфицирования людей в африканских странах, включая страну происхождения, тип обследуемого населения, симптоматику, метод диагностики, а также зарегистрированную распространенность и генотипы.
Диагностика проводилась по образцам стула, если не указано иное.
https://doi.org/10.1371/journal.pntd.0008419.t001
Методы
Заявление об этике
Письменное информированное согласие было получено от законных опекунов детей, добровольно участвующих в этом исследовании. Все процедуры, включенные в исследование, были одобрены Комитетом по этике Института здравоохранения Карлоса III под номером CEI PI 17_2017-v3 и Национальным комитетом по биоэтике здравоохранения (CNBS – Comité Nacional de Bioética para Saúde) Мозамбика под номером 52 / CNBS / 2017 (участники в Замбезии).Аналогичным образом для участников было получено одобрение Институционального комитета по биоэтике здравоохранения Центра исследований в области здравоохранения — CIBS (Ref. CIBS-CISM / 075/2015) с окончательным одобрением CNBS (Ref. 209 / CNBS / 15). в Мапуту.
Дизайн исследования
Это исследование является частью продолжающихся совместных исследований, в которых участвуют Испанский национальный центр микробиологии (SNCM) в Испании, Centro de Investigação em Saúde de Manhiça (CISM) / Fundação Manhiça (FM) в Мозамбике и Департамент США Сельское хозяйство для оценки молекулярной эпидемиологии наиболее частых кишечных простейших паразитов, заражающих людей в Мозамбике.Два независимых исследования с использованием различных схем выборки были проведены в провинциях Замбезия и Мапуту.
Сбор образцов стула в провинции Замбезия
Замбезия (население: 5,1 миллиона; общая площадь: 103 478 км, 2 ) — вторая по численности населения провинция Мозамбика, расположенная в центральном прибрежном районе страны. Проспективное поперечное молекулярно-эпидемиологическое исследование было проведено в период с октября 2017 г. по февраль 2019 г. Все включенные в исследование дети были в возрасте от 3 до 14 лет.Первый набор образцов был получен от школьников, посещающих 18 государственных школ, по 35–2 111 (в среднем: 651) детей в 10 из 22 округов Замбезии. Добровольным участникам были предоставлены комплекты для отбора проб (стерильная полистирольная пластиковая колба со шпателем и уникальным идентификационным номером) для получения индивидуальных образцов стула. Кроме того, был проведен второй набор образцов от детей с желудочно-кишечными жалобами (боль в животе, анальный зуд, вздутие живота, запор, диарея, метеоризм, потеря аппетита, тошнота, рвота), обращающихся за медицинской помощью в центры здравоохранения ( n = 6 ) и больниц ( n = 1) из шести районов области.
Для обоих наборов аликвоту каждого образца фекалий переносили в устройство для сбора стула TOTAL-FIX (Дурвиз, Валенсия, Испания) и отправляли в SNCM в Махадаонда (Испания) для последующего молекулярного анализа.
Сбор образцов стула в провинции Мапуту
Исследование в провинции Мапуту проводилось в районе Манхиса (население: 0,2 миллиона человек; общая площадь: 2 373 км 2 ), который расположен примерно в 80 км к северу от столицы Мапуту в Южном Мозамбике.В районе Манхиса с 1996 года действует Система медико-демографического надзора (HDSS) от CISM, что обеспечивает связь между демографическими и клиническими данными населения [18].
образцов стула было собрано у детей в возрасте до 5 лет под постоянным наблюдением за диарейными заболеваниями, проводимым CISM с сентября 2015 года в районной больнице Манича (MDH) и других периферийных медицинских учреждениях [18,19]. Набирались дети в возрасте до 5 лет, обращающиеся в периферийные медицинские учреждения с диареей средней, тяжелой и менее тяжелой степени.Определение случаев диареи и критерии включения в исследование были такими, как описано ранее [20]. Кроме того, начиная с декабря 2016 г., от 1 до 3 контрольных групп населения (бессимптомные дети без эпизода диареи> 14 дней), сопоставленные с индексным случаем по возрасту, полу и району проживания, были выявлены (с использованием баз данных HDSS) и зарегистрированы в течение 14 дней после указанного индексный случай был зарегистрирован. Стул был собран как для случаев, так и для контроля и отправлен в лабораторию для обработки.Кроме того, с апреля 2017 г. по декабрь 2018 г. регистрировались стула детей, обращавшихся в дозорное медицинское учреждение с жалобами на менее тяжелую диарею, и детей, обращавшихся в сельскую больницу Ксинаване (XRH). Образцы стула были собраны в стерильные колбы и перевезены в лабораторию и хранится при -80 ° C без консервантов для дальнейшего тестирования кишечных патогенов, как описано ранее [21].
Сбор данных
Эпидемиологическая и клиническая информация была собрана в стандартизированной анкете, поставляемой как часть наборов для отбора проб и помеченной тем же идентификационным номером.Анкета была заполнена исследователями, опрашивающими участвующих детей и их опекунов во время выборки. Анкета включала основные демографические характеристики (возраст, пол, место проживания) и потенциальные факторы риска, включая контакт с домашним скотом или домашними животными, тип питьевой воды и информацию о месте дефекации. Между анкетами Манхисы и Замбезии были некоторые различия.
Извлечение и очистка ДНК
В образцах стула из Замбезии ДНК была выделена из 200 мг фекального материала с использованием мини-набора для стула QIAamp Fast DNA и робота QIAcube (Qiagen, Hilden, Германия) в соответствии с инструкциями производителя, за исключением того, что обработка образцов буфером для лизиса была проводят в течение 10 минут при 95 ° C.Очищенные образцы ДНК (200 мкл) хранили при -20 ° C для последующего молекулярного анализа. В Манхисе ДНК экстрагировали вручную и очищали с использованием мини-набора QIAamp DNA Stool Mini из 200 мг фекального материала, следуя инструкциям производителя, с такой же модификацией для стадии лизиса. Очищенные образцы ДНК (200 мкл) были отправлены в SNCM для молекулярного тестирования.
Молекулярное обнаружение
Enterocytozoon bieneusiДля обнаружения E . bieneusi , была проведена вложенная ПЦР для амплификации фрагмента длиной 390 п.н., включающего всю ITS, а также части фланкирующей большой и малой субъединицы гена рРНК [22].Первичные и вторичные реакции (50 мкл) проводили с использованием набора внешних праймеров EBITS3 (5´ GGTCATAGGGATGAAGAG ‒ 3´) и EBITS4 (5´ TTCGAGTTCTTTCGCGCTC ‒ 3´), а также набора внутренних праймеров EBITS1 (5´ ‒ GCTCGCTGAATATCT 3´) и EBITS2,4 (5´ ‒ ATCGCCGACGGATCCAAGTG ‒ 3´) соответственно. Реакционные смеси состояли из 1 мкл матричной ДНК, 200 нМ каждого праймера, 2,5 единиц ДНК-полимеразы MyTAQ (Bioline GmbH, Luckenwalde, Германия) и 5 мкл реакционного буфера MyTAQ, содержащего 5 мМ dNTP и 15 мМ MgCl 2 .Условия цикла для первичной ПЦР были следующими: после денатурации при 94 ° C в течение 3 минут образцы подвергали 35 циклам амплификации (денатурация при 94 ° C в течение 30 с, отжиг при 57 ° C в течение 30 с и элонгация при 72 ° C в течение 40 с) с последующим окончательным удлинением при 72 ° C в течение 10 мин. Условия вторичной ПЦР были идентичны условиям первичной ПЦР, за исключением того, что было проведено только 30 циклов при температуре отжига 55 ° C. Отрицательный (без матрицы ДНК) и положительный ( E . bieneusi ПЦР-положительные образцы, генотипы Ebcar2 и EbpA) контроли были включены во все циклы ПЦР.Продукты ПЦР разделяли на 2% агарозных гелях D5 (Conda, Мадрид, Испания), окрашенных Pronasafe (Conda).
Анализ последовательности
Все ампликоны ожидаемого размера были непосредственно секвенированы в обоих направлениях с использованием внутреннего праймера, установленного в реакционных смесях объемом 10 мкл, с использованием химии Big Dye и анализатора секвенирования ABI 3730xl (Applied Biosystems, Foster City, CA). Данные секвенирования просматривали с помощью программного обеспечения Chromas Lite версии 2.1 (https://technelysium.com.au/wp/chromas/) для создания согласованных последовательностей.Инструмент Blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi) использовался для сравнения этих последовательностей с эталонными последовательностями, депонированными в Национальном центре биотехнологической информации (NCBI). Enterocytozoon bieneusi Генотипы были определены с использованием установленной номенклатурной системы, основанной на нуклеотидной последовательности ITS [14]. Последовательности, полученные в настоящем исследовании, депонированы в базе данных GenBank под номерами доступа от MN845065 до MN845068.
Филогенетический анализ
нуклеотидных последовательностей, полученных в данном исследовании, и E . bieneusi нуклеотидных последовательностей для всех генотипов, ранее идентифицированных у человека и животных в Африке, а также соответствующие контрольные последовательности, включая все E . bieneusi группы, полученные из GenBank, были согласованы с алгоритмом Clustal W с использованием MEGA X [23]. Филогенетический вывод был выполнен методом Neighbor-Joining (NJ), как описано ранее [24], генетическое расстояние было рассчитано с помощью модели параметра Кимуры-2 с использованием MEGA X [23].
Статистический анализ
Мы проанализировали данные с помощью EpiData 4.2.0 (Ассоциация EpiData, Оденсе, Дания) и программное обеспечение Stata, версии 15 (STATA Corp., Колледж-Стейшн, Техас, США). Мы рассчитали отношения шансов (OR) для ассоциаций; значение вероятности ( P ) <0,05 считалось доказательством статистической значимости. Мы исследовали возможные факторы, влияющие на факторы (изменение OR> 20%) и взаимодействия. Поскольку обе популяции включали отбор как по симптоматическим, так и по бессимптомным группам, мы включили «априори» симптоматическую переменную в многомерную модель.Поскольку событие было редким и некоторые факторы (например, G . duodenalis ) были обнаружены во всех случаях, мы использовали штрафную регрессию (регрессию Ферта), выбирая факторы риска с P -значением ≤ 0,2 из однофакторного анализа. , используя информационный критерий Акаике (AIC) и байесовский информационный критерий (BIC) для определения выбора и оценки окончательной модели [25].
Результаты
Всего для участия в этом исследовании было привлечено 1 247 детей в возрасте от 0 до 14 лет в районе Манхиса в Мапуту ( n = 150) и провинции Замбезия ( n = 1097) в Мозамбике.Основные социально-демографические и эпидемиологические характеристики этих педиатрических групп суммированы в Таблице 2.
В Замбезии были обследованы 807 бессимптомных школьников и 290 детей с желудочно-кишечными жалобами, обратившимися за медицинской помощью, в 10 и шести районах провинции, соответственно (таблица 2 и таблицы S1 и S2). Общее соотношение мужчин и женщин составляло 1,0, а дети в возрастной группе от 6 до 10 лет составляли 60% опрошенных лиц. Трое из четырех исследованных детей проживали в сельской местности.
В сельском районе Манхиса были обследованы 109 бессимптомных детей и 41 ребенок с желудочно-кишечными жалобами (11 с диареей средней и тяжелой степени и 30 с менее тяжелой диареей) и обращались за медицинской помощью (таблица 2 и таблицы S3 и S4). В этой подгруппе соотношение мужчин и женщин составляло 1,1, а дети в возрастной группе от 12 до 23 месяцев составляли 40,7% опрошенных лиц. Большинство детей (62,7%) были из района, охваченного MDH. Все эти дети жили в сельской местности.
Всего, E . bieneusi был обнаружен с помощью вложенной ПЦР и подтвержден секвенированием у 0,7% (9/1247, 95% ДИ: 0,4–1,4) исследуемой детской популяции. Распространенность была более чем в 10 раз выше в районе Манхиса в Мапуту (4,0%, 6/150, 95% ДИ: 1,8–8,6) по сравнению со всеми районами Замбезии вместе взятыми (0,3%, 3/1097, 95% ДИ. : 0,1–0,8). Распространенность среди лиц без симптомов составляла 0,9% (8/916, 95% ДИ: 0,4–1,7), а среди пациентов с симптомами — 0,3% (1/331, 95% ДИ: 0.04–2.1), а также с диареей 0,4% (1/251, 95% ДИ: 0,06–2,8). Нуклеотидные последовательности ITS выявили присутствие четырех различных E . bieneusi генотипов, три из которых ранее сообщались у людей (тип IV, S2 и Peru11) и новый генотип (названный HhMzEb1). Смешанных инфекций не наблюдалось. Новый генотип HhMzEb1 отличался от генотипа D (AF101200) на один нуклеотид. Нуклеотидная последовательность генотипа S2, полученная в этом исследовании, показала SNP в области большой субъединицы по сравнению с эталонной последовательностью (номер доступа в GenBank FJ439678).
Основные социально-демографические, эпидемиологические и генотипы, идентифицированные в каждом из E . bieneusi инфекций, выявленных в настоящем исследовании, показаны в таблице 3. В провинции Замбезия, E . bieneusi был обнаружен у 3 бессимптомных детей. Двое из них жили в сельской местности, ходили в одну школу, но были инфицированы разными генотипами (Peru11 и S2) паразита. Оба ребенка были коинфицированы G . duodenalis , Blastocystis sp., и Strongyloides spp. Третий ребенок был инфицирован генотипом типа IV E . bieneusi и был коинфицирован с G . duodenalis . Ни один из детей с симптомами, обследованных в этой провинции, не дал положительных результатов на E . bieneusi .
В провинции Мапуту, E . bieneusi был обнаружен у шести детей мужского пола, у одного была диарея от умеренной до тяжелой степени, а у 5 — бессимптомная. Пять из шести заболевших были моложе 2 лет.Генотипы S2 и типа IV были обнаружены у одного мальчика, один из которых был коинфицирован ротавирусом. Среди 4 мальчиков, инфицированных новым генотипом, HhMzEb1, один был ВИЧ-положительным, имел диарею от умеренной до тяжелой и был коинфицирован Cryptosporidium meleagridis . Другой мальчик с этим генотипом был коинфицирован C . parvum , а третий был коинфицирован ротавирусом. Все шесть E . bieneusi -положительные образцы были коинфицированы G . duodenalis .
Однофакторный анализ объединенных данных (таблица 4) показал, что значимые ассоциации риска включали инфекции с G . duodenalis или Cryptosporidium spp. и возраст, но мытье рук было защитным. Только в наборе данных Замбезии G . duodenalis была значимой ассоциацией. Кроме того, путешествие, Blastocystis sp. И отсутствие уборной были связаны с присутствием E . bieneusi (значение P <0,5), но доверительные интервалы пересекли 1, и только 3 положительных случая. В наборе данных Мапуту не было значимых ассоциаций. В окончательной многомерной модели с использованием комбинированного набора данных после корректировки на симптомы ассоциации риска для E . bieneusi были инфицированы G . duodenalis [OR: 19,11, P = 0,43, 95% ДИ (1,10–332,94)]; инфицирование Cryptosporidium spp.[OR 5,75, P = 0,49 95% CI (1,01–32,89)] и мытье рук [OR 0,31 P = 0,128 95% CI (0,67–1,41)]. Хотя мытье рук не имело большого значения, оно было сохранено в окончательной модели, так как противоречило связи с Cryptosporidium spp. Возраст не был фактором после поправки на другие переменные.
Филогенетический анализ показал, что новый генотип HhMzEB1 кластеризуется в Группу 1, когда оценивалась его связь с другими генотипами человеческого и животного происхождения, о которых ранее сообщалось в Африке (рис. 1).
Рис. 1. Филогенетические отношения между генотипами Enterocytozoon bieneusi , идентифицированными в этом исследовании.
Все генотипы, идентифицированные у людей и животных в Африке, и генотипы, охватывающие все группы E . bieneusi были включены для сравнения. Анализы были выведены методом Neighbor-Joining для всей ITS гена рРНК на основе генетических расстояний, рассчитанных с помощью двухпараметрической модели Кимуры (программное обеспечение MEGA X). Все нуклеотидные последовательности включают информацию о хозяине с регистрационным номером GenBank в скобках.Нуклеотидные последовательности, определенные в этом исследовании, обозначены черными кружками перед названием генотипа. Белые кружки указывают на генотипы, идентифицированные в Африке.
https://doi.org/10.1371/journal.pntd.0008419.g001
Обсуждение
В настоящее время имеется мало информации о встречаемости и распространении кишечных паразитов в Мозамбике [26–28], хотя проект GEMS значительно улучшил наше понимание эпидемиологии диареи, связанной с паразитами G . duodenalis , Cryptosporidium spp. И E . histolytica [15, 29]. Однако информации о микроспоридиях почти нет, и только одно исследование, направленное на изучение распространенности кишечных паразитарных инфекций в неформальном поселении в Бейре, Мозамбик, сообщило о E . bieneusi [27]. Они обнаружили E . bieneusi с помощью ПЦР в реальном времени у 9,3% (28/301) испытуемых, генотипирование не проводилось.Таким образом, насколько нам известно, это первое молекулярно-эпидемиологическое исследование, описывающее встречаемость и генетическое разнообразие E . bieneusi в Мозамбике. Общая распространенность E . Инфекция bieneusi в педиатрической популяции (0-14 лет) из Мозамбика, протестированная в этом исследовании, составила 0,7% (9/1247). Инфекции чаще выявлялись у бессимптомных детей в сельской местности.
Модель E . bieneusi уровни инфицирования среди детей в Замбезии (0.3%) и Мапуту (4%) были ниже, чем распространенность, зарегистрированная в Бейре в провинции Софала (9%) [27], что указывает на потенциальные различия в географическом распределении паразита в Мозамбике. Несоответствие также может быть связано с различиями в социально-экономических характеристиках изучаемого населения, поскольку исследование в Бейре проводилось в неформальном поселении в районе, который часто бывает затоплен и не подключен к канализационной системе после того, как местная больница заметила большое количество случаев диареи. в этом поселке.Распространенность в Мозамбике (0,7%) ниже, чем в других африканских странах, включая Демократическую Республику Сан-Томе и Принсипи [30], Нигерию [31], Южную Африку [ 32] и Уганде [33], и намного ниже, чем в аналогичных педиатрических популяциях (диапазон: 20-67%) в Камеруне [16], Нигерии [17] и Танзании [34] (см. Таблицу 1). Однако на распространенность влияют возрастная группа, выбранная в исследовании, и наличие симптомов, поэтому при сравнении исследований необходимо учитывать эти различия.
Примечательно указать, что все E . bieneusi -позитивные дети также были инфицированы другими патогенами, в том числе двое детей из Маничи, которые были ВИЧ-позитивными. Действительно, было обнаружено от одного до трех дополнительных кишечных паразитов ( G . duodenalis , Cryptosporidium spp., Blastocystis sp. И Strongyloides spp.), И наиболее сильные ассоциации риска были с G . duodenalis и Cryptosporidium spp.Эти данные четко отражают высокоэндемичный сценарий, при котором полипаразитизм является обычным явлением, как ранее сообщалось в городе Бейра [27].
Наше исследование ограничено небольшим количеством положительных образцов, следовательно, широким доверительным интервалом для наших результатов. Более того, подробная информация о мытье рук (с использованием мыла или без него) и использовании уборных (туалет или вне туалета) была недоступна в наборе данных Замбезии, а отсутствующие значения для источника воды и домашнего скота в наборе данных Мапуту подразумевали ограниченное изучение этих ассоциаций, особенно учитывая небольшое количество случаев.
Анализ нуклеотидной последовательностив области ITS в девяти положительных случаях выявил наличие четырех генотипов, трех из них сообщалось ранее (Peru11, Type IV и S2) и нового генотипа (названного HhMzEb1). Это первое сообщение об этих генотипах в Мозамбике. Генотипы типа IV и S2 были идентифицированы в Замбезии и Мапуту, в то время как Перу11 был идентифицирован только в Замбезии, а новый генотип HhMzEb1 — только в Мапуту. Все генотипы, идентифицированные в настоящем исследовании, включая новый HhMzEb1, принадлежали к группе 1 (рис. 1), которая включает E . bieneusi генотипов с низкой специфичностью к хозяину, которые обнаружены не только у людей, но также у домашних и диких животных во всем мире [10,11,14]. Это второй отчет о генотипе S2 у людей, о котором ранее сообщалось только в Малави от трех детей (2 ВИЧ-положительных и один ВИЧ-отрицательный) и восьми взрослых с ВИЧ [35]. Генотип типа IV (также ранее описывавшийся как K, Peru2, BEB5, CMITS1, BEB-var, PtEB III) широко обнаружен у людей в различных регионах мира [5,36–38], при этом в африканских странах было много сообщений о том, что включают Габон [36], Камерун [36,39], Уганду [40], Нигер [41], Нигерию [31,42,43], Демократическую Республику Сан-Томе и Принсипи [30] и Малави [35] (S5 Таблица).Кроме того, о типе IV сообщалось у широкого круга животных-хозяев, включая нечеловеческих приматов, крупного рогатого скота, кошек, собак, грызунов, птиц, змей и черных медведей (таблица S5), а также в пробах воды [44– 47]. Нет предыдущих сообщений о Перу11 (также ранее сообщалось как Перу12) у людей в Африке, но он был обнаружен у людей в Азии и Южной Америке (таблица S5). В Африке Peru11 был найден у павиана в Кении [48]. Кроме того, есть сообщения об этом генотипе в других частях мира у нечеловеческих приматов, кошек, енотов, кроликов, грызунов и птиц (таблица S5).
В этом исследовании не было смешанных инфекций разными E . bieneusi генотипа были замечены с помощью ITS-PCR и секвенирования по Сэнгеру. Однако следует отметить, что сопутствующие инфекции, по-видимому, часто встречаются у людей в эндемичных районах. Действительно, разнообразие внутри изолята было продемонстрировано у детей с диареей в Уганде с использованием микросателлитных маркеров (в дополнение к ITS) и последующего клонирования и секвенирования продуктов ПЦР [49]. Эти данные не позволяют нам окончательно утверждать, что смешанные инфекции не встречаются в обследованном мозамбикском населении, поскольку методология, использованная в этом исследовании, не была выбрана для борьбы со смешанными инфекциями.Идентификация потенциально зоонозных генотипов Peru11 и типа IV, которые обычно встречаются не только у людей, но также у домашних и диких животных во всем мире, указывает на возможность зоонозной или межвидовой передачи. На африканском континенте мало исследований, которые включают молекулярную характеристику E . bieneusi у человека и животных. Однако образцы окружающей среды (воды) также следует рассматривать как источник инфекции микроспоридиями, как E .Было продемонстрировано, что bieneusi участвует во вспышках заболеваний желудочно-кишечного тракта, передаваемых через воду [50]. Наши результаты подчеркивают необходимость дальнейших исследований для изучения ассоциаций риска, поскольку в нашем исследовании они были ограничены низкой распространенностью и отсутствием информации. Исследования могут включать воду, а также животных, которые могут контактировать с популяциями людей в Мозамбике, чтобы понять способы передачи E . bieneusi и, по аналогии, других видов кишечных простейших, вызывающих диарею.
Выводы
Это первое молекулярное исследование E . bieneusi в Мозамбике. Паразит в основном был обнаружен у бессимптомных детей в Мапуту (округ Манхиса) и провинции Замбезия. Молекулярная характеристика выявила новый генотип (HhMzEb1) и три известных генотипа (тип IV, Peru11 и S2) у диарейных и здоровых мозамбикских детей. Идентификация генотипов, ранее описанных у животных, предполагает потенциальную зоонозную и антропонозную передачу.Отсутствует информация о E . bieneusi на африканском континенте у людей, животных-хозяев и образцов окружающей среды. С точки зрения единого здоровья, необходимы дальнейшие исследования генотипирования, чтобы лучше понять эпидемиологию этого паразита.
Благодарности
Мы благодарим детей и их опекунов, которые участвовали в исследовании, а также клинический, полевой и лабораторный персонал, который неустанно работал над тем, чтобы сбор данных и лабораторные исследования проводились в соответствии с протоколами.Мы также благодарим все местные органы власти (окружные управления здравоохранения и образования в Замбезии и Манхисе) и всех лидеров сообществ за поддержку исследования.
Ссылки
- 1. Didier ES, Weiss LM. Микроспоридиоз: текущее состояние. Curr Opin Infect Dis. 2006; 19: 485–492. pmid: 16940873
- 2. Стентифорд Дж. Д., Бекнель Дж. Дж., Вайс Л. М., Килинг П. Дж., Дидье Е. С., Уильямс БАП и др. Микроспоридии — новые патогены в глобальной пищевой цепи.Trends Parasitol. 2016; 32: 336–348. pmid: 26796229
- 3. Вайс Л.М., Бекнель Дж.Л. Микроспоридии: возможные возбудители. Нью-Джерси: Уилли-Блэквелл; 2014.
- 4. Лобо М.Л., Сяо Л., Антунес Ф., Матос О. Микроспоридии как новые патогены и их значение для общественного здравоохранения: 10-летнее исследование ВИЧ-положительных и отрицательных пациентов. Int J Parasitol. 2012; 42: 197–205. pmid: 22265899
- 5. Сантин М. Enterocytozoon bieneusi .В: Сяо Л., Райан У, Фэн И, редакторы. Биология пищевых паразитов. Бока-Ратон: CRC Press; 2015. С. 149–174.
- 6. дель Агила С., Лопес-Велес Р., Феной С., Турриентес С., Кобо Дж., Навахас Р. и др. Идентификация спор Enterocytozoon bieneusi в респираторных образцах от пациента со СПИДом с двухлетним анамнезом кишечного микроспоридиоза. J Clin Microbiol. 1997; 35: 1862–1866. pmid: 10
- 7. Huibers MHW, Moons P, Maseko N, Gushu MB, Iwajomo OH, Heyderman RS и др.Мультиплексная ПЦР-детекция кишечных простейших в реальном времени у ВИЧ-инфицированных детей в Малави: Enterocytozoon bieneusi — обычное явление, связанное с желудочно-кишечными жалобами и может задерживать восстановление ИМТ (статуса питания). Pediatr Infect Dis J. 2018; 37: 910–915. pmid: 29762365
- 8. Рогавски Е.Т., Лю Дж., Платтс-Миллс Дж. А., Кабир Ф., Лертсеттакарн П., Сигуас М. и др. Использование количественных молекулярных методов диагностики для исследования влияния энтеропатогенных инфекций на линейный рост детей в условиях ограниченных ресурсов: продольный анализ результатов когортного исследования MAL-ED.Ланцет Glob Health. 2018; 6: e1319 – e1328. pmid: 30287125
- 9. Сантин М., Файер Р. Микроспоридиоз: Enterocytozoon bieneusi у домашних и диких животных. Res Vet Sci. 2011; 90: 363–371. pmid: 20699192
- 10. Ли В., Фен Й, Сантин М. Специфичность хозяина Enterocytozoon bieneusi и последствия для общественного здравоохранения. Trends Parasitol. 2019; 35: 436–451. pmid: 31076351
- 11. Ли В., Фэн И, Чжан Л., Сяо Л. Потенциальное влияние специфичности хозяина на зоонозную или межвидовую передачу Enterocytozoon bieneusi .Заразить Genet Evol. 2019; 104033. pmid: 31494271
- 12. Матис А., Вебер Р., Деплазес П. Зоонозный потенциал микроспоридий. Clin Microbiol Rev.2005; 18: 423–445. pmid: 16020683
- 13. Искьердо Ф., Кастро Хермида Дж. А., Феной С., Мезо М., Гонсалес-Варлета М., дель Агила С. Обнаружение микроспоридий в питьевой воде, сточных водах и рекреационных реках. Water Res. 2011; 45: 4837–4843. pmid: 21774958
- 14. Сантин М., Файер Р. Номенклатура генотипов Enterocytozoon bieneusi на основе внутренней транскрибируемой спейсерной последовательности: консенсус.J Eukaryot Microbiol. 2009; 56: 34–38. pmid: 19335772
- 15. Kotloff KL, Nataro JP, Blackwelder WC, Nasrin D, Farag TH, Panchalingam S и др. Бремя и этиология диарейных заболеваний у младенцев и детей раннего возраста в развивающихся странах (Глобальное многоцентровое исследование кишечных заболеваний, GEMS): проспективное исследование случай-контроль. Ланцет. 2013; 382: 209–222. pmid: 23680352
- 16. Нкинин С.В., Асонганьи Т., Дидье Е.С., Канеширо Е.С. Инфекция микроспоридий распространена среди здоровых людей в Камеруне.J Clin Microbiol. 2007. 45: 2841–2846. pmid: 17609328
- 17. Ике Э.И., Обадофин М.О., Бриндейро Б., Баугерб С., Фрост Ф., Вандерджагт Д. и др. Кишечный паразитизм в сельской деревне Магама Гумау и поселке Джос на севере центральной части Нигерии. Niger Postgrad Med J. 2007; 14: 290–295. pmid: 18163136
- 18. Sacoor C, Nhacolo A, Nhalungo D, Aponte JJ, Bassat Q, Augusto O, et al., Профиль: Центр исследований здоровья Манхиса (Manhiça HDSS). Int J Epidemiol. 2013; 42: 1309–1318.pmid: 24159076
- 19. Алонсо П., Саут Ф., Апонте Дж., Гомес-Оливе Ф., Нхаколо А., Томсон Р. и др. Manhiça DSS, Мозамбик. Vol. 1, Население и здоровье в развивающихся странах. 2002. 189–195 с.
- 20. Kotloff KL, Blackwelder WC, Nasrin D, Nataro JP, Farag TH, van Eijk A, et al. Глобальное многоцентровое исследование кишечных заболеваний (GEMS) диарейных заболеваний у детей грудного и раннего возраста в развивающихся странах: эпидемиологические и клинические методы исследования случай / контроль.Clin Infect Dis. 2012; 55: S232 – S245. pmid: 23169936
- 21. Панчалингам С., Антонио М., Хоссейн А., Мандомандо I, Очиенг Б., Оундо Дж. И др. Диагностические микробиологические методы в исследовании случай / контроль GEMS-1. Clin Infect Dis. 2012; 55: S225 – S231.
- 22. Бакхольт М.А., Ли Дж. Х., Ципори С. Распространенность Enterocytozoon bieneusi у свиней: 18-месячное обследование на бойне в Массачусетсе. Appl Environ Microbiol. 2002; 68: 2595–2599. pmid: 11976142
- 23.Кумар С., Стечер Г., Ли М., Князь К., Тамура К., Баттистуцци Ф.У. MEGA X: молекулярно-эволюционный генетический анализ на вычислительных платформах. Мол. Биол. Evol. 2018; 35: 1547–1549. pmid: 29722887
- 24. Сайтоу Н., Ней М. Метод объединения соседей: новый метод реконструкции филогенетических деревьев. Mol Biol Evol. 1987; 4: 406–425. pmid: 3447015
- 25. Хайнце Г., Шемпер М. Решение проблемы разделения в логистической регрессии. Stat Med.2002; 21: 2409–2419. pmid: 12210625
- 26. Ирисарри-Гутьеррес MJ, Mingo MH, de Lucio A, Gil H, Morales L., Seguí R, et al. Связь между кишечными простейшими паразитами и желудочно-кишечными заболеваниями среди людей, инфицированных ВИЧ и туберкулезом, в районе Чоук на юге Мозамбика. Acta Trop. 2017; 170: 197–203. pmid: 28302528
- 27. Meurs L, Polderman AM, Vinkeles Melchers NV, Brienen EA, Verweij JJ, Groosjohan B и др. Диагностика полипаразитизма в условиях высокой распространенности в Бейре, Мозамбик: обнаружение кишечных паразитов в образцах фекалий с помощью микроскопии и ПЦР в реальном времени.PLoS Negl Trop Dis. 2017; 11: e0005310. pmid: 28114314
- 28. Аугусто Г., Нала Р., Касмо В., Сабонете А., Мапако Л., Монтейро Дж. Географическое распространение и распространенность шистосомоза и гельминтов, передающихся через почву, среди школьников в Мозамбике. Am J Trop Med Hyg. 2009. 81: 799–803. pmid: 19861614
- 29. Kotloff KL, Nasrin D, Blackwelder WC, Wu Y, Farag T., Panchalingham S, et al. Частота, этиология и неблагоприятные клинические последствия менее тяжелых эпизодов диареи среди младенцев и детей, проживающих в странах с низким и средним уровнем дохода: 12-месячное исследование случай-контроль в качестве продолжения Глобального многоцентрового исследования кишечника (GEMS ).Ланцет Glob Health. 2019; 7 (5): e568 – e584. pmid: 31000128
- 30. Lobo ML, Augusto J, Antunes F, Ceita J, Xiao L, Codices V и др. Cryptosporidium spp., Giardia duodenalis , Enterocytozoon bieneusi и другие кишечные паразиты у маленьких детей в провинции Лобата, Демократическая Республика Сан-Томе и Принсипи. PLoS One. 2014; 9: e97708. pmid: 24846205
- 31. Ayinmode AB, Ojuromi OT, Xiao L. Молекулярная идентификация изолятов Enterocytozoon bieneusi от детей Нигерии.J Parasitol Res. 2011; 129542. pmid: 22132304
- 32. Сами А., Оби С.Л., Ципори С., Вайс Л.М., Геррант Р.Л. Микроспоридиоз в Южной Африке: обнаружение ПЦР в образцах стула ВИЧ-положительных и ВИЧ-отрицательных лиц и школьников в районе Вхембе, провинция Лимпопо. Trans R Soc Trop Med Hyg. 2007; 101: 547–554. pmid: 17412378
- 33. Тамвин Дж. К., Кекитиинва А., Бакира-Китака С., Ндизи Дж., Даунинг Р., Фэн Х и др. Криптоспоридиоз и микроспоридиоз у детей Уганды с постоянной диареей с одновременным инфицированием вирусом иммунодефицита человека и без него.Am J Trop Med Hyg. 2005; 73: 921–925. pmid: 16282304
- 34. Цегельски Дж. П., Ортега Ю. Р., Макки С., Мэдден Дж. Ф., Гайдо Л., Шварц Д. А. и др. Cryptosporidium , Enterocytozoon и Cyclospora инфекции у детей и взрослых пациентов с диареей в Танзании. Clin Infect Dis. 1999; 28: 314–321. pmid: 10064250
- 35. тен Хов Р.Дж., Ван Лисхаут Л., Бидсворт М.Б., Перес М.А., Спее К., Клаас Э.С. и др. Характеристика генотипов Enterocytozoon bieneusi в иммуносупрессивных и иммунокомпетентных группах пациентов.J Eukaryot Microbiol. 2009; 56: 388–393 pmid: 19602086
- 36. Бретон Дж., Барт-Делабесс Э., Билигуи С., Карбон А, Сейлер Х, Окоме-Нкуму М. и др. Новая сильно дивергентная последовательность рРНК среди биоразнообразных генотипов штаммов Enterocytozoon bieneusi , выделенных от людей в Габоне и Камеруне. J Clin Microbiol. 2007. 45: 2580–2589. pmid: 17537939
- 37. Ван Л., Чжан Х., Чжао Х, Чжан Л., Чжан Г., Го М. и др. Зоонозный Cryptosporidium видов и Enterocytozoon bieneusi генотипов у ВИЧ-положительных пациентов, получающих антиретровирусную терапию.J Clin Microbiol. 2013; 51: 557–563. pmid: 23224097
- 38. Сулейман И.М., Берн С., Гилман Р., Кама В., Кавай В., Варгас Д. и др. Молекулярно-биологическое исследование Enterocytozoon bieneusi у ВИЧ-инфицированных пациентов в Лиме, Перу. J Eukaryot Microbiol. 2003; 50: S591 – S596.
- 39. Сарфати С., Буржуа А., Менотти Дж., Льежуа Ф., Моё-Сомо Р., Делапорте Е. и др. Распространенность кишечных паразитов, включая микроспоридии, у взрослых, инфицированных вирусом иммунодефицита человека, в Камеруне: кросс-секционное исследование.Am J Trop Med Hyg. 2006. 74: 162–164. pmid: 16407362
- 40. Tumwine JK, Kekitiinwa A, Nabukeera N, Akiyoshi DE, Buckholt MA, Tzipori S. Enterocytozoon bieneusi среди детей с диареей, посещающих больницу Мулаго в Уганде. Am J Trop Med Hyg. 2002. 67: 299–303. pmid: 12408671
- 41. Эсперн А., Морио Ф., Мигевиль М., Илла Х., Абдулай М., Мейссонье В. и др. Молекулярное исследование микроспоридиоза, вызванного Enterocytozoon bieneusi и Encephalitozoon Кишечник среди пациентов, инфицированных вирусом иммунодефицита человека из двух географических регионов: Ниамей, Нигер, и Ханоя, Вьетнам.J Clin Microbiol. 2007. 45: 2999–3002. pmid: 17634305
- 42. Maikai BV, Umoh JU, Lawal IA, Kudi AC, Ejembi CL, Xiao L. Молекулярные характеристики Cryptosporidium , Giardia и Enterocytozoon у людей в штате Кадуна, Нигерия. Exp Parasitol. 2012; 131: 452–456. pmid: 22664352
- 43. Akinbo FO, Okaka CE, Omoregie R, Dearen T., Leon ET, Xiao L. Молекулярно-эпидемиологическая характеристика Enterocytozoon bieneusi у ВИЧ-инфицированных в Бенин-Сити, Нигерия.Am J Trop Med Hyg. 2012; 86: 441–445. pmid: 22403314
- 44. Ye J, Xiao L, Ma J, Guo M, Liu L, Feng Y. Антропонические кишечные паразиты у обезьян в общественном парке, Китай. Emerg Infect Dis. 2012; 18: 1640–1643. pmid: 23017776
- 45. Ben Ayed L, Yang W, Widmer G, Cama V, Ortega Y, Xiao L. Обследование и генетическая характеристика сточных вод в Тунисе на предмет Cryptosporidium spp., Giardia duodenalis , Enterocytozoon bieneusi , Cyclospora Eimeria spp.J Здоровье воды. 2012; 10: 431–444. pmid: 22960487
- 46. Грачик Т.К., Люси Ф.Е., Машинский Ю., Эндрю Томпсон Р.С., Кору О, Дасильва А.Дж. Зоонозные энтеропатогены человека в искусственно созданных водно-болотных угодьях со свободным водным потоком. Parasitol Res. 2009. 105: 423–428. pmid: 19343366
- 47. Ли Н, Сяо Л., Ван Л., Чжао С., Чжао Х, Дуань Л. и др. Молекулярный надзор за Cryptosporidium spp., Giardia duodenalis и Enterocytozoon bieneusi путем генотипирования и подтипирования паразитов в сточных водах.PLoS Negl Trop Dis. 2012; 6: e1809. pmid: 22970334
- 48. Ли В., Киулия Н.М., Мвенда Дж. М., Ньячео А., Тейлор МБ, Чжан Х и др. Cyclospora papionis , Cryptosporidium hominis и патогенный для человека Enterocytozoon bieneusi у павианов в неволе в Кении. J Clin Microbiol. 2011; 49: 4326–4329. pmid: 21956988
- 49. Видмер Дж., Дило Дж., Тамвин Дж. К., Ципори С., Акиёси Д. Э. Частая встречаемость смешанных инфекций Enterocytozoon bieneusi у людей.Appl Environ Microbiol. 2013; 79: 5357–5362. pmid: 23811516
- 50. Ван Л., Сяо Л., Дуань Л., Е Дж, Го Ю., Го М. и др. Сопутствующие инфекции Giardia duodenalis , Enterocytozoon bieneusi и Clostridium difficile у детей во время вспышки криптоспоридиоза в педиатрической больнице в Китае. PLoS Negl Trop Dis. 2013; 7: e2437. pmid: 24069491
- 51. Ndzi ES, Asonganyi T., Nkinin MB, Xiao L, Didier ES, Bowers LC и др.Быстрый технологический анализ позволяет идентифицировать виды и генотипы латентных инфекций Microsporidia у здоровых коренных жителей Камеруна. J Eukaryot Microbiol. 2016; 63: 146–152. pmid: 26303263
- 52. Raccurt CP, Agnamey P, Sarfati C, Chouaki T, Totet A. [Кишечный микроспоридиоз, вызванный Enterocytozoon bieneusi у пациента, инфицированного ВИЧ-1: первый зарегистрированный случай в Чаде]. Med Trop. 2008. 68: 307–308.
- 53. Wumba R, Jean M, Benjamin LM, Madone M, Fabien K, Josué Z и др. Идентификация Enterocytozoon bieneusi с использованием полимеразной цепной реакции в реальном времени и полиморфизма длин рестрикционных фрагментов у ВИЧ-инфицированных людей из провинции Киншаса Демократической Республики Конго. J Parasitol Res. 2012: 278028. pmid: 22811884
- 54. Вумба Р., Лонго-Мбенса Б., Мандина М., Одио В. Т., Билигуи С., Сала Дж. И др. Инфекции кишечных паразитов у госпитализированных больных СПИДом в Киншасе, Демократическая Республика Конго. Паразит. 2010. 17: 321–328.pmid: 21275238
- 55. Wumba R, Enache-Angoulvant A, Develoux M, Mulumba A, Mulumba PM, Hennequin C и др. [Распространенность оппортунистических пищеварительных паразитарных инфекций в Киншасе, Демократическая Республика Конго. Результаты предварительного исследования 50 больных СПИДом. Med Trop (Марс). 2007. 67: 145–148. pmid: 176
- 56. Endeshaw T, Kebede A, Verweij JJ, Wolday D, Zewide A, Tsige K и др. Выявление микроспоридиоза кишечника у больных с диареей, инфицированных вирусом иммунодефицита человека (ВИЧ-1), с помощью ПЦР и окрашивания Увитекс-2В.Эфиоп Мед Дж. 2005; 43: 97–101. pmid: 16370539
- 57. Endeshaw T., Kebede A, Verweij JJ, Zewide A, Tsige K, Abraham Y, et al. Микроспоридиоз кишечника у пациентов с диареей, инфицированных вирусом иммунодефицита человека-1, в Аддис-Абебе, Эфиопия. Jpn J Infect Dis. 2006. 59: 306–310. pmid: 17060696
- 58. Мвачари К., Бэтчелор Б.И., Пол Дж., Вайяки П.Г., Гилкс К.Ф. Хроническая диарея среди ВИЧ-инфицированных взрослых пациентов в Найроби, Кения. J Infect. 1998. 37: 48–53. pmid: 9733379
- 59.Грейгерт В., Абу-Бакар А., Брюнет Дж., Нурриссон С., Пфафф А.В., Бенарбия Л. и др. Человеческие кишечные паразиты в Махаджанге, Мадагаскар: царство простейших. PLoS One 2018; 13: e0204576. pmid: 30304028
- 60. Майга I, Думбо О, Дембеле М., Траоре Х., Деспортес-Ливаж I, Хилмарсдоттир I и др. [Микроспоридиоз кишечника человека в Бамако (Мали): присутствие Enterocytozoon bieneusi у ВИЧ-инфицированных пациентов]. Санте. 1997. 7: 257–262. pmid: 9410452
- 61.Альфа Сиссе О, Уаттара А., Телье М., Аккосберри I, Билигуи С., Минта Д. и др. Оценка иммунофлуоресцентного теста на антитела с использованием моноклональных антител, направленных против Enterocytozoon bieneusi и Encephalitozoon Кишечник для диагностики кишечного микроспоридиоза в Бамако (Мали). J Clin Microbiol. 2002; 40: 1715–1718. pmid: 11980948
- 62. Бретань С., Фуле Ф., Алкассум В., Флери-Фейт Дж., Девелу М. [Распространенность спор Enterocytozoon bieneusi в стуле больных СПИДом и африканских детей, не инфицированных ВИЧ].Bull Soc Pathol Exot. 1993. 86: 351–357. pmid: 8124104
- 63. Ayinmode AB, Zhang H, Dada-Adegbola HO, Xiao L. Подтипы Cryptosporidium hominis и генотипы Enterocytozoon bieneusi у ВИЧ-инфицированных в Ибадане, Нигерия. Зоонозы в области общественного здравоохранения. 2014; 61: 297–303. pmid: 23870732
- 64. Akinbo FO, Okaka CE, Omoregie R, Adamu H, Xiao L. Необычные генотипы Enterocytozoon bieneusi и подтипы Cryptosporidium hominis у ВИЧ-инфицированных пациентов, получающих высокоактивную антиретровирусную терапию.Am J Trop Med Hyg. 2013; 89: 157–161. pmid: 23629938
- 65. Оджуроми О.Т., Искьердо Ф., Феной С., Фагбенро-Бейоку А., Ойибо В., Аканму А. и др. Идентификация и характеристика микроспоридий в образцах кала ВИЧ-положительных пациентов из Лагоса, Нигерия. PLoS One. 2012; 7: e35239. pmid: 22496910
- 66. Оджуроми О. Т., Дуан Л., Искьердо Ф., Феной С. М., Ойибо В. А., Дель Агила С. и др. Генотипы Cryptosporidium spp. и Enterocytozoon bieneusi у пациентов, инфицированных вирусом иммунодефицита человека, в Лагосе, Нигерия.J Eukaryot Microbiol. 2016; 63: 414–418. pmid: 26662459
- 67. Чабчуб Н., Абдельмалек Р., Меллули Ф., Канун Ф., Телье М., Буратбин А. и др. Генетическая идентификация видов кишечных микроспоридий у пациентов с ослабленным иммунитетом в Тунисе. Am J Trop Med Hyg. 2009. 80: 24–27. pmid: 134
- 68. Абдельмалек Р., Анане С., Чабчуб Н., Эссид Р., Аун К., Шаабен Т. Б. и др. [Коинфекция микроспоридиями и криптоспоридиями у ВИЧ-инфицированных новорожденных]. Arch Pediatr.2011; 18: 562–564. pmid: 21458971
- 69. Анане С., Кауеч Э., Бельхадж С., Абдельмалек Р., Аммари Л., Бен Осман Т. и др. [Идентификация Enterocytozoon bieneusi с помощью ПЦР в стуле тунисских пациентов с ослабленным иммунитетом]. Pathol Biol. 2011; 59: 234–239. pmid: 19481368
- 70. Чабчуб Н., Абдельмалек Р., Исса С., Канун Ф., Бен Чаабене Т., Буратбин А. и др. Приложение ПЦР для исследования и идентификации кишечных микроспоридий после заражения вирусом VIH.Pathol Biol. 2012; 60: 91–94.
- 71. Чабчуб Н., Абдельмалек Р., Бретон Дж., Канун Ф., Телье М., Буратбин А. и др. Идентификация генотипа изолятов Enterocytozoon bieneusi из образцов кала ВИЧ-инфицированных тунисских пациентов. Паразит. 2012; 19: 147–151. pmid: 22550625
- 72. Айсса С., Чабчуб Н., Абдельмалек Р., Канун Ф., Губантини А., Аммари Л. и др. Бессимптомное кишечное носительство микроспоридий у ВИЧ-инфицированных пациентов в Тунисе: распространенность, виды и патогенез.Med Sante Trop. 2017; 27: 281–285. pmid: 28947404
- 73. Лукас С.Б., Пападаки Л., Конлон С., Севанкамбо Н., Гудгейм Р., Сервадда Д. Диагностика кишечного микроспоридиоза у пациентов со СПИДом. J Clin Pathol. 1989; 42: 885–887.
- 74. Hautvast JL, Tolboom JJ, Derks TJ, Beckers P, Sauerwein RW. Бессимптомный микроспоридиоз кишечника у серонегативного по вирусу иммунодефицита человека, иммунокомпетентного ребенка Замбии. Pediatr Infect Dis J. 1997; 16: 415–416. pmid: 48
- 75.ван Гул Т., Людерхофф Э., Натху К.Дж., Киире К.Ф., Данкерт Дж., Мейсон ПР. Высокая распространенность инфекции Enterocytozoon bieneusi среди ВИЧ-инфицированных с постоянной диареей в Хараре, Зимбабве. Trans R Soc Trop Med Hyg. 1995; 89: 478–480. pmid: 8560514
- 76. Карвилл А., Мэнсфилд К., Видмер Дж., Лакнер А., Котлер Д., Уист П. и др. Разработка и применение генетических зондов для обнаружения Enterocytozoon bieneusi в стуле, фиксированном формалином, и в биоптатах кишечника инфицированных пациентов.Clin Diagn Lab Immunol. 1997. 4: 405–408. pmid: 55
- 77. Гамбо Т., Сарбах С., Гангайдзо ИТ, Ортега Ю., Стерлинг С.Р., Карвилл А. и др. Кишечные паразиты у пациентов с диареей и инфекцией вируса иммунодефицита человека в Зимбабве. СПИД. 1999; 13: 819–821. pmid: 10357381
- 78. Гамбо Т., Гангайдзо ИТ, Сарбах С., Карвилл А., Ципори С., Уист П.М. Enterocytozoon bieneusi у пациентов без признаков иммуносупрессии: в двух случаях из Зимбабве с помощью ПЦР был обнаружен положительный стул.Ann Trop Med Parasitol. 2000; 94: 699–702. pmid: 11144811
Tinea Capitis: Предпосылки, патофизиология, этиология
Rayala BZ, Morrell DS. Общие кожные заболевания у детей: кожные инфекции. ФП Ессент . 2017 Февраль 453: 26-32. [Медлайн].
Veasey JV, Miguel BAF, Mayor SAS, Zaitz C, Muramatu LH, Serrano JA. Эпидемиологический профиль tinea capitis в Сан-Паулу. Бюстгальтеры Dermatol .2017 март-апрель. 92 (2): 283-284. [Медлайн].
Fu M, Ge Y, Chen W, Feng S, She X, Li X и др. Tinea faciei у новорожденного, вызванная Trichophytontonsurans. Дж Биомед Рес . 2013 27 января (1): 71-4. [Медлайн]. [Полный текст].
Seebacher C, Bouchara JP, Mignon B. Последние данные по эпидемиологии дерматофитных инфекций. Микопатология . 2008 ноябрь-декабрь. 166 (5-6): 335-52. [Медлайн].
Кондо М, Накано Н, Шираки Й, Хирума М, Икеда С., Сугита Т.Китайско-японский мальчик со стригущим лишаем, вызванным Trichophyton violaceum. J Дерматол . 2006 марта 33 (3): 165-8. [Медлайн].
Абдель-Рахман С.М., Фарранд Н., Шуенеманн Э., Штеринг Т.К., Пройетт Б., Мэги Р. и др. Распространенность инфекций Trichophytontonsurans у школьников: исследование CAPITIS. Педиатрия . 2010 май. 125 (5): 966-73. [Медлайн].
Mirmirani P, Tucker LY. Эпидемиологические тенденции в педиатрическом дерматомикозе головы: популяционное исследование, проведенное Kaiser Permanente в Северной Калифорнии. J Am Acad Dermatol . 2013. 69 (6): 916-21. [Медлайн].
Hogewoning A, Amoah A, Bavinck JN, Boakye D, Yazdanbakhsh M, Adegnika A, et al. Кожные заболевания у школьников в Гане, Габоне и Руанде. Инт Дж Дерматол . 2013 г. 4 апреля [Medline].
Pai VV, Hanumanthayya K, Tophakhane RS, Nandihal NW, Kikkeri NS. Клиническое исследование Tinea capitis в Северной Карнатаке: трехлетний опыт работы в одном институте. Индийский дерматол онлайн J . 2013 января, 4 (1): 22-6. [Медлайн]. [Полный текст].
Fulgence KK, Abibatou K, Vincent D, Henriette V, Etienne AK, Kiki-Barro PC, et al. Tinea capitis у школьников на юге Кот-д’Ивуара. Инт Дж Дерматол . 2013 апр. 52 (4): 456-60. [Медлайн].
Такур Р. Tinea capitis в Ботсване. Clin Cosmet Investig Dermatol . 2013. 6: 37-41. [Медлайн]. [Полный текст].
Leiva-Salinas M, Marin-Cabanas I, Betlloch I, Tesfasmariam A, Reyes F, Belinchon I, et al.Tinea capitis у школьников в сельской местности на юге Эфиопии. Инт Дж Дерматол . 2015 июл.54 (7): 800-5. [Медлайн].
Насир С., Ральф Н., О’Нил С., Канни Р., Ленан П., О’Доннелл Б. Тенденции развития дерматомикоза в ирландской педиатрической популяции и сравнение щеток для кожи головы и соскобов в качестве методов исследования. Педиатр дерматол . 2013 22 февраля [Medline].
Фуллер Л.С., Чайлд Ф.Дж., Миджли Дж., Хиггинс Э.М.Диагностика и лечение стригущего лишая волосистой части головы. BMJ . 2003 8 марта. 326 (7388): 539-41. [Медлайн].
Джайн Н., Доши Б., Хопкар У. Трихоскопия при алопеции: упрощенная диагностика. Инт Дж. Трихология . 2013 Октябрь 5 (4): 170-8. [Медлайн]. [Полный текст].
Park J, Kim JI, Kim HU, Yun SK, Kim SJ. Трихоскопические данные об облысении у корейцев. Энн Дерматол . 2015 27 октября (5): 539-50. [Медлайн].
Lacarrubba F, Micali G, Tosti A.Дерматоскопия кожи головы или трихоскопия. Curr Probl Dermatol . 2015 Февраль 47: 21-32. [Медлайн].
Сахин ГО, Дадачи З, Озер ТТ. Два случая tinea ciliaris с блефаритом, вызванными Microsporum audouinii и Trichophyton verrucosum, и обзор литературы. Микозы . 2014 г., 13 апреля [Medline].
Акбаба М., Илкит М., Сутолук З., Атес А., Зорба Х. Сравнение методов расчески, зубной щетки и ватного тампона для диагностики бессимптомного носительства дерматофитов на коже черепа. J Eur Acad Dermatol Venereol . 2008 22 марта (3): 356-62. [Медлайн].
Le M, Gabrielli S, Ghazawi FM, Alkhodair R, Sheppard DC, Jafarian F. Эффективность и достоинства методики ватного тампона для диагностики дерматомикоза у детей. J Am Acad Dermatol . 2020 12 января [Medline].
Фридлендер С.Ф., Пикеринг Б., Каннингем Б.Б., Гиббс Н.Ф., Эйхенфилд Л.Ф. Использование метода ватного тампона в диагностике опоясывающего лишая на голове. Педиатрия . 1999, август 104 (2, часть 1): 276-9. [Медлайн].
Бонифаз А., Иса-Иса Р., Араиза Дж., Крус С., Эрнандес Массачусетс, Понсе Р.М. Метод цитощетокультуры для диагностики опоясывающего лишая на голове. Микопатология . 2007 июн. 163 (6): 309-13. [Медлайн].
Peixoto RRGB, Meneses OMS, da Silva FO, Donati A, Veasey JV. Tinea Capitis: корреляция клинических аспектов, результатов прямого микологического исследования и агентов, выделенных из грибковой культуры. Инт Дж. Трихология . 2019 ноя-дек. 11 (6): 232-235. [Медлайн].
Trovato MJ, Schwartz RA, Janniger CK. Tinea capitis: современные концепции в клинической практике. Cutis . 2006 Февраль 77 (2): 93-9. [Медлайн].
Aqil N, BayBay H, Moustaide K, Douhi Z, Elloudi S, Mernissi FZ. Проспективное исследование дерматоскопа у детей: упрощение диагностики с помощью дерматоскопа. J Медицинский чемоданчик, Rep . 2018 28 декабря. 12 (1): 383.[Медлайн].
Schechtman RC, Silva ND, Quaresma MV, Bernardes Filho F, Buçard AM, Sodré CT. Дерматоскопические данные как дополнительный инструмент в дифференциальной диагностике этиологического агента дерматомикоза на голове. Бюстгальтеры Dermatol . 2015 май-июнь. 90 (3 Дополнение 1): 13-5. [Медлайн].
Slowinska M, Rudnicka L, Schwartz RA, et al. Волосы-запятая: дерматоскопический маркер опоясывающего лишая: быстрый метод диагностики. J Am Acad Dermatol .2008, ноябрь 59 (5 приложение): S77-9. [Медлайн].
Шемер А., Плотник И.Б., Давидовичи Б., Грюнвальд М.Х., Магун Р., Амихай Б. Лечение дерматомикоза на голове — гризеофульвин по сравнению с флуконазолом — сравнительное исследование. J Dtsch Dermatol Ges . 2013 10 апреля [Medline].
Шемер А., Плотник И.Б., Давидовичи Б., Грюнвальд М.Х., Магун Р., Амихай Б. Лечение дерматомикоза на голове — гризеофульвин по сравнению с флуконазолом — сравнительное исследование. J Dtsch Dermatol Ges .2013 10 апреля [Medline].
Бханусали Д., Коли М., Сильверберг Д.И., Алексис А., Сильверберг Н.Б. Результаты лечения опоясывающего лишая у людей с цветной кожей. J Лекарства Дерматол . 2012 июл.11 (7): 852-6. [Медлайн].
Elewski BE. Кожные микозы у детей. Br J Дерматол . 1996 июнь 134 Дополнение 46: 7-11: обсуждение 37-8. [Медлайн].
Чен С., Ран Й, Дай Й, Лама Дж, Ху В., Чжан К.Введение пероральной капсулы итраконазола с цельным молоком демонстрирует повышенную эффективность, подтвержденную сканирующей электронной микроскопией, у ребенка с Tinea Capitis, вызванным Microsporum canis. Педиатр дерматол . 2015 8 октября [Medline].
Гупта А.К., Майс Р.Р., Верстег С.Г., Пираччини Б.М., Шир Н.Х., Пиге В. и др. Tinea capitis у детей: систематический обзор лечения. J Eur Acad Dermatol Venereol . 2018 24 мая. [Medline].
Doss RW, Эль-Рифаи AA, Ради N, Эль-Шериф AY.Восприимчивость к антимикробным препаратам Tinea Capitis у детей из Египта. Индийский J Dermatol . 2018 март-апрель. 63 (2): 155-159. [Медлайн].
Джон А.М., Шварц Р.А., Джаннигер СК. Керион: раздраженный дерматомикоз. Инт Дж Дерматол . 2018 Январь 57 (1): 3-9. [Медлайн].
Williams JV, Honig PJ, McGinley KJ, Leyden JJ. Полуколичественное исследование дерматомикоза на голове и бессимптомного состояния носительства у школьников из городских районов. Педиатрия . 1995, август 96 (2, часть 1): 265-7. [Медлайн].
Уайт Дж. М., Хиггинс Э. М., Фуллер LC. Скрининг бессимптомного носительства Trichophytontonsurans в домашних контактах с пациентами с дерматомикозом головы: результаты 209 пациентов из Южного Лондона. J Eur Acad Dermatol Venereol . 2007 сентября 21 (8): 1061-4. [Медлайн].
Pomeranz AJ, Sabnis SS, McGrath GJ, Esterly NB. Бессимптомные носители дерматофитов в семьях детей с опоясывающим лишаем головы. Arch Pediatr Adolesc Med . 1999 Май. 153 (5): 483-6. [Медлайн].
Гупта А.К., Купер Е.А., Боуэн Дж. Мета-анализ: эффективность гризеофульвина в лечении дерматомикоза на голове. J Лекарства Дерматол . 2008 г., 7 (4): 369-72. [Медлайн].
Fleece D, Gaughan JP, Aronoff SC. Сравнение гризеофульвина и тербинафина при лечении дерматомикоза: метаанализ рандомизированных клинических исследований. Педиатрия . 2004 ноя.114 (5): 1312-5. [Медлайн].
Gonzalez U, Seaton T, Bergus G, Jacobson J, Martinez-Monzon C. Системная противогрибковая терапия для опоясывающего лишая у детей. Кокрановская база данных Syst Rev . 17 октября 2007 г. CD004685. [Медлайн].
Гупта А.К., Хофстейдер С.Л., Адам П., Саммербелл Р.К. Tinea capitis: обзор с упором на лечение. Педиатр дерматол . 1999 май-июнь. 16 (3): 171-89. [Медлайн].
Koumantaki-Mathioudaki E, Devliotou-Panagiotidou D, Rallis E, et al.Является ли итраконазол препаратом выбора при Microsporum canis tinea capitis? Наркотики Exp Clin Res . 2005. 31 Suppl: 11-5. [Медлайн].
Фридлендер С.Ф., Али Р., Крафчик Б. и др. Тербинафин в лечении Trichophyton tinea capitis: рандомизированное двойное слепое исследование с определением продолжительности в параллельных группах. Педиатрия . 2002 апр. 109 (4): 602-7. [Медлайн].
Krafchik B, Pelletier J. Открытое исследование опоясывающего лишая у 50 детей, получавших 2-недельный курс перорального тербинафина. J Am Acad Dermatol . 1999 Июль 41 (1): 60-3. [Медлайн].
Ghannoum MA, Wraith LA, Cai B, Nyirady J, Isham N. Чувствительность изолятов дерматофитов, полученная в ходе крупного всемирного клинического исследования тербинафина tinea capitis. Br J Дерматол . 2008 Сентябрь 159 (3): 711-3. [Медлайн].
Elewski BE, Caceres HW, DeLeon L, et al. Пероральные гранулы тербинафина гидрохлорида по сравнению с пероральной суспензией гризеофульвина у детей с опоясывающим лишаем головы: результаты двух рандомизированных, слепых для исследователей, многоцентровых международных контролируемых исследований. J Am Acad Dermatol . 2008 июль 59 (1): 41-54. [Медлайн].
Тей Х.Л., Тан А.С., Чан Ю.С. Метаанализ рандомизированных контролируемых исследований, сравнивающих гризеофульвин и тербинафин при лечении дерматомикоза на голове. J Am Acad Dermatol . 2011 Апрель 64 (4): 663-70. [Медлайн].
Фридлендер С.Ф., Али Р., Крафчик Б. и др. Тербинафин в лечении Trichophyton tinea capitis: рандомизированное двойное слепое исследование с определением продолжительности в параллельных группах. Педиатрия . 2002 апр. 109 (4): 602-7. [Медлайн].
Гупта AK, Лион, округ Колумбия. Взлет и падение перорального кетоконазола. Дж. Cutan Med Surg . 2015 июл-авг. 19 (4): 352-7. [Медлайн].
CDC — DPDx — микроспоридиоз
Возбудители
Микроспоридии представляют собой группу одноклеточных внутриклеточных паразитов, тесно связанных с грибами, хотя природа связи с царством грибов не ясна. Таксономическое положение этой группы неоднократно обсуждалось и пересматривалось; исторически они считались простейшими и часто остаются под контролем диагностических паразитологических лабораторий.Для микроспоридий характерно образование устойчивых спор разного размера (обычно 1–4 мкм для важных с медицинской точки зрения видов). Они обладают уникальной органеллой, полярным канальцем или полярной нитью, которая свернута внутри споры, что демонстрирует ее ультраструктура. Микроспоридии также обладают дегенерированными митохондриями, называемыми митосомами, и не имеют обычного аппарата Гольджи.
На сегодняшний день более 1400 видов, принадлежащих к более чем 200 родам, были описаны как паразиты, заражающие широкий круг позвоночных и беспозвоночных-хозяев.Существует по крайней мере 15 видов микроспоридий, которые были идентифицированы как патогены человека; подавляющее большинство случаев вызвано Enterocytozoon bieneusi, , за которыми следуют несколько видов Encephalitozoon видов ( E. cuniculi, E. hellem , E. кишечник ( = Septata) . К другим менее часто встречающимся возбудителям относятся представители рода Anncaliia (= Brachiola ) ( A.algerae , A. connori, A. vesicularum ), Microsporidium ( M . ceylonensis , M. africanum ), Trachipleistophora ), Nosema ocularum , Pleistophora ronneafiei , Vittaforma corneae (= , скорее всего, Nosema corneae (= Nosema corneae ) Endoreticulatus .
Жизненный цикл
Инфекционная форма микроспоридий представляет собой устойчивую спору, которая может сохраняться в окружающей среде в течение нескольких месяцев. Затем спора прорастает, быстро выворачивая свой полярный каналец, который контактирует с мембраной эукариотической клетки-хозяина. Затем спора вводит инфекционную спороплазму в клетку-хозяин через полярный каналец. Внутри клетки спороплазма входит в пролиферативную фазу, отмеченную обширным размножением через мерогонию (двойное деление или множественное деление), создавая меронты.Расположение этой стадии развития в клетке-хозяине варьируется в зависимости от рода; это может происходить либо в прямом контакте с цитозолем клетки-хозяина ( Enterocytozoon, Nosema ), внутри паразитофорной вакуоли неизвестного происхождения ( Encephalitozoon ), в секретируемой паразитами оболочке ( Pleistophora, Trachipleistophora ) или в окружении эндоплазматический ретикулум клетки-хозяина ( Endoreticulatus, Vittaforma ). После фазы пролиферации меронты претерпевают спорогонию, при которой развиваются толстые стенки спор и инвазионный аппарат, создавая споронты и в конечном итоге созревшие споры, когда все органеллы поляризованы.Когда количество спор увеличивается и они полностью заполняют цитоплазму клетки-хозяина, клеточная мембрана разрушается, и споры выделяются в окружающую среду. Эти свободные зрелые споры могут инфицировать новые клетки, продолжая цикл.
Зрелые споры видов, локализующихся в кишечнике, могут выделяться с фекалиями, хотя путь передачи для многих видов остается неясным. Воздействие спор в воде или почве, по-видимому, является потенциально основным путем, основанным на обнаружении спор в этих источниках вместе с историями болезни. E. bieneusi и V. corneae были обнаружены в поверхностных водах, а споры Nosema sp. (и, вероятно, A. algerae ) были обнаружены в канаве. Подтверждены случаи донорского микроспоридиоза ( Encephalitozoon cuniculi ) после трансплантации костного мозга, почек, печени и сердца.
Хосты
Многие домашние и дикие животные могут быть естественно инфицированы различными важными с медицинской точки зрения микроспоридиями. Enterocytozoon bieneusi обычно считается паразитом человека, но был обнаружен у свиней, приматов, крупного рогатого скота, кошек, собак и некоторых других млекопитающих. Некоторые, но не все из этих штаммов животного происхождения, по-видимому, представляют зоонозные генотипы.
Encephalitozoon cuniculi эндемичен для нескольких популяций диких и содержащихся в неволе кроликов. Иногда его также находили у домашних собак, кошек, лисиц, обезьян в неволе и норок. Птицы, особенно пситтацины (попугаи, попугаи, влюбленные птицы, волнистые попугаи и т. Д.)), может представлять резервуары для Encephalitozoon hellem . В отличие от двух других важных представителей рода, E. кишечник редко идентифицируется у животных, кроме человека.
Диапазон хозяев других микроспоридий, которые, как известно, инфицируют людей, не так хорошо известен. Животных-резервуаров для роговицы Vittaforma не выявлено. Pleistophora spp. обнаружены у рыб и рептилий, но морфология спор у этих видов несовместима с морфологией спор видов, вовлеченных в инфекции человека ( P.ronneafiei ). Tubulinosema acridophagus, Trachipleistophora spp. И Anncaliia algerae относятся к известным паразитам насекомых, однако значение насекомых в передаче неясно.
Географическое распространение
Микроспоридии все чаще признаются во всем мире как условно-патогенные инфекционные агенты. Продолжаются попытки охарактеризовать глобальное распространение видов и генотипов.
Микроспоридиоз человека представляет собой важное и быстро развивающееся оппортунистическое заболевание.Исторически это наблюдалось у лиц с тяжелым иммунодефицитом, особенно у людей со СПИДом, однако применение эффективных антиретровирусных методов лечения значительно снизило заболеваемость в этой группе. Известно также, что случаи заболевания возникают у иммунокомпетентных людей. Клинические проявления микроспоридиоза очень разнообразны и различаются в зависимости от причинного вида и пути заражения. Распространенная инфекция может быть смертельной. Из всех проявлений микроспоридиоза наиболее частым является диарея, связанная с Enterocytozoon bieneusi- .


