Острица (Enterobius vermicularis)
ОСТРИЦА, Enterobius vermicularis – контактный гельминт, возбу-
дитель энтеробиоза. Заболевание распространено повсеместно. По частоте встречаемости занимает первое место среди гельминтозов у детей (60-80% детей дошкольных учреждений).
Морфологические особенности (рис. 43): длина тела самки около 10
мм, самца – 2-5 мм, белого цвета.
Рис. 43. Морфология Enterobius vermicularis. А, Б, В – схемы, Г, Д, Е, Ж —
микрофотографии, А, Г, Д – самка, Б, Ж, — самец, В, Е – яйцо. 1 – везикула, 2 –
пищевод, 3 – бульбус, 4 — половое отверстие, 5 – матка, 6 – анальное отверстие.
На переднем конце тела находится вздутия кутикулы – везикулы, а в задней части пищевода шарообразное расширение – бульбус, участвующие в фиксации паразита к стенкам кишечника.
Цикл развития (рис. 44): острицы локализуются в нижнем отделе тонкого и начальном отделе толстого кишечника. После оплодотворения самцы погибают, а самки ночью, когда расслаблены сфинктеры, выползают из анального отверстия, ползают по коже промежности, выделяют раздражающую жидкость и откладывают яйца (10 000 – 15 000 каждая).
которые утром легко могут быть занесены в рот и рассеяны по окружающим предметам. В кишечнике из яиц выходят личинки, которые через две недели достигают половой зрелости. Продолжительность жизни острицы около месяца. Болеют энтеробиозом дети дошкольного и младшего школьного возраста в организованных коллективах, где имеются условия для передачи инвазии контактным путем.
Рис. 44. Жизненный цикл Enterobius vermicularis.
Патогенное действие:
Механическое (повреждение слизистой оболочки кишечника).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Питание за счет организма хозяина (содержимым кишечника) и нарушение обменных процессов
Характерные симптомы: зуд и чувство жжения вокруг заднего прохода. Зуд беспокоит больных днем и ночью, становится нестерпимым, распространяется на промежность, половые органы, живот. У больных ухудшаются самочувствие, сон, появляются раздражительность, нервные расстройства, снижается успеваемость. Затем присоединяются различные симптомы со стороны пищеварительной системы: поносы с примесью слизи, тошнота, рвота, урчание и вздутие живота.
У больных ухудшаются самочувствие, сон, появляются раздражительность, нервные расстройства, снижается успеваемость. Затем присоединяются различные симптомы со стороны пищеварительной системы: поносы с примесью слизи, тошнота, рвота, урчание и вздутие живота.
Осложнения: вульвовагинит (заползание остриц во влагалище), аппендицит (заползание остриц в червеобразный отросток).
Лабораторная диагностика: обнаружение яиц гельминта при помощи метода липкой ленты, который проводят утром или днем после сна до подмывания ребенка. Яйца (рис. 43) бесцветные, асимметричные, уплощены с одной стороны (50 х 30 мкм). Кроме того, можно обнаружить самок остриц в области промежности (иногда их обнаруживают сами больные).
Профилактика: соблюдение правил личной гигиены, особенно чистоты рук и постельного белья. Больного ребенка необходимо укладывать спать в трусиках из плотной ткани, утром их кипятить и утюжить. Общественная профилактика – привитие детям гигиенических навыков, обследование на энтеробиоз обслуживающего персонала детских учреждений, изоляция и лечение больных, систематическая влажная уборка помещений, санитарная обработка игрушек, санитарно-просветительная работа с родителями и воспитателями дошкольных учреждений.
Энтеробиоз. Меры борьбы и профилактики
Горловский городской центр Государственной санитарно-эпидемиологической службы РЦ СЭН Министерства здравоохранения Донецкой Народной Республики сообщает, что в городе Горловка ежегодно выявляется около 600 больных энтеробиозом. Удельный вес энтеробиоза среди других гельминтозов достигает 70-95%.
Энтеробиоз распространен во всех широтах земного шара, где существует человек, т.к. жизненный цикл паразита не зависит от климатических условий местности. Распространение энтеробиоза зависит от санитарного состояния жилища, учреждения и личных гигиенических навыков людей. Особенно высокая инвазированность отмечается среди детей дошкольных учреждений и школ.
Возбудителем энтеробиоза является острица. Острица – мелкий круглый червь веретенообразной формы молочного цвета. Длина взрослой самки достигает 9-12мм, самца – 3-5мм. Яйца остриц имеют продолговатую, несколько ассиметричную форму. Размер яиц – 65-60х20-30мкм. Взрослые гельминты обитают в нижнем отделе тонкой кишки, в слепой кишке и в верхнем отделе толстой кишки. Как правило, паразитируют только самки. Самцы после оплодотворения выделяются с испражнениями. Питаются гельминты содержимым кишок. Численность паразитирующих в кишечнике особей широко варьирует от нескольких десятков до сотен и тысяч.
Взрослые гельминты обитают в нижнем отделе тонкой кишки, в слепой кишке и в верхнем отделе толстой кишки. Как правило, паразитируют только самки. Самцы после оплодотворения выделяются с испражнениями. Питаются гельминты содержимым кишок. Численность паразитирующих в кишечнике особей широко варьирует от нескольких десятков до сотен и тысяч.
Единственным источником инвазии является инвазированный человек. Заражение происходит при проглатывании зрелых яиц остриц, в которых содержатся подвижные личинки. Под действие пищеварительных ферментов тонкого кишечника личинки освобождаются из яиц, опускаясь в нижние его отделы, проходят 2-3 линьки. Здесь завершается процесс оплодотворения, и самцы пассивно покидают кишечник. А молодые самки остриц прикрепляются к слизистой оболочке и накапливают яйца, число которых достигает 5-17 тысяч. Во время миграции в кишечнике яйца дозревают до стадии личинки. Под действием кислорода, ползающая самка выделяет яйца. На коже остаются кучки яиц по 100-300 в каждой.
При значительной влажности и неопрятности острицы продолжают странствовать, заползая по промежности во влагалище и даже в полость малого таза.
Возникающий при движении гельминтов зуд, приводит к расчесам зудящих мест, загрязнению рук, попаданию яиц в подногтевые ложа. Таким образом, основным фактором передачи инвазии являются руки, а также — загрязненные руками игрушки, пищевые продукты, возможно заражение в плавательных бассейнах. Не исключается возможность заражения при вдыхании яиц с пылью, которая образуется при встряхивании нательного и постельного белья.
Патогенное влияние остриц на организм человека обусловлено комплексом механизмов. Механическое воздействие гельминтов на слизистую оболочку кишечника приводит к рефлекторному нарушению функций органов пищеварительного тракта и возможности развития гастрита, энтерита. При проникновении в червеобразный отросток острицы могут стать причиной аппендицита.
Клинические проявления энтеробиоза разнообразны и зависят от интенсивности заражения и индивидуальной реакции человека. Основными клиническими симптомами острой фазы являются боли в животе, тошнота, учащенный стул до 4 раз в сутки, зуд в области заднего прохода. Эти явления продолжаются до 5-7 дней.
В хронической фазе симптомы заболевания повторяются каждые 3-4 недели в результате повторного заражения. У части больных жалобы могут отсутствовать. При длительной инвазии, как правило, наряду с «кишечным дискомфортом», зудом выражены неврологические симптомы: головная боль, головокружение, снижение памяти. Чаще страдают дети. Они становятся капризными, плаксивыми, быстро утомляются, плохо воспринимают полезные навыки.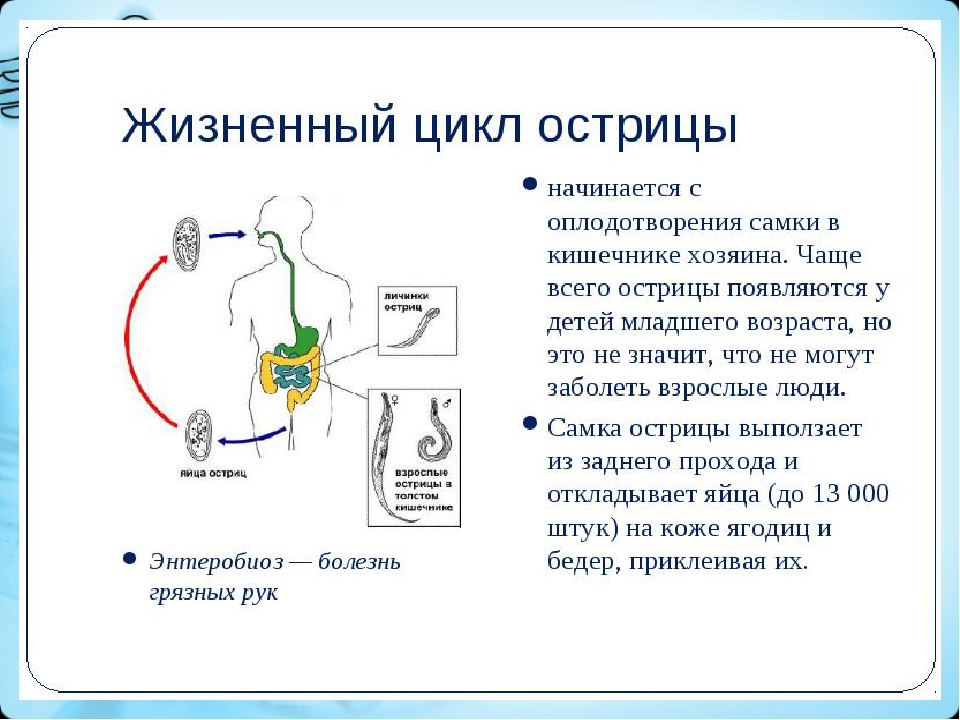
Основным информативным методом лабораторной диагностики энтеробиоза является специальный микроскопический метод отпечатка или соскоба.
Необходимым условием успешного лечения больного является одновременное проведение всего комплекса профилактических мер, предупреждающих повторное заражение. Учитывая высокую контагиозность заболевания, обследованию на энтеробиоз подлежат все контактные перед проведением лечения больного. Все выявленные с острицами подлежат одновременному лечению, препараты для лечения назначит лечащий врач.
Основные рекомендации по санитарно-гигиеническому режиму в семье, где выявлен больной.
- Чистота рук и ногтей, борьба с вредной привычкой грызть ногти, брать пальцы в рот.
- Инвазированные должны спать в «закрытых» трусах, т.
 е. с резинками не только на поясе, но и вокруг ног.
е. с резинками не только на поясе, но и вокруг ног. - Обязательное подмывание перианальной области водой с мылом на ночь и утром после сна.
- При наличии зуда перед сном рекомендуется содовая очистительная клизма (1/2 чайной ложки на стакан кипяченой воды комнатной температуры), она рассчитана только на механическое удаление гельминтов из прямой кишки (чесночные, уксусные клизмы применять не рекомендуется, по причине раздражение слизистой).
- Ежедневное купание под душем.
- Ежедневная смена постельного белья и его проглаживание горячим утюгом.
Энтеробиоз — болезнь грязных рук, поэтому для его профилактики детям следует прививать навыки личной гигиены, гигиены с раннего детства. Ногти пальцев рук должны быть коротко подстрижены.
Следует настоятельно запрещать грызть ногти, сосать пальцы рук. Желательно проводить обучение на фоне игровых ситуаций, которые запоминаются ребенком, и советы становятся привычкой.
При копировании, либо ином использовании материалов ссылка на официальный сайт https://admin-gorlovka.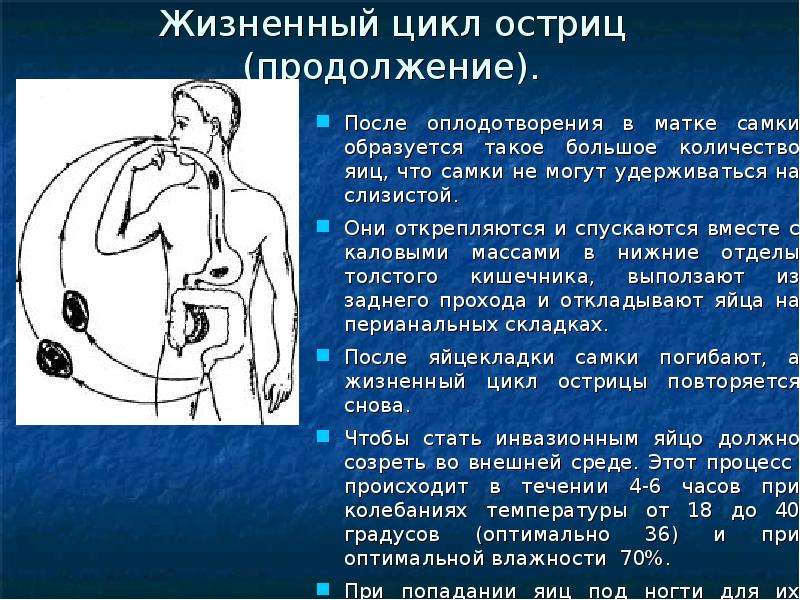 ru обязательна.
ru обязательна.
Биология для студентов — 038. Экология и патогенное значение нематод (аскарида человеческая, детская острица, трехинелла)
Аскарида человеческая (Ascaris lumbricoides) — возбудитель аскаридоза. Человеческая аскарида — это крупный геогельминт, самки которого достигают в половозрелом состоянии длины 40 см, а самцы — 20 см. Тело аскариды цилиндрическое, сужено к концам. У самца задний конец тела спирально закручен на брюшную сторону.
Зрелые яйца паразита имеют овальную форму, окружены толстой многослойной оболочкой, бугристые Оплодотворенные яйца выводятся из организма человека с фекалиями и для дальнейшего развития должны попасть в почву. Яйца созревают при высокой влажности, наличии кислорода и оптимальной температуре 24—25 °С через 2—3 недели.
Человек заражается аскаридами чаще всего через немытые овощи и фрукты, на которых находятся яйца. В кишечнике человека из яйца выходит личинка, которая проделывает сложные миграции по организму человека. Она прободает стенку кишечника, проникает сначала в вены большого круга кровообращения, потом через печень, правое предсердие и желудочек попадает в легкие. Из капилляров легких она выходит в альвеолы, затем в бронхи и трахею. Это вызывает формирование кашлевого рефлекса, что способствует попаданию паразита в глотку и вторичному заглатыванию со слюной. Попав в кишечник человека повторно, личинка превращается в половозрелую форму, которая способна размножаться и живет около года. Одна самка за сутки дает до 240 000. яиц.
Она прободает стенку кишечника, проникает сначала в вены большого круга кровообращения, потом через печень, правое предсердие и желудочек попадает в легкие. Из капилляров легких она выходит в альвеолы, затем в бронхи и трахею. Это вызывает формирование кашлевого рефлекса, что способствует попаданию паразита в глотку и вторичному заглатыванию со слюной. Попав в кишечник человека повторно, личинка превращается в половозрелую форму, которая способна размножаться и живет около года. Одна самка за сутки дает до 240 000. яиц.
Острица детская — возбудитель энтеробиоза. Острица — мелкий червь белого цвета. Половозрелые самки достигают в длину 10 мм, самцы — 2—5 мм. Тело прямое, заостренное сзади. Задний конец тела самца спирально закручен. Яйца острицы бесцветные и прозрачные, овальной формы, несимметричные, уплощенные с одной стороны. Острица паразитирует только в организме человека, где половозрелая особь локализуется в нижних отделах тонкого кишечника, питаясь его содержимым. Смены хозяев не происходит. Самка со зрелыми яйцами ночью выходит их заднепроходного отверстия и откладывает в складках ануса огромное количество яиц (до 15000.), после чего погибает. Ползание паразита по коже вызывает зуд.
Смены хозяев не происходит. Самка со зрелыми яйцами ночью выходит их заднепроходного отверстия и откладывает в складках ануса огромное количество яиц (до 15000.), после чего погибает. Ползание паразита по коже вызывает зуд.
Характерно, что яйца достигают инвазионной зрелости уже через несколько часов после откладывания. Лица, болеющие энтеробиозом, во сне расчесывают зудящие места, при этом под ногти попадает огромное количество яиц. С рук они заносятся самим же больным в рот (возникает аутореинвазия) или рассеиваются по поверхности белья и предметам. При проглатывании яиц они попадают в тонкий кишечник, где быстро развиваются половозрелые паразиты. Продолжительность жизни взрослой острицы составляет 56—58 суток. Если за это время не произошло нового самозаражения, наступает самоизлечение человека.
Трихинелла — возбудитель трихинеллеза. Заболевание эпизодически встречается повсеместно на всех континентах и во всех климатических зонах,. Морфологически трихинелла — это очень мелкий паразит: самки имеют в длину до 2,5—3,5 мм, а самцы — 1,4—1,6 мм.
Жизненный цикл. Трихинелла — это типичный биогельминт, жизненный цикл которого связан только с организмом хозяина. Кроме организма человека, трихинеллы паразитируют у свиней, крыс, кошек и собак, волков, медведей, лис и многих других диких и домашних млекопитающих. Любое животное, в организме которого живут трихинеллы, одновременно является и промежуточным, и окончательным хозяином. Распространение заболевания обычно происходит при поедании животными зараженного мяса. Проглоченные личинки в кишечнике быстро достигают половой зрелости в тонком кишечнике хозяина. После оплодотворения в кишечнике самцы быстро погибают, а самки на протяжении 2 месяцев рождают около 1500—2000 живых личинок, после чего также гибнут. Личинки пробуравливают стенку кишки, проникают в лимфатическую систему, затем с током крови разносятся по всему организму, но оседают преимущественно в определенных группах мышц: диафрагме, межреберных, жевательных, дельтовидных, икроножных. Период миграции обычно составляет 2—6 недель. Проникнув в мышечные волокна (часть которых при этом погибает), личинки спирально закручиваются и инкапсулируются (оболочка обызвествляется). В таких плотных капсулах личинки могут жить несколько десятков лет. Человек заражается при употреблении мяса животных, пораженных трихинеллезом. Термическое воздействия на мясо при обычной кулинарной обработке не оказывает губительного влияния на паразита.
Проникнув в мышечные волокна (часть которых при этом погибает), личинки спирально закручиваются и инкапсулируются (оболочка обызвествляется). В таких плотных капсулах личинки могут жить несколько десятков лет. Человек заражается при употреблении мяса животных, пораженных трихинеллезом. Термическое воздействия на мясо при обычной кулинарной обработке не оказывает губительного влияния на паразита.
Тип Круглые черви. Общая характеристика. Патогенные формы.
1. Особенности строения
Описано более 500 000. видов круглых червей. Обитают они в разных средах: морских и пресных водах, почве, разлагающихся органических субстратах и др. Многие черви приспособились к паразитическому образу жизни.
Главные ароморфозы типа:
1) первичная полость тела;
2) наличие заднего отдела кишечника и анального отверстия;
3) раздельнополость.
У всех круглых червей тело несегментированное, имеет в поперечном сечение более или менее округлую форму. Тело трехслойное, развивается из эндо-, мезо— и эктодермы. Имеется кожно-мускульный мешок. Он состоит из наружной нерастяжимой плотной кутикулы, гиподермы (представленной единой многоядерной цитоплазматической массой без границ между клетками — синцитием) и одного слоя продольных гладкомышечных волокон. Кутикула играет роль наружного скелета (опоры для мышц), защищает от воздействия неблагоприятных факторов окружающей среды. В гиподерме активно протекают процессы обмена веществ. Она же задерживает все токсические для гельминта продукты. Мышечный слой состоит из отдельных клеток, которые сгруппированы в 4 тяжа продольных мышц — спинной, брюшной и два боковых.
Тело трехслойное, развивается из эндо-, мезо— и эктодермы. Имеется кожно-мускульный мешок. Он состоит из наружной нерастяжимой плотной кутикулы, гиподермы (представленной единой многоядерной цитоплазматической массой без границ между клетками — синцитием) и одного слоя продольных гладкомышечных волокон. Кутикула играет роль наружного скелета (опоры для мышц), защищает от воздействия неблагоприятных факторов окружающей среды. В гиподерме активно протекают процессы обмена веществ. Она же задерживает все токсические для гельминта продукты. Мышечный слой состоит из отдельных клеток, которые сгруппированы в 4 тяжа продольных мышц — спинной, брюшной и два боковых.
Круглые черви имеют первичную полость тела — псевдоцель, которая заполнена жидкостью. В ней расположены все внутренние органы. Они образуют пять дифференцированных систем — пищеварительную, выделительную, нервную, половую и мышечную. Кровеносная и дыхательная системы отсутствуют. Кроме этого, жидкость придает телу упругость, играет роль гидроскелета и обеспечивает обмен веществ между внутренними органами.
Пищеварительная система представлена в виде сквозной трубки, которая начинается ротовым отверстием, окруженным кути-
кулярными губами, на переднем конце тела, а заканчивается — анальным отверстием на заднем конце тела. Пищеварительная трубка состоит из трех отделов — переднего, среднего и заднего. У остриц имеется бульбус — расширение пищевода.
Нервная система состоит из головных ганглиев, окологлоточного кольца и отходящих от него нервных стволов — спинного, брюшного и двух боковых. Наиболее развиты спинной и брюшной нервные стволы. Между стволами имеются соединительные перемычки. Органы чувств развиты очень слабо, представлены осязательными бугорками и органами химического чувства.
Выделительная система построена по типу протонефридиев, но количество выделительных клеток гораздо меньше. Функцией выделения обладают также особые фагоцитарные клетки, которые накапливают продукты обмена веществ и инородные тела, попавшие в полость тела.
У круглых червей появляется раздельнополость. Половые органы имеют трубчатое строение. У самки они обычно парные, у самца — непарные. Мужской половой аппарат состоит из семенника, семяпровода, который переходит в семяизвергательный канал. Он открывается в заднюю кишку. Женский половой аппарат начинается парными яичниками, далее идут два яйцевода в виде трубок и парные матки, которые соединяются в общее влагалище. Размножение круглых червей только половое.
Половые органы имеют трубчатое строение. У самки они обычно парные, у самца — непарные. Мужской половой аппарат состоит из семенника, семяпровода, который переходит в семяизвергательный канал. Он открывается в заднюю кишку. Женский половой аппарат начинается парными яичниками, далее идут два яйцевода в виде трубок и парные матки, которые соединяются в общее влагалище. Размножение круглых червей только половое.
Количество клеток, входящих в состав тела круглых червей, всегда ограничено. Поэтому они имеют небольшие возможности в плане роста и регенерации.
Медицинское значение имеют представители только одного класса — собственно Круглые черви. Выделяют биогельминтов, которые развиваются с участием промежуточных хозяев, и геогельминтов, сохранивших связь с внешней средой (их яйца или личинки развиваются в почве).
Круглые черви — паразиты человека
Аскарида
Аскарида человеческая (Ascaris lumbricoides) — возбудитель аскаридоза. Заболевание распространено практически повсеместно. Вид аскариды человеческой близок по морфологии к свиной аскариде, которая встречается в Юго-Восточной Азии, где может легко заражать человека, а человеческая аскарида — свиней.
Заболевание распространено практически повсеместно. Вид аскариды человеческой близок по морфологии к свиной аскариде, которая встречается в Юго-Восточной Азии, где может легко заражать человека, а человеческая аскарида — свиней.
Человеческая аскарида — это крупный геогельминт, самки которого достигают в половозрелом состоянии длины 40 см, а самцы — 20 см. Тело аскариды цилиндрическое, сужено к концам. У самца задний конец тела спирально закручен на брюшную сторону.
Зрелые яйца паразита имеют овальную форму, окружены толстой многослойной оболочкой, бугристые. Имеют желтовато-коричневый цвет, размеры до 60 мкм.
Аскарида человеческая — это геогельминт, который паразитирует почти исключительно у человека. Оплодотворенные яйца выводятся из организма человека с фекалиями и для дальнейшего развития должны попасть в почву. Яйца созревают при высокой влажности, наличии кислорода и оптимальной температуре 24—25 °С через 2—3 недели. Они резистентны к действию неблагоприятных факторов окружающей среды (могут сохранять жизнеспособность в течение 6 лет и более).
Человек заражается аскаридами чаще всего через немытые овощи и фрукты, на которых находятся яйца. В кишечнике человека из яйца выходит личинка, которая проделывает сложные миграции по организму человека. Она прободает стенку кишечника, проникает сначала в вены большого круга кровообращения, потом через печень, правое предсердие и желудочек попадает в легкие. Из капилляров легких она выходит в альвеолы, затем в бронхи и трахею. Это вызывает формирование кашлевого рефлекса, что способствует попаданию паразита в глотку и вторичному заглатыванию со слюной. Попав в кишечник человека повторно, личинка превращается в половозрелую форму, которая способна размножаться и живет около года. Число аскарид, одновременно паразитирующих в кишечнике одного человека, может достигать нескольких сотен или даже тысяч. При этом одна самка за сутки дает до 240 000. яиц.
Патогенное действие. Общая интоксикация продуктами жизнедеятельности аскарид, которые весьма токсичны. Развиваются головная боль, слабость, сонливость, раздражительность, снижаются память и работоспособность. Инвазия большим количеством аскарид может привести к развитию механической кишечной непроходимости, аппендицита, закупорке желчных протоков (при этом развивается механическая желтуха), в печени могут образовываться абсцессы. Известны случаи атипичной локализации аскарид в ухе, горле, печени, сердце. При этом необходимо сроч- ное хирургическое вмешательство. Мигрирующие личинки вызывают разрушение ткани легкого и формирование очагов гнойной инфекции.
Инвазия большим количеством аскарид может привести к развитию механической кишечной непроходимости, аппендицита, закупорке желчных протоков (при этом развивается механическая желтуха), в печени могут образовываться абсцессы. Известны случаи атипичной локализации аскарид в ухе, горле, печени, сердце. При этом необходимо сроч- ное хирургическое вмешательство. Мигрирующие личинки вызывают разрушение ткани легкого и формирование очагов гнойной инфекции.
Диагностика.
Обнаружение яиц аскариды человеческой в фекалиях больного.
Профилактика
1.Личная. Соблюдение правил личной гигиены, тщательное мытье овощей, ягод, фруктов, короткая стрижка ногтей, под которыми могут быть яйца паразита.
2.Общественная. Санитарно-просветительская работа. Запрет удобрения огородов и ягодников фекалиями, не прошедшими специальной обработки.
Острица
Острица детская (Enterobius vermicularis) — возбудитель энтеробиоза. Заболевание повсеместно распространено, чаще встречается в детских коллективах (отсюда и название).
Заболевание повсеместно распространено, чаще встречается в детских коллективах (отсюда и название).
Острица — мелкий червь белого цвета. Половозрелые самки достигают в длину 10 мм, самцы — 2—5 мм. Тело прямое, заостренное кзади. Задний конец тела самца спирально закручен. Яйца острицы бесцветные и прозрачные, овальной формы, несимметричные, уплощенные с одной стороны. Размеры яиц — до 50 мкм.
Острица паразитирует только в организме человека, где половозрелая особь локализуется в нижних отделах тонкого кишечника, питаясь его содержимым. Смены хозяев не происходит. Самка со зрелыми яйцами ночью выходит их заднепроходного отверстия и откладывает в складках ануса огромное количество яиц (до 15000.), после чего погибает. Ползание паразита по коже вызывает зуд.
Характерно, что яйца достигают инвазионной зрелости уже через несколько часов после откладывания. Лица, болеющие энтеробиозом, во сне расчесывают зудящие места, при этом под ногти попадает огромное количество яиц.
С рук они заносятся самим же больным в рот (возникает аутореинвазия) или рассеиваются по поверхности белья и предметам. При проглатывании яиц они попадают в тонкий кишечник, где быстро развиваются половозрелые паразиты. Продолжительность жизни взрослой острицы составляет 56—58 суток. Если за это время не произошло нового самозаражения, наступает самоизлечение человека.
Патогенное действие. За счет зуда промежности у детей часто возникают плохой сон, недосыпание, раздражительность, ухудшение самочувствия, часто снижается успеваемость в школе. При проникновении паразита в червеобразный отросток возможно воспаление последнего, т. е. развитие аппендицита (что бывает чаще, чем при аскаридозе).
Так как паразиты располагаются на поверхности слизистой тонкого кишечника, возможны ее воспаление и нарушение целостности стенки кишки. Эффект отнятия пищи чаще всего не развивается, так как паразит имеет малые размеры и не требует такого количества питательного материала, как, например, ленточные черви.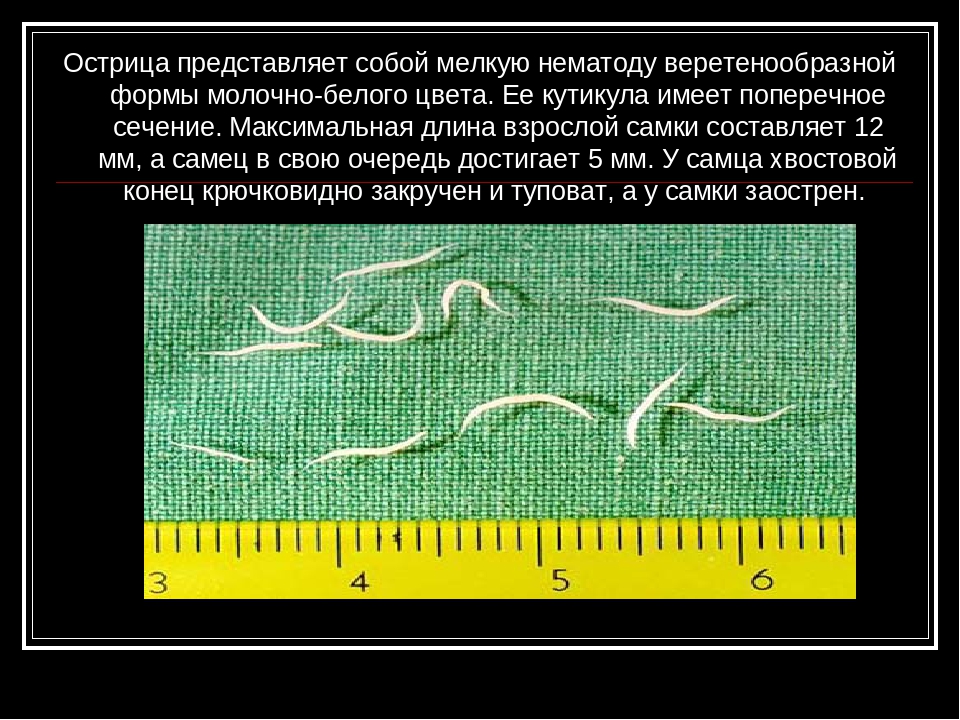
Диагностика
Диагноз ставится на основании обнаружения яиц острицы в материале с перианальных складок и при обнаружении паразитов, выползающих из ануса. В испражнениях больных энтеробиозом острицы и их яйца чаще всего отсутствуют.
Профилактика
1.Личная. Тщательное соблюдение правил личной гигиены, санитарное просвещение населения. Тщательное мытье рук, особенно перед едой и после сна, короткая стрижка ногтей. Больным детям на ночь нужно надевать трусики, которые утром тщательно стирать и проглаживать (острицы не выносят высоких температур).
2.Общественная. Регулярное обследование детей (особенно в организованных коллективах) и персонала, работников предприятий общественного питания на энтеробиоз.
Власоглав
Власоглав человеческий (Trichocephalus trichiurus) — возбудитель трихоцефалеза. Заболевание имеет довольно широкое, практически повсеместное распространение.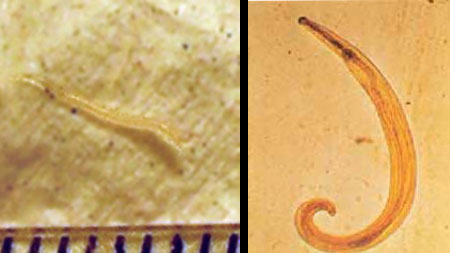 Возбудитель локализуется в нижних отделах тонкого кишечника (преимущественно в слепой кишке), верхних отделах толстого кишечника.
Возбудитель локализуется в нижних отделах тонкого кишечника (преимущественно в слепой кишке), верхних отделах толстого кишечника.
Половозрелая особь власоглава имеет в длину до 3—5 см. Передний конец туловища значительно уже заднего и нитевидно вытянут. В нем находится только пищевод. Задний конец тела самца спирально закручен и утолщен. В нем расположены половая система и кишечник. Яйца власоглава по форме напоминают бочонки, на концах имеются крышки в виде пробок. Яйца светлые, прозрачные, длиной до 50 мкм. Продолжительность жизни паразита составляет до 6 лет.
Власоглав паразитирует только в организме человека. Смены хозяев не происходит. Это типичный геогельминт, который развивается без миграции (в отличие от аскариды человеческой). Для дальнейшего развития яйца гельминта с фекалиями человека должны попасть во внешнюю среду. Развиваются они в почве в условиях повышенной влажности и достаточно высокой температуры. Яйца достигают инвазионности уже через 3—4 недели после попадания в почву. В яйце формируется личинка. Заражение человека происходит при проглатывании яиц, содержащих личинки власоглава. Это возможно при употреблении загрязненных яйцами овощей, ягод, фруктов или другой пищи, а также воды.
В яйце формируется личинка. Заражение человека происходит при проглатывании яиц, содержащих личинки власоглава. Это возможно при употреблении загрязненных яйцами овощей, ягод, фруктов или другой пищи, а также воды.
В кишечнике человека под действием пищеварительных ферментов оболочка яйца растворяется, из него выходит личинка. Половой зрелости паразит достигает в кишечнике человека через несколько недель после заражения.
Патогенное действие. Паразит располагается в кишечнике, где питается кровью человека. Содержимое кишечника он не поглощает, в связи с этим выведение этого паразита из организма человека довольно сложное и требует от врача особой настойчивости (препараты, вводимые перорально, не действуют на паразита). Передний конец тела власоглава довольно глубоко погружается в стенку кишки, что может в значительной степени нарушать ее целостность и вызывать воспаление. Происходит интоксикация организма человека продуктами жизнедеятельности паразита: появляются головные боли, повышенная утомляемость, снижение работоспособности, сонливость, раздражительность. Нарушается функция кишечника, возникают боли в животе, могут быть судороги. Так как паразит питается кровью, может возникать малокровие (анемия). Часто развивается дисбактериоз. При массивной инвазии власоглавы могут вызвать воспалительные изменения в червеобразном отростке (аппендиците).
Нарушается функция кишечника, возникают боли в животе, могут быть судороги. Так как паразит питается кровью, может возникать малокровие (анемия). Часто развивается дисбактериоз. При массивной инвазии власоглавы могут вызвать воспалительные изменения в червеобразном отростке (аппендиците).
Диагностика
Обнаружение яиц власоглава в фекалиях больного человека.
Профилактика.
1.Личная. Соблюдения правил личной гигиены, тщательное мытье овощей, ягод и фруктов.
2.Общественная. Санитарно-просветительская работа с населением, благоустройство общественных уборных и предприятий общественного питания.
Трихинелла
Трихинелла (Trichinella spiralis) — возбудитель трихинеллеза. Заболевание эпизодически встречается повсеместно на всех континентах и во всех климатических зонах, но существуют определенные природные очаги. В России почти все случаи трихинеллеза встречались в зоне лесов, что говорит о том, что заболевание является природно-очаговым и связано с определенными видами животных, которые на данной территории являются природным резервуаром паразита.
Локализация. Личинки трихинелл обитают в поперечно-полосатой мускулатуре, а половозрелые особи — в тонком кишечнике, где залегают между ворсинок, передним концом тела проникая в лимфатические капилляры.
Морфологически трихинелла — это очень мелкий паразит: самки имеют в длину до 2,5—3,5 мм, а самцы — 1,4—1,6 мм.
Жизненный цикл. Трихинелла — это типичный биогельминт, жизненный цикл которого связан только с организмом хозяина. Попадание в окружающую среду для дальнейшего развития и заражения вовсе не обязательно. Кроме организма человека, трихинеллы паразитируют у свиней, крыс, кошек и собак, волков, медведей, лис и многих других диких и домашних млекопитающих. Любое животное, в организме которого живут трихинеллы, одновременно является и промежуточным, и окончательным хозяином.
Распространение заболевания обычно происходит при поедании животными зараженного мяса. Проглоченные личинки в кишечнике быстро достигают половой зрелости в тонком кишечнике хозяина.
После оплодотворения в кишечнике самцы быстро погибают, а самки на протяжении 2 месяцев рождают около 1500—2000 живых личинок, после чего также гибнут. Личинки пробуравливают стенку кишки, проникают в лимфатическую систему, затем с током крови разносятся по всему организму, но оседают преимущественно в определенных группах мышц: диафрагме, межреберных, жевательных, дельтовидных, икроножных. Период миграции обычно составляет 2—6 недель. Проникнув в мышечные волокна (часть которых при этом погибает), личинки спирально закручиваются и инкапсулируются (оболочка обызвествляется). В таких плотных капсулах личинки могут жить несколько десятков лет.
Личинки пробуравливают стенку кишки, проникают в лимфатическую систему, затем с током крови разносятся по всему организму, но оседают преимущественно в определенных группах мышц: диафрагме, межреберных, жевательных, дельтовидных, икроножных. Период миграции обычно составляет 2—6 недель. Проникнув в мышечные волокна (часть которых при этом погибает), личинки спирально закручиваются и инкапсулируются (оболочка обызвествляется). В таких плотных капсулах личинки могут жить несколько десятков лет.
Человек заражается при употреблении мяса животных, пораженных трихинеллезом. Термическое воздействия на мясо при обычной кулинарной обработке не оказывает губительного влияния на паразита.
Патогенное действие. Клинические проявления заболевания различны: от бессимптомного течения до летального исхода, что зависит в первую очередь от количества личинок в организме. Инкубационный период — 5—45 дней. Наблюдается общее токсико-аллергическое действие на организм (воздействие продуктов жизнедеятельности паразита и развитие реакций иммунной системы на него).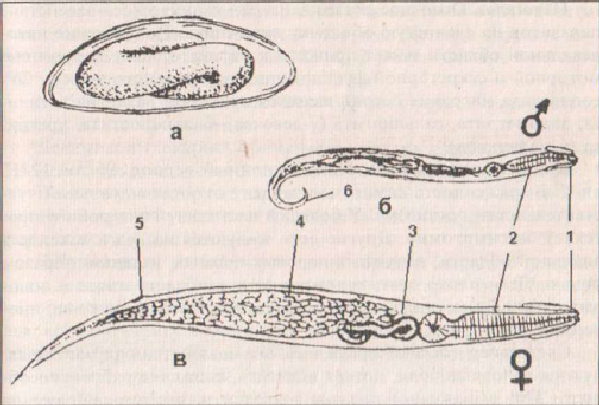 Важно механическое влияние паразита на мышечные волокна, что отражается на работе мышц.
Важно механическое влияние паразита на мышечные волокна, что отражается на работе мышц.
Диагностика
Анамнестически — употребление мяса диких животных или непроверенного мяса. Исследование биоптата мышц на наличие паразита. Применяются иммунологические реакции.
Профилактика
Термическая обработка мяса. Не следует употреблять в пищу не проверенное ветеринарной службой мясо. Санитарный надзор в свиноводстве, проверка свинины.
Анкилостома (кривоголовка)
Кривоголовка двенадцатиперстной кишки (Ancylostoma duodenale) — возбудитель анкилостомидоза. Заболевание распространено повсеместно в зонах субтропического и тропического климата с высокими температурами и влажностью. Имеются случаи возникновения очагов заболевания в зонах умеренного климата при условиях повышенной влажности почвы и ее загрязнения фекалиями.
Анкилостомы — это паразиты червеобразной формы красноватого цвета. Самка имеет длину 10—18 мм, самцы — 8—10 мм. Передний конец загнут на спинную сторону (отсюда и название). На головном конце паразита имеется ротовая капсула с 4 хитиновыми зубами. Яйца кривоголовки овальные, прозрачные, с притупленными полюсами, размерами до 60 мкм.
Самка имеет длину 10—18 мм, самцы — 8—10 мм. Передний конец загнут на спинную сторону (отсюда и название). На головном конце паразита имеется ротовая капсула с 4 хитиновыми зубами. Яйца кривоголовки овальные, прозрачные, с притупленными полюсами, размерами до 60 мкм.
Продолжительность жизни паразита — 4—5 лет. В организме человека обитает в тонком кишечнике (преимущественно в двенадцатиперстной кишке).
Относится к геогельминтам, которые в организме человека проходят миграцию (подобно аскариде). Паразитирует только у человека. Оплодотворенные яйца с фекалиями попадают в окружающую среду, где при благоприятных условиях через сутки из них выходят личинки, называемые рабдитными. Они неинвазионны. Личинки активно питаются фекалиями и гниющими органическими веществами и два раза линяют. После этого личинка приобретает инвазионность (это филяриевидные личинки). В организм человека они могут попасть через рот с загрязненной пищей и водой. Но чаще всего личинки активно внедряются через кожу. Так как заражение происходит в основном при соприкосновении с почвой, чаще всего заражаются лица тех профессий, которые связаны с землей (это землекопы, огородники, шахтеры и др.).
Так как заражение происходит в основном при соприкосновении с почвой, чаще всего заражаются лица тех профессий, которые связаны с землей (это землекопы, огородники, шахтеры и др.).
В организме человека происходит миграция личинок. Сначала они проникают из кишечника в кровеносные сосуды, оттуда в сердце и легкие. Поднимаясь по бронхам и трахее, они проникают в глотку, вызывая развитие кашлевого рефлекса. Повторное заглатывание личинок со слюной приводит к тому, что они вновь попадают в кишечник, где поселяются в двенадцатиперстной кишке.
Своей ротовой капсулой кривоголовка захватывает небольшой участок слизистой оболочки и, повреждая ее ворсинки, питается кровью. Паразиты выделяют антикоагулянтные вещества, которые препятствуют свертыванию крови, поэтому могут возникать кишечные кровотечения.
Патогенное действие. Возникает интоксикация организма продуктами жизнедеятельности паразита. Возможно развитие массивных (за счет длительности) кишечных кровотечений, которые приводят к выраженной анемии. Возможно развитие аллергии на паразита. Появляются боли в животе, расстройства пищеварения, головные боли, слабость, утомляемость. Дети могут заметно отставать в развитии. При отсутствии должного лечения возможен летальный исход.
Возможно развитие аллергии на паразита. Появляются боли в животе, расстройства пищеварения, головные боли, слабость, утомляемость. Дети могут заметно отставать в развитии. При отсутствии должного лечения возможен летальный исход.
Диагностика
Обнаружение личинок и яиц в фекалиях больного.
Профилактика.
1.Личная. Не следует ходить без обуви по земле в тех районах, где распространен анкилостомидоз.
2.Общественная. Раннее выявление и лечение больных анкилостомидозом. В шахтах должна проводиться борьба с паразитами. Все шахтеры должны иметь фляги с чистой водой.
Ришта
Ришта (Dragunculus medinensis) — возбудитель драгункулеза. Заболевание широко распространено в странах с тропическим
и субтропическим климатом (в Ираке, Индии, экваториальной Африке и др.). Раньше встречалось только в Средней Азии.
Паразит имеет нитевидную форму, длина самки — от 30 до 150 см при толщине 1—1,7 мм, самец — только до 2 см длиной.
Жизненный цикл паразита связан со сменой хозяев и водной средой. Окончательный хозяин — человек, а также обезьяна, иногда — собака и другие дикие и домашние млекопитающие. Промежуточный хозяин — рачки-циклопы. У человека паразит локализуется в подкожной жировой клетчатке преимущественно нижних конечностей. Описаны случаи нахождения ришт под серозной оболочкой желудка, пищевода, мозговыми оболочками. Самки ришты живородящие. Над передним концом тела самки образуется огромный пузырь, заполненный серозной жидкостью. При этом возникает нарыв, человек ощущает сильнейший зуд. Он проходит при соприкосновении кожи с водой. При опускании ног в воду пузырь лопается, из него выходит огромное количество живых личинок. Их дальнейшее развитие возможно при попадании в организм циклопов, которые этих личинок заглатывают. В теле циклопа личинки превращаются в микрофиллярии. При питье зараженной воды окончательный хозяин может проглотить циклопа с микрофилляриями. В желудке этого хозяина циклоп переваривается, а микрофиллярия ришты попадает сначала в кишечник, где прободает его стенку и проникает в кровоток. С током крови они заносятся в подкожную жировую клетчатку, где достигают половой зрелости примерно через 1 год и начинают производить личинок.
С током крови они заносятся в подкожную жировую клетчатку, где достигают половой зрелости примерно через 1 год и начинают производить личинок.
Развитие паразита в организме зараженных людей происходит синхронно (с интервалом в 1 год). Личинки появляются у самок примерно в одинаковое время у всех носителей паразита. Этим достигается одновременное заражение большого количества циклопов, что повышает вероятность проникновения паразита в организм окончательного хозяина в условиях засушливого климата с редкими дождями.
Патогенное действие. В местах расположения паразита появляются сильный зуд и отвердение кожи. Если паразит расположен рядом с суставом, нарушается его подвижность: больной не может ходить. Возникают болезненные язвы и нарывы на коже, которые могут осложняться вторичной инфекцией. Паразит оказывает также общетоксическое и аллергическое действие на человека за счет выделения в кровь продуктов своего обмена.
Диагностика. При типичной локализации паразита до образования язв на коже возможно визуальное обнаружение половозрелых форм, которые имеют вид извитых, хорошо заметных валиков под кожей. При атипичной локализации (например в серозных и мозговых оболочках) требуется постановка иммунологических проб.
При атипичной локализации (например в серозных и мозговых оболочках) требуется постановка иммунологических проб.
Профилактика.
1.Личная. Не следует пить нефильтрованную и некипяченую воду из открытых водоемов в очагах заболевания.
2.Общественная. Своевременное выявление и лечение больных, охрана мест водоснабжения, организация водопроводов в общественных местах.
Есть старинная поговорка: «Если попьет святой воды в Бухаре, прорвется и у него ришта на ноге».
Круглые черви — биогельминты
Биогельминты — это паразиты, которые развиваются при участии промежуточных хозяев. Среди круглых червей только относительно небольшая группа паразитов нуждается в переносчиках, т. е. передается трансмиссивно. Все они встречаются в тропическом и субтропическом климате. Относятся к семейству Fil—lariodea и вызывают сходные заболевания — филляриатозы.
Роль основного хозяина выполняют человек, человекообразные обезьяны и другие млекопитающие. Переносчики — кровососущие насекомые (комары, мошки, слепни, мокрецы).
Переносчики — кровососущие насекомые (комары, мошки, слепни, мокрецы).
Половозрелые особи (филлярии) обитают в тканях внутренней среды. Они рождают личинки (микрофиллярии), которые периодически поступают в кровь и лимфу. При укусе кровососущим насекомым личинки поступают в его желудок, оттуда — в мышцы, где достигают инвазионности и переходят в хоботок насекомого. При укусе основного хозяина переносчик заражает его паразитом в инвазионной стадии. Так как в организме переносчиков происходит и развитие паразита, он одновременно является и промежуточным хозяином (они всегда специфичны для каждого вида филлярий).
Выход филлярий в кровяное русло всегда сочетается со временем максимальной активности переносчика. Если переносчиками являются комары, личинки выходят в кровоток вечером и ночью, если слепни, то они выходят преимущественно днем и утром. Когда филлярии переносятся мокрецами или мошками, выход па-
разита лишен периодичности, так как жизнедеятельность мокрецов определяется в основном влажностью.
Основные виды филлярий — паразитов человека.
1.Wuchereria banctofti. Встречается в экватариальной Африке, Азии, Южной Америке. Переносчики — комары. Окончательный хозяин — человек, а также обезьяны. В их организме паразиты локализуются в лимфоузлах и сосудах, вызывая застой крови и лимфы, появляются слоновость, аллергизация.
2.Brugia malayi. Распространена в Юго-Восточной Азии. Переносчики — комары. Окончательный хозяин — человек, а также высшие обезьяны, кошачьи. Локализация и патогенное действие такие же, как у Wuchereria banctofti.
3.Oncocerca volvulus. Встречается в экваториальной Африке, Центральной, Северной и Южной Америке. Переносчики — мошки. Окончательный хозяин — человек. В организме паразиты локализуются под кожей груди, головы, конечностей, вызывают образование болезненных узелков. При локализации в области глаз возможна слепота.
4.Loa loa. Распространена в Западной Африке. Переносчики — слепни. Окончательный хозяин — человек, а также обезьяны. Локализация в организме: под кожей и слизистыми оболочками, где возникают болезненные узелки и нарывы.
5.Mansonella. Встречается в Центральной и Южной Америке. Переносчики — мокрецы. Окончательный хозяин — человек, в организме которого паразит локализуется в жировой ткани, под серозными оболочками, в брыжейке кишечника.
6.Acantocheilonema. От предыдущего заболевания отличается ареалом паразита: это Южная Америка, экваториальная Африка.
Диагностика обнаружение в крови микрофиллярий. Кровь нужно брать в то время суток, когда обнаружение паразита вероя-нее всего.
Профилактика.
Борьба с переносчиками. Раннее выявление и лечение больных.
Источник: Н. С. Курбатова, Е. А. Козлова «Конспект лекций по общей биологии»
Осторожно: гельминты!
Гельминты, или
паразитические черви, – это многоклеточные животные, которые ведут
паразитический образ жизни в теле другого организма.
В настоящее время установлено, что человек является хозяином более 160 видов гельминтов. Около половины представляют круглые черви, остальные относятся к плоским глистам.
Гельминты человека могут паразитировать во всех органах и тканях. Наибольшее их количество встречается в отделах кишечника: аскариды, власоглавы, острицы, анкилостомы, лентецы, цепни и т. д. В желчных ходах печени живут трематоды, фасциола, описторхис, в лёгких – парагонимус и в период миграции личинки некоторых нематод. Личинки цестод паразитируют в различных органах и тканях: эхиноккок в печени, лёгких, костях и пр. В лимфатической системе живут филарии.
В организме человека
могут одновременно паразитировать несколько видов гельминтов (2–4 и более). Все
гельминты оказывают то или иное патогенное воздействие на организм человека. Заболевания,
вызываемые ими, называются гельминтозами. Жизненный цикл гельминтов
разнообразен. Яйца или личинки большинства гельминтов выделяются из организма
хозяина во внешнюю среду.
В зависимости от способа дальнейшего развития яиц и личинок паразитических червей можно разделить на две группы: биогельминтов (развиваются со сменой хозяев) и геогельминтов (развиваются прямым путём без смены хозяев). К геогельминтам относятся почти все нематоды (круглые черви).
Круглые
глисты – наиболее широко распространённые паразиты
человека, играют значительную роль в его патологии. Личинки нематод, попав в
желудочно-кишечный тракт, не удерживаются там, а проделывают сложную миграцию:
личинка, вылупившаяся из яйца в желудочно-кишечном тракте хозяина,
пробуравливает стенку кишечника, попадает в кишечные вены, оттуда через
воротную вену в печень и далее в верхнюю полую вену, правое сердце и через лёгочную
артерию в лёгкие. Затем личинка внедряется в лёгочные бронхиолы, оттуда
мигрирует в бронхи, трахею и ротовую полость. Из ротовой полости она
проглатывается со слюной и, попав вторично в желудочно-кишечный тракт,
задерживается в нём и превращается в зрелого паразита.
Широко распространённый представитель – аскарида. Яйца аскариды устойчивы к низким температурам, более чувствительны к высоким, при 60 оС яйца гибнут в течение двух минут, при 75 оС – в течение 1 секунды. Заражение аскаридами происходит через загрязнённые испражнения человека, почву и воду, через загрязнённые продукты питания – сырые немытые овощи, выращиваемые на огородах, удобряемых сточными водами или необезвреженными человеческими фекалиями. Заражение может произойти в результате загрязнения пищевых продуктов яйцами глистов с пылью или через мух.
Острица
встречается как у детей, так и у взрослых. Острица – белый веретенообразный
паразит. Его яйца, выделенные во внешнюю среду, быстро дозревают (через 6
часов). Зрелые яйца попадают в желудочно-кишечный тракт и развиваются в зрелого
паразита, не проделывая миграции. Заражение происходит при непосредственном
контакте с больными, при вдыхании яиц остриц с пылью, через пищу и предметы, к
которым прикасались руками, загрязнёнными яйцами паразита. Так как созревание
яиц во внешней среде происходит очень быстро, то нужна чрезвычайная чистоплотность,
чтобы человек, заражённый острицами, не подвергался повторному самозаражению.
Так как созревание
яиц во внешней среде происходит очень быстро, то нужна чрезвычайная чистоплотность,
чтобы человек, заражённый острицами, не подвергался повторному самозаражению.
Распространённый паразит – власоглав. Основные факторы инвазии (заражения) те же, что и для аскаридоза.
Повсюду, где в пищу употребляется свиное мясо, встречается трихинелла. Очень мелкий паразит, едва видимый простым глазом. Трихинеллёз – заболевание человека и некоторых животных (свиней, домашних и диких грызунов, плотоядных). При трихинеллёзе наблюдается резкая эозинофилия в крови.
Развитие ленточных червей (цестодов) происходит со сменой хозяев, человек является окончательным хозяином. Заражение случается при поедании плохо проваренного или прожаренного мяса, содержащего финны.
Исключением является эхинококк, который паразитирует у человека в личиночной стадии, и вооружённый цепень, который вызывает заболевание цистицеркоза.
Сосальщики (трематоды) характеризуются листовидной формой тела и наличием присосок. Попадают в организм человека из водной среды через кожные покровы или с питьевой водой, также при поедании человеком заражённой рыбы или крабов.
Причина заболевания гельминтозом – попадание в организм личинки или яйца паразитирующего червя. Этому способствуют факторы, при которых создаются условия для проникновения паразита в тело человека:
– несоблюдение личной гигиены, пренебрежение мытьём рук перед едой, употребление грязных или плохо вымытых фруктов, овощей, ягод, антисанитария в помещении, контакт с домашними животными без соблюдения мер предосторожности, питьё воды из открытых водоёмов;
– употребление сырого молока или неочищенной воды, термически не обработанных рыбы, мяса.
Зинаида Иванюта,
врач лабораторной диагностики 11-й городской поликлиники г. Минска
Часто встречающиеся гельминтозы — БУ «Нижневартовская городская поликлиника»
Паразиты — организмы, питающиеся за счет особей другого вида и временно или постоянно пребывающие на поверхности их тела или внутри организма.
Каждый паразит наносит вред хозяину уже одним своим присутствием, как инородное тело. Чем паразит крупнее и его масса больше, тем это механическое воздействие значительнее. Для поддержания своей жизнедеятельности и интенсивного размножения каждый паразит потребляет некоторое количество пищи хозяина.
Продукты жизнедеятельности паразитов обладают антигенными свойствами, вызывающими иммунологическую активность, аллергию или подавление иммунитета хозяина.
Лямблиоз — протозойное заболевание, протекающие как в виде латентного паразитоносительства, так и в манифестных формах с преимущественным поражением средних отделов желудочно-кишечного тракта.
Основным источником инвазии является человек, зараженный лямблиями.
Второстепенную роль играют собаки и крупный рогатый скот (особенно телята) и свиньи.
Возможным резервуаром лямблий в природе являются бобры и ондатры, которые могут инфицировать водоемы.
Механизм передачи инфекции фекально-оральный. Заражение происходит при проглатывании цист лямблий, которые могут длительно выживать во внешней среде. Во влажном кале они сохраняют жизнеспособность в зависимости от температуры окружающей среды от одних суток до 3 недель. В чистой холодной воде цисты выживают более 2-х месяцев, на поверхности хлеба и яблок — до 6 часов, на вареном картофеле — более 2 суток.
Цисты сохраняют жизнеспособность после прохождения через желудочно-кишечный тракт насекомых. В кишечнике мух они остаются живыми от 30 часов до нескольких суток, в кишечнике тараканов — до 8 суток.
— лечение больных кишечными протозоозами с контролем его эффективности через 10 — 14 дней. Критерием эффективности являются два отрицательных результата лабораторного исследования, проведенного с интервалом в 2 — 3 дня;
— установление диагноза носительства возбудителей кишечных протозоозов у лиц, относящихся к декретированным группам населения. При их согласии руководители организаций и индивидуальные предприниматели временно на период лечения и контрольных обследований после лечения переводят на другую работу. При невозможности перевода, временно на период лечения и обследования их отстраняют от работы с выплатой пособий по социальному страхованию в соответствии с законодательством Российской Федерации;
Профилактика и меры борьбы.
Основными мерами неспецифической профилактики являются меры по предотвращению фекального загрязнения воды, пищевых продуктов и других объектов внешней среды. Необходимо строго соблюдать правила личной гигиены, уничтожать механических переносчиков — мух и тараканов.
Описторхоз— природноочаговый биогельминтоз, характеризующийся поражением гепатобилиарной системы и поджелудочной железы.
Эпидемиология описторхоза
Источником инвазии являются зараженные описторхисами млекопитающие (домашние и дикие плотоядные, человек). Дикие плотоядные являются основным источником инвазии на большей части ареала, где человек не включен в циркуляцию возбудителя.
Основные факторы передачи: необеззараженная рыба только семейства карповых (вяленая, соленая, холодного копчения, строганина, сырая), содержащая жизнеспособных метацеркарий описторхиса. Заражение человека происходит при употреблении необеззараженной рыбы семейства карповых, содержащей жизнеспособных личинок описторхиса.
Естественная восприимчивость людей к заражению описторхисами высокая. Наибольшие показатели заболеваемости регистрируются в возрастной группе от 15 до 50 лет. Несколько чаще болеют мужчины. Заражение, как правило, происходит в летне-осенние месяцы. Часто наблюдаются повторные случаи заражения после излечения. Иммунитет нестойкий.
Описторхоз — пероральный биогельминтоз. Ареал возбудителя простирается от бассейна р. Енисей до западных границ Европы, но распространение заболевания у человека носит очаговый характер. Уровень пораженности населения описторхисами определяют социально-бытовые факторы: образ жизни (традиции, привычки), степень развития рыбного промысла, удельный вес рыбы в пищевом рационе, методы кулинарной обработки рыбы, санитарное состояние местности.
В связи с тем, что промежуточный и второй промежуточный хозяева обитают в водоемах, очаги описторхоза концентрируются вблизи рек. Крупнейший в мире очаг этого заболевания сформировался в Обь-Иртышском речном бассейне. Инвазированность сельского населения в нижнем течении р. Иртыш и среднем течении р. Обь достигает 90 — 95%, причем нередко инвазированны и дети дошкольного возраста.
Здесь регистрируются наиболее высокие показатели заболеваемости населения (до 1000 на 100 тыс.). Причина такого исключительного значения данной территории в эпидемиологии описторхоза заключается в наличии чрезвычайно развитой речной поймы, обеспечивающей условия для циркуляции возбудителя болезни. Территории с приведенными выше количественными показателями пораженности населения относятся к гиперэндемичным.
Развитие Opisthorchis felineus происходит с тройной сменой хозяев: первого промежуточного (моллюски), второго промежуточного (рыбы) и окончательного (млекопитающие).
К числу окончательных хозяев паразита относятся человек, кошка, собака, свинья и более 25 видов диких млекопитающих, в рацион которых входит рыба (лисица, песец, соболь, хорек, выдра, норка, водяная полевка, ондатра и др.).
Из кишечника окончательных хозяев зрелые яйца описторхисов выделяются в окружающую среду. Яйца паразитов, попавшие в водоем, могут сохранять жизнеспособность 5 — 6 месяцев. В воде яйцо заглатывается моллюском рода Codiella или Opisthorchophorus. В кишечнике моллюска из яйца выходит мирацидий, проникает в полость тела и, претерпевая метаморфоз, превращается в половозрелую фазу развития — материнскую спороцисту. Размножаясь партеногенетическим путем (без оплодотворения), спороциста дает начало особям следующего, тоже партеногенетического поколения — редиям. В редиях 2-го поколения развиваются подвижные церкарии — личинки гермафродитного поколения. Время развития паразитов в моллюске в зависимости от температуры воды может составлять от 2 до 10 — 12 месяцев. Церкарии, покинув тело родительской особи, выходят из моллюска в воду и при помощи секрета особых желез прикрепляются к коже рыб семейства карповых (язь, елец, линь, плотва, лещ и др.). Затем они активно внедряются в подкожную клетчатку и мускулатуру, теряют хвост и спустя сутки инцистируются, превращаясь в метацеркарии, размеры которых составляют 0,21 — 0,33 x 0,17 — 0,25 мм. Через 6 недель метацеркарии становятся инвазионными, и содержащая их рыба может служить источником заражения окончательных хозяев. Метацеркарии в живой рыбе сохраняют свою жизнеспособность и инвазионность 5 — 8 лет. Весьма устойчивы они к воздействию низких температур. В замороженной рыбе личинки утрачивают жизнеспособность при -40 °C до 7 ч, при -35 °C до 14 ч, при -28 °C — 32 ч. Замораживание рыбы при более высокой температуре не гарантирует ее полного обеззараживания. Метацеркарии чувствительны к высоким температурам. После выделения из рыбы они погибают при 55 °C в течение 5 мин. При засолке, если доля соли в рыбе равна 14%, а плотность тузлука составляет 1,2, метацеркарии выживают в мелкой рыбе от 10 до 21 суток (в зависимости от вида рыбы), а в крупной, длиной свыше 25 см (язи, лещи, лини), — до 40 суток.
Высокая устойчивость метацеркарий к воздействию факторов окружающей среды требует соблюдения режимов обеззараживания материала и объектов внешней среды (поверхностей, лабораторной посуды и пр.) в испытательных лабораториях, проводящих исследование рыбы и готовой рыбной продукции на паразитарную чистоту.
В кишечнике дефинитивного хозяина под воздействием дуоденального сока личинки освобождаются от оболочек цист и по общему желчному протоку мигрируют в желчный пузырь и в желчные протоки печени. Иногда они могут попадать также в поджелудочную железу. Через 3 — 4 недели после заражения окончательных хозяев паразиты достигают половой зрелости и после оплодотворения начинают откладывать яйца. Выделяющиеся с фекалиями животных и человека зрелые яйца содержат личинку-мирацидий, не способную заразить дефинитивного хозяина без прохождения ее дальнейшего развития в промежуточном и дополнительном хозяине. Таким образом, выделения больного, а также загрязненные ими объекты внешней среды непосредственной эпидемической опасности для окружающих не представляют. Продолжительность жизни кошачьей двуустки может достигать 20 — 25 лет.
Санитарно-гигиенические мероприятия
Оценку состояния рыбохозяйственных водоемов по паразитологическим показателям проводят на территориях, где существует риск заражения описторхисами, 1 раз в 5 лет или по эпидемиологическим показаниям.
Места отлова, сроки и видовой состав рыб определяют управления Роспотребнадзора по субъектам Российской Федерации по плану-графику, согласованному с руководством рыбодобывающих организаций.
При оценке паразитологического состояния водоема в первую очередь исследуют виды рыб, наиболее подверженные заражению. Наилучшими индикаторами неблагополучия водоема в отношении инвазии личинками описторхиса являются язь, далее по убывающей — елец, линь, красноперка, плотва, лещ, голавль, синец, белоглазка, подуст, чехонь, жерех, пескарь, уклейка, густера, гольян, верховка, щиповка.
В аккредитованных испытательных лабораториях исследуют по 20 особей промыслового размера дополнительных хозяев описторхиса (рыб семейства карповые), распространенных на этой территории. При отрицательном результате число исследуемых экземпляров рыб доводится до 40. Если отрицательный результат подтверждается, водоем считается благополучным. Рыба, выловленная в таких водоемах, допускается на реализацию без ограничений.
При обнаружении в водоеме рыб, зараженных личинками описторхиса, всю рыбу данного вида и остальных видов, способных играть роль дополнительных хозяев описторхисов, а также рыбную продукцию подвергают обеззараживанию от личинок описторхисов перед реализацией.
Вся рыбопродукция из водоема допускается к сертификации и реализации только после ее обеззараживания.
При паразитологическом контроле сырья (свежей, охлажденной и мороженой рыбы) проводят микроскопическое исследование мышечных тканей и подкожной клетчатки рыбы на наличие метацеркарий описторхиса. Не допускается в реализацию и подлежит обеззараживанию сырье, в пробе которого обнаружена хотя бы одна жизнеспособная личинка описторхиса.
Проводят обязательный паразитологический контроль каждой партии готовой рыбной продукции холодного копчения, пресервов, соленой, пряной, маринованной (бочковой), вяленой рыбы. Готовая продукция не должна содержать жизнеспособных личинок описторхиса.
Рыбу язь для приготовления вяленой продукции холодного копчения допускают после замораживания.
Санитарно-паразитологический контроль рыбы и рыбной продукции на рынках обеспечивает руководитель рынка. Рыба, содержащая жизнеспособные личинки описторхиса, подлежит обеззараживанию.
Учитывая высокую устойчивость метацеркарий описторхисов к низким температурам, замораживание рыбы при более высокой температуре не гарантирует ее обеззараживания.
Обеззараживание рыбы от личинок описторхиса обеспечивается применением смешанного крепкого и среднего посола (плотность тузлука с первого дня посола 1,20 при температуре 1 — 2 °C) при достижении массовой доли соли в мясе рыбы 14%. При этом продолжительность посола должна быть:
а) пескаря, уклейки, гольяна, верховки — 10 суток;
б) плотвы, ельца, красноперки, голавля, синца, белоглазки, подуста, чехони, жереха, щиповки, мелких (до 25 см) язей, лещей, линей — 21 сутки;
в) крупных (свыше 25 см) язей, лещей, линей — 40 суток.
Допускается более слабый или менее длительный посол «условно годной» рыбы только после предварительного ее замораживания в режимах, указанных выше.
При невозможности обеспечить режимы замораживания, гарантирующие обеззараживание рыбной продукции, ее следует использовать для пищевых целей только после горячей термической обработки или стерилизации (консервы) в соответствии с действующими технологическими инструкциями.
Заморозка: в бытовом холодильнике личинки сохраняют жизнеспособность. При температуре -40 0 — 7 часов, при — 35 0 — 14 часов, при -280 — 32 часа.
При засолке рыбы необходимо применять 2кг соли на 10 кг рыбы. При этом продолжительность соления мелкой рыбы (до 25 см) — 14 суток; крупных (свыше 25 см) — 40 суток.
Вяление необходимо проводить с предварительным посолом в течение 2 недель из расчета 2 кг соли на 10 кг рыбы.
Варить рыбу следует порционными кусками не менее 20 минут с момента закипания, рыбные пельмени — не менее 20 минут с момента закипания. Рыбу (рыбные котлеты) необходимо жарить порционными кусками в жире 20 минут. Крупные куски рыбы весом до 100 г следует жарить в распластанном виде не менее 20 минут. Мелкую рыбу можно жарить целиком в течение 15—20 минут. Рыбные пироги необходимо выпекать 60 минут.
При холодном копчении рекомендуется предварительный посол в течение 2 недель (из расчета 2 кг соли на 10 кг рыбы).
Лечебно-профилактические мероприятия
Выявление инвазированных осуществляют лечебно-профилактические организации независимо от организационно-правовых форм и форм собственности, а также лица, занимающиеся частной медицинской практикой, при обращении и оказании медицинской помощи, а также при профилактических, плановых, предварительных при поступлении на работу и периодических обследованиях и осмотрах в установленном порядке.
Контрольные обследования.
Выявленные инвазированные берутся на учет в кабинетах инфекционных заболеваний или участковыми терапевтами (педиатрами) с заполнением контрольной карты диспансерного наблюдения. Контроль эффективности лечения проводят через 3 месяца после дегельминтизации. Критерии эффективности лечения — три отрицательных результата копроовоскопических исследований или однократного отрицательного результата дуоденального содержимого.
Отходы запрещается скармливать скоту, домашним животным и зверям, а также сбрасывание в водоемы.
Дифиллоботриоз зоонозный биогельминтоз с хроническим течением, характеризующийся нарушением функций верхнего отдела пищеварительного тракта, а при тяжелом течении — развитием анемии.
Возбудитель — лентец широкий — Diphyllobothrium latum .
Его длина может достигать 2 – 10 м, в редких случаях — 15 – 20 м.
Яйца лентеца широкого выделяются из кишечника человека еще незрелыми, и их развитие происходит в воде. Дальнейшее развитие личинки происходит в заглотивших ее первых промежуточных хозяевах — различных видах веслоногих рачков.
Проглоченные различными планктоноядными рыбами и мальками хищных рыб инвазированные рачки перевариваются, а процеркоиды пробуравливают кишечную стенку и мигрируют в различные органы рыбы. У щук и налимов плероцеркоиды располагаются во внутренних органах и мышцах, у окуней и ершей — всегда в мышцах.
Патогенное действие широкого лентеца на организм человека обусловлено рядом факторов: механическим воздействием на слизистую кишечника, токсико-аллергическими реакциями, а также развитием авитаминоза.
Прикрепляясь к слизистой оболочке тонкой кишки, лентецы ущемляют ее своими ботриями, что приводит к местному изъязвлению, некротизации и атрофии.
Продолжительность жизни широкого лентеца может достигать 20 и более лет.
Профилактика дифиллоботриоза:
Выявление инвазированных людей, тщательная кулинарная обработка рыбы и икры.
При этом необходимо учитывать, что гибель паразитов при замораживании рыбы во всей массе наступает:
при -6 – 8°С через 7 суток,
при -12°С в течение 3 дней,
при -16°С через 36 ч,
при -27°С спустя 12 ч.
При посоле икры рыб в качестве самостоятельного продукта соблюдаются следующие условия:
– теплый посол (температура 15 – 16°С) проводится в 12% растворе поваренной соли в течение 30 минут, в 10% растворе — в течение часа, в 8% — 2 ч; в 6% — 6 ч;
– охлажденный посол (при температуре 5 – 6°С) производится при тех же концентрациях соли, но время экспозиции удваивается.
Тениаринхоз— антропонозный биогельминтоз с хроническим течением, характеризующийся преимущественно желудочно-кишечными расстройствами. Возбудитель — цепень бычий, или цепень невооруженный — Taenia saginata.
Когда стробила гельминта достигает 5 – 7 метров длины, конечные членики отрываются и вместе с фекалиями или самостоятельно выходят наружу. Они выделяются обычно поодиночке, в среднем по 6 – 8 в течение суток. В каждом членике находится до 175 тыс. яиц. Членики способны активно двигаться. Промежуточный хозяин — крупный рогатый скот (бык, буйвол, зебу, як, северный олень). Скот заражается онкосферами на пастбищах при заглатывании члеников или онкосфер с травой, сеном, водой или подлизывая мочу, находящуюся вблизи фекалий.
Цистицерки имеют форму овальных пузырьков размером от горошины до зерна фасоли (4 – 10 мм в поперечнике).
В организм — человека — цистицерки невооруженного цепня попадают при употреблении в пищу недостаточно проваренного финнозного мяса животных — промежуточных хозяев этого гельминта.
В кишечнике человека сколекс цистицерка выворачивается наподобие пальца перчатки и прикрепляется присосками к слизистой оболочке кишки (обычно двенадцатиперстной) и начинает расти.
От момента заражения до созревания зрелых члеников проходит около 3 месяцев. Длительность жизни паразита иногда достигает 20 лет. Бычий цепень, как правило, паразитирует у человека в единственном числе.
Патогенез и клиника. Скопление цепней может вызвать закупорку кишечника. Интенсивное потребление паразитом пищевых веществ, создают дефицит наиболее ценных компонентов питательных веществ, вследствие чего постоянно ощущается чувство голода, повышается потребление пищи, снижается масса тела. Постоянное выползание члеников из заднего прохода и их передвижение по коже угнетающе действует на психику больного.
Эпидемиология. Механизм заражения — пероральный. Фактором передачи служит мясо крупного рогатого скота и мясные изделия.
Профилактика и меры борьбы. Для обеззараживания мяса и мясопродуктов, пораженных цистицерками бычьего цепня, используют замораживание. При снижении температуры в толще мяса до -12°С все цистицерки погибают немедленно. При температуре -6 – 9°С тушу выдерживают в холодильной камере не менее 24 ч.
Куски мяса массой до 2 кг и толщиной до 8 см варят в течение 3 часов в открытых или 2,5 часа. Допускается обеззараживание говядины путем ее засолки. Куски мяса массой не более 2,5 кг засыпают поваренной солью из расчета 1 кг соли на 10 кг мяса, затем заливают 24% рассолом поваренной соли и выдерживают 20 суток.
Личная профилактика заключается в исключении из рациона сырого и недостаточно термически обработанного мяса крупного рогатого скота, а также мяса, не прошедшего ветеринарный контроль (неклейменого).
Тениоз — антропонозный биогельминтоз, одним из основных клинических проявлений которого является нарушение функций желудочно-кишечного тракта.
Возбудитель — цепень вооруженный (свиной) — Taenia solium.
Взрослые свиные цепни паразитируют в тонкой кишке человека, который является их единственным дефинитивным хозяином. Отделившиеся от стробилы зрелые членики выделяются наружу только пассивно с фекалиями больного. Яйца, заключенные в члениках, содержат вполне сформированную личинку, которая не нуждается в дозревании во внешней среде.
Промежуточными хозяевами чаще всего служат домашняя свинья, дикий кабан, медведь, верблюд, реже — собака, кошка, кролик, заяц и др.
Они заражаются при заглатывании члеников и онкосфер с пищей или водой.
Продолжительность жизни цистицерков у свиньи 3 – 6 лет, после чего они сморщиваются, петрифицируются и погибают.
С фекалиями выделяются преимущественно кусочки стробилы, состоящие из 5 – 6 члеников. Продолжительность жизни цепня вооруженного в кишечнике человека составляет несколько лет.
Патогенез и клиника. При неосложненном кишечном тениозе в основе патогенеза лежат те же механизмы, что и при тениаринхозе. Клинические симптомы у этих двух нозоформ идентичны, однако при тениозе они, как правило, более выражены. В основном возникают диспепсические и неврологические расстройства: нарушение аппетита, тошнота, рвота, боли в животе, неустойчивый стул, периодические головные боли, головокружение, обморочные состояния, нарушение сна.
Эпидемиология. Источником заражения является инвазированный человек, выделяющий с фекалиями членики и яйца гельминта. Рассеивание их в окружающей среде приводит к заражению промежуточных хозяев (главным образом, свиней). Люди заражаются при употреблении в пищу недостаточно термически обработанного мяса свиней, иногда мяса диких кабанов и медведей. Поскольку свиньям свойственна копрофагия, то их мясо иногда бывает очень интенсивно заражено цистицерками. Именно поэтому при тениозе в желудочно-кишечном тракте человека часто паразитирует много экземпляров цепня свиного.
Профилактика и меры борьбы.
Учитывая высокую степень устойчивости цистицерков свиного цепня к воздействию низких температур, обеззараживание свиных туш методом замораживания производится при более жестком температурном режиме. Температуру в толще мышцы свиной туши необходимо довести до -10°С и выдержать при температуре воздуха в камере -12°С в течение 10 суток.
Гименолепидоз— контагиозный гельминтоз человека и некоторых мышевидных грызунов, характеризующийся, главным образом, нарушениями функций пищеварительного тракта.
Возбудителем гименолепидоза служит карликовый цепень — Hymenolepis nana.
Карликовый цепень относится к гельминтам с упрощенным жизненным циклом, который обычно начинается и заканчивается в организме человека, то есть человек служит и промежуточным, и окончательным хозяином.
При заглатывании человеком инвазионных яиц H. nana в тонкой кишке онкосферы освобождаются от яйцевых оболочек и активно внедряются в ворсинки, где превращаются в зрелых ларвоцист
Продолжительность жизни карликового цепня, включая личиночный период развития, около 2-х месяцев.
Осложнения обострение течения язвы желудка и двенадцатиперстной кишки.
Эпидемиология. Основным источником заражения при гименолепидозе является больной человек. Механизм передачи — фекально-оральный. Основными путями передачи служат контактно-бытовой и пищевой. Заражение может происходить непосредственно от инфицированного человека или через предметы обихода. Поэтому гименолепидоз относят к контагиозным гельминтозам. Фактором передачи инвазионного начала могут служить загрязненные яйцами гельминтов руки, ночные горшки, дверные ручки, стульчаки туалетов, игрушки, пищевые продукты, кухонная утварь, предметы обихода.
Профилактика и меры борьбы. Большое значение имеют меры личной профилактики: строжайшее соблюдение правил личной гигиены, привитие гигиенических навыков детям (мытье рук перед едой и после посещения туалета, искоренение привычки у детей младшего возраста сосать пальцы и грызть ногти).
Аскаридоз
Возбудителем аскаридоза человека является аскарида человеческая — Ascaris lumbricoides.
Взрослые самцы и самки аскарид паразитируют обычно в тонкой кишке человека.
Выделение яиц самками заканчивается к 7 месяцу их жизни. Продолжительность жизни состовляет от 11-13 месяцев.
Осложнения. Одно из наиболее серьезных осложнений — непроходимость кишечника, которая образуется вследствие рефлекторного спазма или закупорки просвета кишечника клубком аскарид. Проникновение аскарид в червеобразный отросток иногда вызывает аппендицит.
Эпидемиология. Единственным источником инвазии является зараженный аскаридозом человек, выделяющий с фекалиями огромное количество яиц. Одна самка выделяет до 240 тыс. яиц в сутки. Механизм передачи преимущественно фекально-оральный. Факторами передачи служат главным образом почва, руки, пища, в меньшей степени вода.
Аскаридоз — один из наиболее распространенных гельминтозов. Профилактика и меры борьбы. Необходимо мыть руки перед приемом пищи и после загрязнения их землей; употреблять в пищу только тщательно промытые и ошпаренные кипятком овощи, ягоды и фрукты, особенно редис и морковь, которые тесно контактируют с землей. Ягоды, имеющие шероховатую поверхность или дольчатое строение (клубника, земляника, малина и др.) следует обмывать 1% раствором питьевой соды, а затем чистой водой.
Трихоцефалез
Характеризуется хроническим течением (до 3 – 5 лет). Нередко протекает бессимптомно или субклинически. Самки власоглава откладывают в сутки от 1000 до 3500 незрелых яиц.
Эпидемиология. Источник инвазии, механизм и пути передачи трихоцефалеза в основном такие же, как при аскаридозе.
Профилактика и меры борьбы. Меры профилактики трихоцефалеза сходны с мерами, проводимыми при аскаридозе. Они заключаются в своевременном выявлении и лечении инвазированных, в охране окружающей среды от фекального загрязнения, соблюдении правил личной гигиены и тщательном мытье овощей и фруктов перед употреблением их в пищу.
Энтеробиоз — (контагиозный антропонозный гельминтоз, проявляющийся перианальным зудом, диспепсическими расстройствами и невротическими реакциями (особенно у детей).
В самке находится (от 5000 – 17000 тыс. яиц в каждой). Во время сна острицы выползают из анального отверстия и откладывают яйца в перианальных складках хозяина, после чего погибают. Длительность их жизни не превышает 1 месяца.
Осложнения. Наиболее частыми осложнениями являются энтеробиозные аппендициты, обусловленные сочетанием инвазии острицами и вторичной бактериальной инфекцией; энтеробиозный эндометрит и раздражение тазовой брюшины в результате миграции самок остриц через половые пути женщин.
Источник инвазии — больной человек. Механизм передачи — фекально-оральный.
Энтеробиоз — один из наиболее широко распространенных гельминтозов человека.
Профилактика и меры борьбы. Необходимо строго соблюдать правила личной гигиены. Ногти должны быть коротко острижены, и при каждом мытье рук подногтевые пространства надо тщательно очищать. Перед едой и после посещения уборной следует мыть руки. Необходимо искоренить свойственную некоторым детям привычку брать пальцы в рот и грызть ногти. В помещениях ежедневно производится влажная уборка с использованием дезинфектантов, все вещи и предметы протираются от пыли. Эффективным способом является кварцевание помещений.
Инвазированные острицами подлежат обязательному лечению в амбулаторных или стационарных условиях (при необходимости изоляции по эпидемиологическим показаниям) на основании их добровольного информированного согласия и с учетом права на отказ от медицинского вмешательства.
Инвазированные острицами лица, относящиеся по роду своей профессиональной деятельности к декретированному контингенту, на период лечения (в соответствии с трудовым законодательством) переводятся на другую работу, не связанную с риском распространения энтеробиоза. При невозможности перевода таких работников временно (на период лечения и контрольного лабораторного обследования) отстраняют от работы с выплатой компенсации в установленном законодательством порядке. Взрослое население, профессионально не относящееся к декретированным контингентам, на период лечения от работы не отстраняется.
Детей, инвазированных острицами, являющихся источниками распространения энтеробиоза, не допускают в дошкольные образовательные учреждения, на период лечения и проведения контрольного лабораторного обследования.
При плановых профилактических обследованиях детей в организованных коллективах и выявлении 20% и более инвазированных острицами на период лечения из детского коллектива не отстраняют. Химиопрофилактику проводят одновременно всем детям и персоналу препаратами, разрешенными для этих целей, в установленном порядке в соответствии с инструкцией на препарат.
На период проведения лечебно-профилактических мероприятий впервые поступающих детей или длительно отсутствовавших в детский коллектив не принимают.
Трихинеллез— зоонозный биогельминтоз, вызываемый личинками трихинелл и характеризующийся острым течением, лихорадкой, выраженными аллергическими проявлениями и поражением поперечнополосатой мускулатуры.
Основным возбудителем трихинеллеза человека служит один из видов рода трихинелл — Trichinella spiralis
Длительность жизни самок трихинелл в кишечнике человека составляет 3 – 6 недель. За это время одна самка отрождает от 200 до 2000 личинок, размером около 0,1 мм. Через слизистую оболочку кишечника личинки проникают в лимфатическую, а затем в кровеносную систему и током крови разносятся по всему организму хозяина.
Миграция личинок начинается на 6 й день после заражения. Личинки активно проникают из капилляров в мышечные волокна поперечнополосатой скелетной мускулатуры. Там они увеличиваются в размерах до 0,8 – 1 мм, начинают свертываться спиралью. Вокруг них начинает образовываться капсула и спустя 18 – 20 дней личинки становятся инвазионными. С 6 го месяца после инвазирования в капсулах начинается процесс обызвествления, при этом многие личинки погибают, но некоторые сохраняют жизнеспособность в течение 25 и более лет.
Трихинеллы чаще всего поражают наиболее активно работающие мышцы, обильно снабжаемые кровью, насыщенной кислородом: ножки диафрагмы, межреберные, жевательные, глазодвигательные, шейные мышцы, мышцы гортани и языка.
Наиболее часто первыми симптомами заболевания являются лихорадка, головная боль, развитие отеков лица и крапивницы.
Температура, как правило, поднимается внезапно до 39 – 40°С и держится на высоком уровне в течение 7 – 8 дней. Одновременно с повышением температуры появляются отеки век, а затем и всего лица.
Профилактика и меры борьбы.
– предотвращение поедания свиньями трупов грызунов и других животных
– обязательное исследование на трихинеллез туш всех забиваемых свиней и недопущение в пищу свинины, не прошедшей ветеринарно-санитарный контроль.
Информацию подготовил: врач-эпидемиолог БУ «Нижневартовская городская поликлиника» Егорова И.А.
Количество просмотров: 2536
Понимание и лечение инфекции остриц в колониях мышей
Острицы — это паразиты-нематоды (семейство Oxyuridae), которые имеют простой прямой жизненный цикл и часто являются контаминантами как специфических, свободных от патогенов (SPF), так и обычных колоний лабораторных мышей. Острицы передаются при попадании внутрь яиц с зародышем. Два вида остриц, которые обычно заражают лабораторных мышей, — это Syphacia obvelata и Aspiculuris tetraptera .
Животные могут быть инфицированы обоими видами одновременно.Распространенность остриц в популяции инфицированных грызунов зависит от многих факторов, включая экологическую нагрузку, пол, возраст, напряжение и иммунный статус. У самцов, как правило, больше паразитов, чем у самок, в то время как у молодых животных, как правило, больше паразитов, чем у старых. Лабораторные мыши, как правило, более устойчивы к экспериментально индуцированной инфекции, чем дикие мыши. Атимические мыши, как и следовало ожидать, имеют повышенную восприимчивость к инфекции.
Syphacia spp. находятся в слепой или передней части толстой кишки, где они питаются бактериями, присутствующими в просвете.Самки мигрируют в задний проход и откладывают покрытые липким слоем яйца непосредственно на перианальной коже. Syphacia spp. яиц становятся заразными через 5-20 часов после выпуска. S. obvelata имеет предпатентный период (время от поедания инфекционных личинок до производства яиц половозрелыми червями), составляющий 11-15 дней. Syphacia spp. может эмбрионировать на хозяине и ретроинфицировать животное, мигрируя обратно в тело.
Aspiculuris tetraptera личинки обитают в криптах Либеркуна в проксимальном отделе толстой кишки после вылупления в слепой кишке.В отличие от Syphacia spp., A. tetraptera мигрируют из проксимального в дистальный отдел толстой кишки, откладывая яйца. Затем яйца выводятся с калом и не заразны до 5-8 дней. A. tetraptera имеет препатентный период 21-25 дней.
В отличие от многих распространенных болезней лабораторных мышей, инфекции остриц можно лечить
Инфекции острицами обычно считаются умеренно патогенными или непатогенными у животных с нормальной иммунной системой. Однако инфекция острицы может помешать достижению целей исследования по ряду причин.Было показано, что инфекция остриц усиливает гуморальный иммунный ответ хозяина на непаразитарные антигенные стимулы и ускоряет развитие печеночной монооксигеназной системы. У бестимусных мышей инфекция остриц может спровоцировать развитие лимфопролиферативного заболевания, которое в конечном итоге приводит к лимфоме.
В отличие от многих распространенных болезней лабораторных мышей, инфекции остриц можно лечить. Программа повторной деривации заслуживает некоторого рассмотрения, особенно если в колонии присутствуют другие патогены, и колония может поддерживаться в высоком состоянии здоровья после повторной деривации.От остриц лечат глистогонными составами.
Программы лечения могут включать ивермектин, вводимый местно или с питьевой водой, или лечение измельченным кормом, содержащим фенбендазол. Однако антигельминтики не являются полностью доброкачественными соединениями, поэтому при лечении, особенно ивермектином, могут возникать побочные эффекты.
Яйца остриц обычно считаются стойкими загрязнителями окружающей среды, и часто принимаются строгие санитарные меры, чтобы избавить помещения для животных от яиц.Многие из этих мер принимаются на основе характеристик человеческой острицы, Enterobius vermicularis , которая интенсивно изучается как представитель Oxyuridae. В нескольких отчетах прямо задокументировано присутствие яиц оксиуридов грызунов в окружающей среде, но тщательная очистка помещения для животных редко бывает плохой идеей, хотя это может быть дорогостоящим и трудоемким.
Рис. 1. Фекальный поплавок с яйцеклеткой Aspiculuris tetraptera.
Рисунок 2.Ленточный тест, показывающий многочисленные яйца Syphacia obvelata.
Список литературы
(авторы выделены жирным шрифтом — ученые лаборатории Джексона)
Притчетт К. и Джонстон Н. Обзор методов борьбы с инфекциями остриц в колониях лабораторных грызунов. Contemp. Вершина. Лаборатория. Anim. Sci 2002; 41: 31-41.
[PMID: 11958602]
пробиотиков для борьбы с паразитами: обзор
Пробиотики определяются как живые организмы, приносящие пользу хозяину.Их эффективность была продемонстрирована для лечения желудочно-кишечных заболеваний, респираторных инфекций и аллергических симптомов, но их использование в основном ограничивается бактериальными и вирусными заболеваниями. В течение последнего десятилетия, пробиотики как средство борьбы с паразитарными инфекциями были зарегистрированы в основном в отношении кишечных заболеваний, но также и некоторых нематериальных инфекций, которые имеют важное значение для человека и ветеринарии. В большинстве случаев доказательства положительного эффекта были получены в исследованиях на животных моделях.В некоторых случаях клеточные взаимодействия между пробиотиками и патогенами или соответствующими клетками-хозяевами также исследовались с использованием систем культивирования in vitro. Однако молекулярные механизмы, опосредующие положительные эффекты, еще плохо изучены. Эти исследования показывают, что пробиотики действительно могут обеспечивать штамм-специфичную защиту от паразитов, вероятно, через несколько механизмов. Но необходимы дополнительные исследования, чтобы оправдать использование пробиотиков в терапии.
1. Введение
ВОЗ определяет пробиотики как «живые организмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» (http: // www.who.int/foodsafety/publications/fs_management/probiotics2/en/). Важно отметить, что общее определение пробиотиков для рода или вида невозможно установить, поскольку два близкородственных штамма могут вызывать обратные эффекты. Следовательно, пробиотик всегда должен быть полностью охарактеризован на уровне штамма [1]. Хороший пробиотический штамм должен обладать полезными свойствами (иммуностимуляция, защита от патогенов, метаболизм и т. Д.), Быть непатогенным, устойчивым к низким pH и кислотам, таким образом сохраняться в кишечнике и быть способным прикрепляться к эпителию кишечника [2].Этим критериям удовлетворяют около 50 штаммов, соответствующих 26 видам. Большинство пробиотических организмов — это грамположительные бактерии, выделенные из микрофлоры кишечника человека или различных молочных продуктов, таких как творог, ласси и кулфи. Однако положительные эффекты пробиотиков чаще демонстрируются на модельных животных, чем на прямых клинических доказательствах, и в значительной степени зависят от принятой дозы. Рекомендуется доза не менее пяти миллиардов колониеобразующих единиц в день в течение не менее 5 дней [2]. Эта минимальная доза учитывает выживаемость проглоченных пробиотиков в желудочно-кишечном тракте, где они конкурируют с резидентными бактериями [3].Сообщается о трех основных преимуществах (рис. 1).
Модуляция кишечной среды пробиотиками, обладающими способностью контролировать распространение окружающих микроорганизмов, и / или конкуренцией за заселение общего биотопа (например, доступ к питательным веществам) [2]. Например, железо является ограничивающим питательным веществом: оно важно для большинства бактерий, и пробиотики могут конкурировать за его доступность. Lactobacillus может сделать железо недоступным для патогенных микроорганизмов, либо связывая гидроксид железа на его поверхности [4], либо секретируя сидерофоры, которые образуют хелат и транспортируют железо [3].Некоторые пробиотики также способны влиять на состав и равновесие микрофлоры кишечника (см. Обзор [5]). Например, было показано, что пробиотическая терапия с использованием смеси пробиотиков (VSL # 3) увеличивает общее количество кишечных бактерий и восстанавливает разнообразие бактериальной микробиоты у пациентов [6]. Наконец, пробиотики также могут контролировать свою биотическую среду посредством регуляции перистальтики кишечника и секреции слизи [2].
Секреция активных молекул (например,грамм. бактериоцины, антибиотики, свободные жирные кислоты, перекись водорода), которые могут контролировать рост и / или выживание окружающих микроорганизмов. Бактериоцины — это секретируемые пептиды или белки, которые обычно убивают близкородственные бактерии, проникая через их мембраны или вмешиваясь в основные ферменты (см. Обзор [5]). Многие из них продуцируются пробиотическими штаммами Lactobacillus (лактацин B, лактацин F, низин и др.). Lactobacillus reuteri продуцирует реутерин (3-гидроксипропиональдегид), антибиотик широкого спектра действия, активный против бактерий, дрожжей, грибов, простейших и вирусов [7].Снижая местный рН кишечника с помощью молочной кислоты, пробиотики также могут изменять рост чувствительных к кислоте организмов [5].
Модуляция иммунитета путем стимуляции иммунного ответа хозяина на различные патогены. В кишечнике пробиотики взаимодействуют с эпителиальными клетками, М-клетками Пейера и иммунными клетками. Эти взаимодействия приводят к увеличению количества клеток, продуцирующих IgA, что сопровождается выработкой IgM и секреторного IgA, которые особенно важны для иммунитета слизистых оболочек, способствуя созданию барьера против патогенных организмов [8, 9].Кроме того, пробиотики могут также влиять на дендритные клетки, которые отвечают за сбор антигенов из кишечника и их презентацию наивным Т-клеткам, что приводит к их дифференцировке в Т-хелперы (Th2, Th3) или Т-регуляторные лимфоциты. Молекулы пробиотиков, участвующие в индукции дендритных клеток, плохо охарактеризованы, за исключением белка A S-слоя L. acidophilus NCFM, который регулирует созревание дендритных клеток и функции Т-клеток [10]. Также было показано, что пробиотики модулируют высвобождение цитокинов (TNF-IFN-, IL-10, IL-12) [11].Эти цитокины играют центральную роль в поддержании тонкого баланса между необходимыми и избыточными защитными механизмами. Например, полисахарид А, синтезируемый Bacillus fragilis NCTC 9343, защищает от экспериментального колита за счет адекватной индукции продукции IL-10 [12].
В заключение, пробиотики могут убивать или ингибировать патогены с помощью штамм-специфических механизмов, основанных на конкуренции, секреции молекул и / или иммунной индукции. Большинство описанных взаимодействий подразумевает наличие прокариотического патогена, который колонизирует один и тот же компартмент кишечника.Недавно было проведено несколько исследований, посвященных изучению того, могут ли пробиотики контролировать распространение эукариотических патогенов либо в кишечнике в качестве пробиотика, либо в другом отделе (рис. 2, таблица 1). Эта концепция подтверждается недавними исследованиями, показывающими, что комменсальная микрофлора кишечника может играть решающую роль в завершении жизненного цикла кишечной паразитической нематоды Trichuris muris и в модуляции иммунного ответа хозяина [13], а также может обеспечивать косвенный защитная иммуностимуляция против негутового паразита, Toxoplasma gondii [14].В следующих главах мы сообщим о последних результатах, касающихся воздействия пробиотиков на некоторых паразитов, как показано в таблице 1, и предложим будущие направления, которые помогут стандартизировать пробиотические тесты на эукариотические патогены.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источники коммерческих пробиотиков: Actimel : Lactobacillus bulgaricus, Streptococcus thermophilius и Lactobacillus casei DN-114 01; Mitogrow Imagilin Technology, состоит из живых Pediococcus acidilactici; Mitomax Imagilin Technology, состоит из живых Pediococcus acidilactici и Saccharomyces boulardii; Primalac содержит в основном Lactobacillus acidophilus и Lactobacillus casei; VSL # 3: четыре штамма лактобацилл ( Lactobacillus plantarum , Lactobacillus casei , Lactobacillus acidophilus и Lactobacillus bulgaricus ), три штамма бифидобактерий , Bifidobacter , Bifidobacter и longifidobacter breve ) и один штамм стрептококка ( Streptococcus thermophilius ).
2. Cryptosporidium
Cryptosporidium является кишечным патогеном, принадлежащим к группе альвеол, который может вызывать разрушительные желудочно-кишечные инфекции у людей с ослабленным иммунитетом. В окружающей среде Cryptosporidium обнаруживается в воде в виде ооцисты, инфекционной формы. После проглатывания ооцисты проходят через просвет кишечника в тонкий кишечник, где они высвобождают подвижные спорозоиты, которые прикрепляются и проникают в эпителиальные клетки желудочно-кишечного тракта.Спорозоиты локально разрушают микроворсинки и проникают в клетки-хозяева, чтобы создать свою внутриклеточную нишу, где они остаются во внецитоплазматической вакуоли. После репликации и уклонения паразитов ооцисты образуются и выводятся с фекалиями (см. Обзор [15]) (рис. 2). Эпителиальные клетки кишечника, инфицированные Cryptosporidium parvum , обнаруживают нарушение всасывания Na + и H 2 O, а также повышенную секрецию Cl —, что приводит к диарее.Нарушения барьерных свойств кишечного эпителия, частично вызванные нарушением межклеточных соединительных комплексов, также способствуют развитию диареи. Несмотря на реальный риск вспышек криптоспоридиоза, передаваемых через воду, полностью эффективной терапии не существует. Наиболее часто используемые препараты, такие как паромомицин и азитромицин или нитазоксанид, эффективны только в сочетании с иммуновосстанавливающими агентами [16]. Иммунокомпетентные взрослые мыши способны контролировать инфекцию Cryptosporidium parvum , тогда как мыши с нокаутом IFN и тяжелым комбинированным иммунодефицитом (SCID) восприимчивы к этому паразиту [17, 18].Помимо иммунитета, кишечная флора также может влиять на устойчивость к Cryptosporidium [19]: взрослые иммунокомпетентные мыши без микробов имеют повышенную чувствительность к Cryptosporidium , тогда как мыши SCID, колонизированные определенной анаэробной флорой (Altered Schaedler Flora), способны противостоять инфекции [20].
Было продемонстрировано положительное влияние пробиотиков на криптоспоридиоз: взрослые мыши (самки C57BL / 6, иммуносупрессированные вирусом лейкемии мышей (штамм LP-BM5), возраст 3-4 недель) получали ежедневно L.reuteri , штаммы 4000 и 4020 или L. acidophilus NCFM продемонстрировали снижение выделения ооцист [21, 22]. Эта частичная защита не была связана с восстановлением иммунитета (выработкой цитокинов). Ежедневный прием L. reuteri был также эффективным для предотвращения колонизации кишечника C. parvum и поражения тканей у хозяина с недостаточной иммунной системой (мыши с дефицитом TCR-альфа-гнотобиотика). Waters et al. предположили, что защита была вызвана секрецией еще не идентифицированных противомикробных препаратов [23].У человека был зарегистрирован единичный случай разрешения пролонгированного криптоспоридиоза с помощью пробиотического лечения [24].
С другой стороны, пробиотики менее эффективны у новорожденных животных [25]. При использовании двух различных смесей пробиотиков, Actimel или смеси пробиотиков VSL # 3 не наблюдалось значительного улучшения, хотя наблюдалась тенденция к более короткой продолжительности инфекции у животных, получавших пробиотики. Тем не менее, авторы пришли к выводу, что нельзя исключить некоторый эффект в других экспериментальных условиях, таких как длительное введение перед инфекцией и использование альтернативных животных моделей со зрелой кишечной флорой и иммунной системой.Отсутствие эффекта также наблюдалось в полевых условиях у телят голштинской породы, рожденных на молочной ферме, где криптоспоридиоз был эндемическим заболеванием. Несмотря на ежедневный прием бактериальной смеси в течение 10 дней после рождения, частота диареи и выделения фекалий у леченых и нелеченных животных была одинаковой [26]. Одним из ограничений исследований на сельскохозяйственных животных является одновременное воздействие пробиотиков и паразитов с момента рождения.
Интересно, что исследования in vitro продемонстрировали ингибирующие эффекты бесклеточных супернатантов L.acidophilus NCFM и L. reuteri штамм 23272 на жизнеспособность и инфекционность C. parvum и C. hominis [27, 28]. Точно так же бесклеточные супернатанты Bacillus brevis , Enterococcus faecium и Pseudomonas alcaligenes снижают устойчивость ооцист C. parvum , вызывая преждевременную эксцистанцию ооцисты [29]. Соединения, лежащие в основе такого ингибирования, исследуются.
3. Лямблии
Лямблии лямблии (также известные как Лямблии кишечные или Лямблии двенадцатиперстной кишки ) — кишечные патогенные простейшие паразиты, принадлежащие к группе Diplomonad, которые вызывают около 280 миллионов симптоматических инфекций у человека в год [30] .Этот моноксенный паразит, передающийся через воду, способен инфицировать широкий круг хозяев. У человека для инициации инфекции достаточно всего десяти экологически устойчивых кист. Кисты высвобождают подвижные и репликативные формы, известные как трофозоиты, во время их прохождения через желудочно-кишечный тракт. Эти формы размножаются в просвете кишечника, где они прикрепляются к эпителию (рис. 2). Эта фаза связана с симптомами заболевания: водянистая диарея, боль в эпигастрии, тошнота, рвота и потеря веса обычно появляются через 6–15 дней после проглатывания кисты, но половина инфекций остается бессимптомной.Лечение основано на метронидазоле и нитроимидазоле, но инфекции также могут разрешиться спонтанно. Т-клетки, нейтрофилы, макрофаги, а также антитела IgM, IgG и IgA являются основными участниками иммунного ответа, необходимого для разрешения лямблиоза. Цитокины Т-клеток также могут индуцировать выработку и высвобождение антигиардиальных дефенсинов [31]. Некоторые факторы, такие как общий вариабельный иммунодефицит (гипогаммаглобулинемия) или измененная микрофлора кишечника, по-видимому, предрасполагают к инфекции Giardia [29].Хотя сообщалось, что клиническое воздействие сильнее у маленьких детей и лиц с недостаточным питанием или иммунодефицитом, мало известно о том, как Giardia spp. вызывают заболевание, поскольку трофозоиты не инвазивны и выделяют неизвестные токсины [30].
Первое предложение об использовании пробиотиков для борьбы с инфекциями, вызываемыми Giardia , было сделано после открытия, что изогенные мыши обладают переменной восприимчивостью к инфекции Giardia в зависимости от их кишечной флоры [32].Интересно отметить, что устойчивость к инфекции Giardia могла передаваться от мыши к мыши в обычных помещениях и была устранена с помощью антибиотиков, таких как неомицин, активных против резидентной анаэробной флоры.
Важным шагом к пониманию пробиотической активности стало открытие того, что супернатант культуры пробиотического штамма LA1 Lactobacillus johnsonii способен контролировать рост G. lamblia in vitro [33]. В этом исследовании также были протестированы шесть других штаммов Lactobacillus acidophilus , но они не показали каких-либо заметных эффектов. L. johnsonii Супернатант LA1 блокировал развитие G. lamblia в фазе G1, но, по-видимому, был неспособен предотвратить адгезию G. lamblia к эпителиальным клеткам. Биохимическая характеристика супернатантов выявила присутствие неидентифицированных термочувствительных продуктов с низкой молекулярной массой [33]. Ежедневное добавление живых бактерий в питьевую воду песчанок за семь дней до орального заражения цистами G. lamblia защищало животных [34]. Также наблюдались снижение образования цист в фекалиях, сокращение предпатентной фазы и улучшение общего состояния здоровья.Это лечение показало защиту от пониженного всасывания питательных веществ, а также от гистологических изменений слизистой оболочки кишечника, обычно связанных с лямблиозом. Повышенный ответ спленоцитов на Т-клеточные и В-клеточные митогены, а также на антигены Giardia , предполагает, что, помимо потенциального воздействия внеклеточных факторов, обработка L. johnsonii LA1 усиливала иммунный ответ хозяина против Giardia. .
Штамм Lactobacillus casei MTCC 1423, а также Enterococcus faecium SF68 также были эффективны в устранении инфекции Giardia у мышей [35, 36].Защита была связана с уменьшением атрофированных ворсинок и инфильтрирующих клеток в тонком кишечнике мышей, получавших пробиотики [35], или с усилением иммунного ответа, поскольку продукция специфических анти- Giardia кишечных IgA и IgG была замечена при лечении. мыши [36]. Недавно эксперименты in vivo на истощенных мышах показали, что ежедневная предварительная обработка L. casei MTCC1423 эффективно снижает как тяжесть, так и продолжительность лямблиоза по сравнению с истощенными мышами, не получавшими пробиотиков [37].
Исследования, проведенные на людях в 1995 г., показали положительный эффект введения пробиотических дрожжей Saccharomyces boulardii (Reflos) не непосредственно для предотвращения лямблиоза, а для помощи в выздоровлении от постинфекционного синдрома раздраженного кишечника (PI-IBS, см. Раздел 7), осложнение, возникающее у некоторых пациентов, излечившихся от паразита с помощью лекарств [38]. Это наблюдение было подтверждено более поздним исследованием, показывающим, что S. boulardii снижает количество кист паразита в фекалиях пациентов, получавших комбинацию S.boulardii и метронидазол в сравнении с пациентами, получавшими только метронидазол [39].
В то время как эти исследования сходятся на существовании положительного эффекта, обеспечиваемого различными типами пробиотиков при лямблиозе, необходимо провести дополнительную работу, чтобы определить, есть ли прямое влияние на развитие G. lamblia в организме хозяина или просто снижение патологических эффектов или, что более вероятно, их комбинации.
4. Eimeria
Eimeria — это апикомплексный паразит, ответственный за кокцидиоз домашней птицы, домашнего скота и мелких животных, таких как кролики, собаки и кошки.Птичий кокцидиоз — это серьезное паразитарное заболевание домашней птицы, имеющее очень большие экономические последствия [40]. Птицы заражаются в результате проглатывания спорулированных ооцист, которые впоследствии выделяются с образованием спорозоитов в просвете верхнего отдела кишечника. Эти спорозоиты мигрируют в предпочтительные для них места развития, различающиеся между семью видами, имеющими ветеринарное значение. Затем они проникают в энтероциты ворсинок и претерпевают первое бесполое размножение, шизогонию, что приводит к высвобождению многочисленных мерозоитов, которые инициируют вторую шизогонию, заражая новые эпителиальные клетки.Наконец, образуются макро- и микрогаметы, инициирующие половую фазу, в результате которой образуются устойчивые к окружающей среде ооцисты, которые выделяются с фекалиями [41] (Рисунок 2). Лекарства (например, ампролиум, галофугинон или полиэфирные ионофоры, такие как монензин лазалоцид) и живые вакцины являются двумя основными мерами борьбы с этим заболеванием. Однако с лекарственной устойчивостью нужно бороться постоянно, и уже много лет новые лекарства не вводятся. Живые вакцины против кокцидиоза очень эффективны на основе неаттенуированных и аттенуированных штаммов.Однако они демонстрируют низкий запас прочности для первых и риск возврата к вирулентности, а также дорогостоящее крупномасштабное производство для вторых. Не сообщалось об успешных подходах к разработке рекомбинантных вакцин [42]. Поэтому необходимы альтернативные методы контроля [43]. Пробиотики широко используются в птицеводстве, поскольку они помогают поддерживать нормальную микрофлору кишечника, улучшают потребление корма и пищеварение, а также способны стимулировать иммунную систему [44].Лишь ограниченное количество исследований посвящено их защитному эффекту против видов Eimeria , ответственных за кокцидиоз птиц [45–49].
Введение Прималака, коммерчески доступного препарата на основе Lactobacillus , цыплятам от рождения до трех недель способно стимулировать интраэпителиальные лимфоциты кишечника и значительно снизить (до 75%) количество ооцист E. acervulina у обработанных цыплят [45].Более того, у птиц, получавших диету с дефицитом витамина А, было показано, что Primalac усиливает иммунитет птиц, даже если в этом случае выделение ооцист было меньше, чем в предыдущем исследовании (до 26%) [46]. Третья серия экспериментов с тем же общим протоколом, но с удвоенной инфекционной дозой показала небольшое, но значительное повышение уровней цитокинов (-IFN и IL-2) вместе со снижением выделения ооцист у цыплят, обработанных Прималаком, по сравнению с контрольными цыплятами, но не различия в уровне антител anti- Eimeria [47].Был сделан вывод, что уровень защиты может зависеть от дозы контрольного заражения, но опосредуется иммунной стимуляцией, о чем свидетельствует повышение уровня цитокинов [47].
Другие коммерчески доступные пробиотические препараты (Митомакс, комбинация Pediococcus acidilactici и Saccharomyces boulardii , и только Mitogrow, Pediococcus acidilactici ) были испытаны на цыплятах, впоследствии инфицированных E. tenella vul и E. a. используя экспериментальные процедуры, описанные Dalloul et al . [40, 48]. В то время как Mitomax вызывал на 10–38% снижение количества выделяющихся ооцист, сопровождаемое повышенным уровнем антител против Eimeria [48], Mitogrow вызывал повышение уровня антител против Eimeria и не приводило к значительному снижению количества из E. acervulina выделяет ооцисты [40].
Таким образом, хотя результаты сходятся к существованию защитного, хотя и частичного, эффекта этих различных пробиотических препаратов против кокцидиоза птиц, задействованные механизмы в настоящее время остаются неуловимыми, с различными данными, касающимися снижения выделения ооцист, уровней цитокинов, и антитела против Eimeria .
Tierney et al. исследовали взаимодействия между штаммами Lactobacillus куриного происхождения и Eimeria [49]. Три штамма Lactobacillus были выделены из различных частей желудочно-кишечного тракта курицы и протестированы на их способность предотвращать инвазию E. tenella in vitro на клеточной модели MDBK (Madin-Darby bovine kidney). Все штаммы значительно подавляли инвазию, возможно, за счет стерического вмешательства или конкурентного исключения.Потенциальный эффект секретируемых ими внеклеточных факторов был дополнительно исследован путем тестирования супернатантов культур Lactobacillus . Один супернатант, продуцируемый изолятом Lactobacillus salivarius Lb16c6, полученным из слепой кишки, проявлял значительную активность, на которую незначительно влияла 30-минутная обработка при 100 ° C. Однако молекулярный принцип, ответственный за этот ингибирующий эффект, еще не обнаружен.
5. Черви
В ходе своей работы, показывающей, что иммуностимуляторы могут вызывать неспецифическую устойчивость против паразитов, Bautista-Garfias et al.оценили способность жизнеспособного или мертвого пробиотика Lactobacillus casei вызывать устойчивость к Trichinella spiralis у мышей [50]. Эта нематода ответственна за трихинеллез, одно из самых распространенных и клинически важных заболеваний в мире. Люди могут заразиться, употребляя зараженную пищу. Черви созревают в кишечнике промежуточного хозяина, такого как свинья, попадают в кровь и лимфатическую систему и проникают в поперечнополосатые мышцы. Миграция личинок вызывает повреждение тканей хозяина и воспалительные реакции с осложнениями, которые могут привести к смерти.Эффективность лечения на основе мебендазола или альбендазола различна. Как жизнеспособные, так и мертвые L. casei ATCC7469 вводили перорально мышам NIH и вызывали защитный ответ со значительным сокращением как взрослых червей (58 и 44%, соответственно), так и личинок на грамм мышцы (до 70%). . Обработка супернатантом культуры L. casei была менее эффективной, но все же показала значительный эффект (снижение количества взрослых червей на 32%). Авторы связывают защитный эффект с продукцией IL-2, -IFN и оксида азота [50, 51].
Toxocara canis — кишечная аскарида, поражающая в первую очередь собак. Люди и грызуны являются паратеническими хозяевами, которые заражаются при проглатывании яиц либо с зараженной пищей, либо в результате геофагии. Проглоченные яйца вылупляются и распространяются по всему телу, что приводит к симптомам, связанным с токсокарозом человека (мигрирующая висцеральная или оккулярная личинка или скрытый токсокароз). Basualdo et al., . сообщил о впечатляющем эффекте E. faecalis CECT 7121 на T.canis развитие личинок у мышей N: NIH-Swiss: снижение количества личинок в печени и легких на 90% было измерено через 48 часов после заражения яйцами с зародышем [52].
Аналогичным образом Ascaris suum , которая обычно поражает свиней, также может передаваться людям, когда мигрирующие личинки вызывают поражения печени и эозинофильный пневмонит. Обработка пробиотиками свиноматок во время беременности и их поросят после рождения с помощью Bifidobacterium lactis (изолят свиньи) ослабляет ингибирование всасывания глюкозы в тонком кишечнике, вызванное A.suum , признак, связанный с изгнанием паразита из тощей кишки [53]. Свиньи, получавшие пробиотики, все еще нормально изгоняют A. suum из кишечника. Таким образом, лечение, по-видимому, противодействует негативному аспекту ответа на инфекцию, связанному с потреблением питательных веществ, не влияя на защитный иммунный ответ [53, 54].
Schistosoma mansoni , кровяной трематодный червь, является основным возбудителем бильгарциоза. Заражение человека инициируется при контакте с водой свободно плавающих вилкохвостых церкарий.После созревания в коже личинки мигрируют через кожу, кровь, легкие и печень и, наконец, достигают брыжеечного венозного сплетения. Некоторые из яиц, откладываемых взрослыми самками, проходят через стенки венул, проходят через слизистую оболочку кишечника и выводятся с фекалиями. Затем яйца заражают своего промежуточного хозяина — улитки, Biomphalaria glabrata . Zymomonas mobilis , бактерия, в основном известная своей способностью производить биоэтанол и первоначально выделенная из алкогольных напитков, как сообщается, обеспечивает более 60% защиты от инфекции S.mansoni у мышей при пероральном введении в качестве лечебного средства (через 7 дней после заражения церкарией) [55]. Степень защиты определяли через 60 дней после заражения по количеству червей, извлеченных из печени мыши путем перфузии. Что касается гистопатологии, поражения (гранулемы) в печени и кишечнике были многочисленными и сходными в группах, получавших и не леченных. Яиц также было много в кишечнике, особенно в тощей и подвздошной кишке. Напротив, администрация Z.mobilis в качестве профилактического способа (за 7 дней до заражения) не защищал от инфекции, и, что еще хуже, сочетание профилактических и лечебных процедур усугубляло симптомы.
6. Другие паразиты
В отношении других эукариотических патогенов влияние пробиотиков в основном было зарегистрировано одной исследовательской группой, которая продемонстрировала потенциальное влияние L. casei ATCC 7469 на защиту от негутовых паразитов, таких как Babesia , Plasmodium или Trypanosoma (Баутиста с соавторами в Мексике).
Пероральное или внутрибрюшинное лечение L. casei ATCC 7469 у мышей, инфицированных Babesia microti (серый штамм), значительно снизило паразитемию, возможно, за счет стимуляции врожденной иммунной системы [56]. Защитный ответ улучшился, когда лактобациллы вводили за 3 дня до заражения паразитом или в тот же день, по сравнению с 7 днями ранее. Поскольку при инфицировании B. bovis ранний врожденный ответ был приписан раннему появлению транскриптов IL-12 и -IFN в селезенке [57], было высказано предположение, что L.casei может усилить эту защитную реакцию. Молекулярный механизм в настоящее время исследуется путем тестирования низкомолекулярных и высокомолекулярных компонентов, выделенных из лактобацилл, на их способность вызывать ранний защитный иммунный ответ против B. microti [58].
L. casei ATCC 7469 также оказывает защитное действие против малярийного паразита Plasmodium chabaudi AS у мышей NIH [59]. L. casei усиливает неспецифическую устойчивость к P.chabaudi , с более длительными периодами препатирования (5 дней по сравнению с 4 днями у контрольных мышей), более короткими периодами патентования (8 дней по сравнению с 11 днями у контрольных мышей), сопровождающимся снижением паразитемии и жизнеспособности паразитов, выделенных из селезенки обработанных мышей. Концентрация оксида азота была увеличена (от 500% до 900%) в сыворотке мышей , обработанных L. casei , и было предложено придать защитный эффект против плазмодиальной инфекции.
Тот же пробиотический штамм также показал защитный эффект против Trypanosoma cruzi (штамм Ninoa), возбудителя болезни Шагаса у мышей NIH [60].Пероральные или внутрибрюшинные дозы лактобацилл за 7 дней до заражения паразитами показали значительное снижение паразитемии в течение следующих 50 дней. Вопрос о том, был ли иммунный ответ хозяина, который, как известно, стимулируется L. casei [61] и способен контролировать инфекции T. cruzi [62], был ответственным за этот защитный эффект, все еще обсуждается.
Наконец, сообщалось о положительном эффекте введения пробиотических дрожжей Saccharomyces boulardii (Ultra-levure) в сочетании с антибиотиками при остром амебиазе, вызванном Entamoeba histolytica , со значительным уменьшением продолжительности симптомов (диарея, лихорадка). , боль в животе) и наличие кист в стуле [63].
7. Постинфекционный синдром раздраженного кишечника
Синдром раздраженного кишечника (СРК) — это функциональное желудочно-кишечное расстройство, при котором боль в животе связана с дефекацией или изменением привычек кишечника при отсутствии органической причины [64]. Патофизиология СРК остается неясной, но общепринято считать, что симптомы возникают из-за дисфункции кишечника и включают изменение моторики в ответ на стимулы и сенсорное восприятие [65, 66]. Незначительное воспаление и активация иммунной системы — один из предполагаемых механизмов патогенеза СРК.Наиболее сильным признанным экологическим фактором риска развития СРК является бактериальный гастроэнтерит. Пациенты с постинфекционным СРК (ПИ-СРК) демонстрируют дисфункции, аналогичные таковым у пациентов с СРК. Поскольку гастроэнтерит нарушает кишечную микробиоту, было высказано предположение, что коррекция дисфункций кишечника с помощью комменсальной микробиоты может иметь терапевтический потенциал у пациентов с PI-IBS [65, 67, 68]. Кишечные паразиты, такие как Blastocystis hominis , Cryptosporidium parvum , Giardia lamblia , Entamoeba histolytica или нематода Trichinella spiralis , могут вызывать симптомы, подобные СРК, а также могут играть возможную роль в этиологии СРК [ 66, 69, 70].Потенциал пробиотиков в лечении симптомов, подобных СРК, связанных с паразитарной инфекцией, мало изучен. Надежные исследования получены на модели T. spiralis на мышах NIH Swiss, которая показывает сходство с PI-IBS [65]. Взрослые черви и личинки вызывают функциональные изменения (воспалительный ответ, усиление перистальтики кишечника, рост гладких мышц и изменение выработки слизи), которые сохраняются не менее 3 недель после изгнания паразита. Ни один из протестированных пробиотиков не вводился перорально ( Lactobacillus paracasei NCC2461, L.johnsonii NCC533 (LA1), Bifidobacterium longum NCC2705 и B. lactis NCC362) препятствовали выселению паразитов. Однако был измерен штамм-специфический эффект на стойкую гиперсокращаемость мышц, наблюдаемую в этой модели после выздоровления от инфекции: только L. paracasei ослабляет постинфекционную гиперсокращаемость. Положительный эффект коррелирует с модуляцией иммунологического ответа на паразита и / или прямым или косвенным действием L.paracasei на гиперсокращаемость мышц. Защитная активность также присутствует в супернатанте культуры L. paracasei и является термолабильным, что указывает на то, что это, вероятно, секретируемый метаболит. Эффекты L. paracasei были дополнительно исследованы с использованием изящного метаболомного подхода, основанного на ЯМР [71]. T. spiralis -инфицированные мыши показали измененные метаболические профили, которые были связаны с повышенной сократимостью кишечника, мышечной гипертрофией и нарушением функций тощей кишки. Обработка L. paracasei нормализовала мышечную активность и нарушенный энергетический обмен. Авторы пришли к выводу, что лечение L. paracasei может быть полезным у пациентов с PI-IBS.
В модели мышей с дефицитом Т-клеточного рецептора гнотобиотов, C. parvum вызывает стойкую инфекцию, а также IBS-подобные поражения в слепой кишке. Когда эти мыши были предварительно колонизированы L. reuteri , а затем заражены C. parvum , было обнаружено меньше паразитов и уменьшились связанные с ними гиперплазические и воспалительные поражения [23, 70].
Хотя клинические доказательства эффективности начинают появляться, общее влияние пробиотиков на лечение PI-IBS остается предметом серьезных дискуссий. В основном это связано с трудностью сравнения исследований из-за различий в дизайне экспериментов, дозах пробиотиков и штаммах, а также в ответственных агентах [67, 68, 72–74].
8. Лечение пробиотиками, новая терапевтическая стратегия при паразитарных заболеваниях?
Вышеупомянутые исследования сводятся к положительному эффекту пробиотиков для борьбы с паразитарными инфекциями и указывают на штамм-специфический пробиотический эффект.Пока мало что известно о клеточных или молекулярных механизмах, поддерживающих эти эффекты. Пока что экспериментальные исследования Cryptosporidium , Giardia или Eimeria являются единственными, которые подтверждают пробиотическое действие через секрецию активного начала, которое может ингибировать развитие паразитов, хотя молекулярная природа этих компонентов остается неизвестным. Также были предложены пробиотики для воздействия на микрофлору кишечника и развитие иммунного ответа.Однако лежащие в основе механизмы не ясны, включая стимуляцию различных подмножеств клеток иммунной системы для выработки цитокинов, которые, в свою очередь, играют роль в индукции и регуляции иммунного ответа, а также в усилении кишечных иммунных ответов IgA и увеличении выработки кишечного муцина ( обзор см. в [75]). L. johnsonii LA1, Lactobacillus штамм GG или Bifidobacterium lactis Bb12, как было показано, модулируют иммунные ответы IgA [75], тогда как L.rhamnosus GG увеличивает продукцию муцина в кишечнике [76]. Эти действия могут повысить очищение кишечника от паразитов, таких как Giardia , и могут объяснить защиту in vivo, обеспечиваемую некоторыми пробиотиками [31]. Сходным образом было показано, что IL-10 и секреторный IgA-ответ, важные участники эффективного иммунного ответа против Cryptosporidium , индуцируются некоторыми пробиотическими штаммами [77]. Даже если прямая связь между введением пробиотиков, индукцией иммунных эффекторов и уничтожением паразитов еще четко не установлена, это кажется весьма вероятным.
Предложение пробиотиков в качестве альтернативы классическим методам лечения, таким как лекарства или вакцины, от паразитов кажется неразумным; дополнительный терапевтический подход для снижения риска заражения или сохранения классических методов лечения кажется более реалистичным. На данный момент исследования воздействия пробиотиков на паразитов все еще находятся в зачаточном состоянии, и необходимы дальнейшие исследования, чтобы двигаться вперед в этом направлении. Также необходимо обратить внимание на несколько важных моментов.
Используемые пробиотики должны быть точно охарактеризованы на уровне штамма.
Необходимо приложить усилия для стандартизации протоколов в каждой модели (введение, доза, время и т. Д.). Отсутствие пробиотического эффекта на криптоспоридиоз действительно наблюдалось при коротком предварительном лечении пробиотиком (2 дня) или при сопутствующем контакте с пробиотиком и патогеном [25, 26] в отличие от более длительного предварительного лечения (13 дней [21, 22]). Но длительная иммуностимуляция эффекта не усиливает. У здорового субъекта нельзя легко получить сильную активацию иммунной системы, потому что постоянная стимуляция антигеном может оказывать негативное воздействие на хозяина, включая аутоиммунитет [9].
Необходимо провести дополнительные исследования, объединяющие большее количество патогенов, а также соответствующие им модели хозяина / животного с большим разнообразием пробиотиков (по отдельности или в комбинации).
Другой фактор изменчивости, который необходимо учитывать, — это микрофлора кишечника экспериментальных моделей животных. Хотя очевидно, что генетический фон животных важен, факторы окружающей среды, такие как условия гигиены, качество корма и стресс, также могут влиять на устоявшуюся микрофлору, влияя на результаты исследований [78].Чтобы преодолеть такие внутренние вариации, необходимы модели с идентичным генетическим фоном (инбредный штамм) и контролируемой микрофлорой, которые подвергаются одинаковому питанию. Упрощенные модели, такие как животные-гнотобиоты (мыши с определенной микрофлорой), являются бесценным инструментом для изучения воздействия кишечных микроорганизмов в качестве пробиотиков на хозяина [5]. Было бы также интересно наблюдать за установлением пробиотиков в кишечнике и их влиянием на устоявшуюся микрофлору.
Для правильного проектирования будущих методов лечения пробиотиками необходимо глубокое понимание молекулярных механизмов, поддерживающих действие пробиотиков.Поскольку пробиотики могут убивать патогены посредством секреции, ингибировать их адгезию или инвазию, инактивировать токсины или конкурировать за питательные вещества, большинство исследований было сосредоточено на кишечных патогенах с гипотезой о локальной эффективности пробиотиков. Но исследования in vivo нематогенных патогенов ( Plasmodium , Trypanosoma , Babesia и т. Д.) Подтверждают отдаленный эффект, обеспечиваемый пробиотиками, вероятно, за счет неспецифической иммунной стимуляции. Во всех случаях необходимо приложить немало усилий для выяснения механизма действия многообещающих организмов.
9. Заключение
Появляется концепция о том, что пробиотики могут контролировать развитие эукариотических патогенов. Терапевтические подходы с пробиотиками могут помочь снизить риск заражения конкретными паразитами или дополнить классические антипаразитарные методы лечения. Лучшее понимание молекулярных механизмов, лежащих в основе положительного воздействия пробиотиков на паразитарную инфекцию, необходимо для проверки правильности этого подхода. Таким образом, необходимы дальнейшие более глубокие исследования с использованием более определенных протоколов (конкретные пробиотики и экспериментальные модели), а также расширенные клинические исследования.Гнотобиотики, генотип и микробный статус которых можно четко определить, а также диету и условия окружающей среды, которые можно легко контролировать, могут стать бесценным инструментом для продвижения в этом направлении.
Сокращения
| IBS: | Синдром раздраженного кишечника |
| PI-IBS: | Постинфекционный IBS. |
Благодарности
Это исследование было поддержано программой CNRS MIE и программой Muséum National d’Histoire Naturelle (ATM microorganismes).М. А. Траверс был поддержан грантом региона Иль-де-Франс и стипендиатом Национального музея истории.
Влияние инфекции Enterobius vermicularis и лечения мебендазолом на кишечную микробиоту и иммунный ответ хозяина
Аннотация
Фон
Предыдущие исследования связи энтеробиоза и хронических воспалительных заболеваний показали противоречивые результаты. Взаимодействие инфекции Enterobius vermicularis , в частности, с кишечной микробиотой и индуцированными иммунными ответами, никогда тщательно не исследовалось.
Методология / выводы
Чтобы ответить на вопрос, может ли воздействие острицы и мебендазола изменить микробный состав кишечника и иммунные реакции, мы набрали 109 (30 отрицательных по острицам, 79 инфицированных острицами) детей первого и четвертого классов начальной школы в Тайчжуне, Тайвань. для исследования микробиома кишечника и анализа кишечных цитокинов и SIgA. У лиц, инфицированных острицами, образцы фекалий собирали снова через 2 недели после введения 100 мг мебендазола.Разнообразие кишечной микробиоты увеличилось после инфицирования Enterobius и достигло пика после введения мебендазола. На уровне филума инфекция остриц и дегельминтизация мебендазолом были связаны со снижением относительной численности Fusobacteria и увеличением доли Actinobacteria . На уровне рода относительная численность пробиотика Bifidobacterium увеличивалась после лечения энтеробиозом и мебендазолом. Уровень SIgA в кишечнике был ниже в группе, инфицированной острицами, и был повышен в половине группы, получавшей мебендазол.Более высокая доля предварительной обработки Salmonella spp . ассоциировался с отсутствием увеличения SIgA после дегельминтизации мебендазолом.
Выводы / Значение
Воздействие острицы в сочетании с мебендазолом в детстве связано с увеличением бактериального разнообразия, увеличением численности актинобактерий , включая пробиотик Bifidobacterium , и уменьшением доли фузобактерий . Уровень SIgA кишечника был ниже в группе, инфицированной острицами, и повышался у половины пациентов после лечения мебендазолом.
Информация об авторе
Может ли инфекция остриц у человека в сочетании с лечением от гельминтов мебендазолом изменить микробиоту кишечника до состава, который полезен для хозяина и повлияет на его иммунный ответ слизистых оболочек, в настоящее время неясно. В когорте из 109 детей младшего школьного возраста мы обнаружили, что инфекция Enterobius vermicularis связана с повышенным микробным разнообразием кишечника, пониженной относительной численностью Fusobacteria и повышенной долей Actinobacteria , включая пробиотик Bifidobacterium .Было обнаружено, что дегельминтизация мебендазолом коррелирует с дальнейшим увеличением бактериального разнообразия. Однако более низкие уровни SIgA кишечника были обнаружены в группе, инфицированной острицами, и они были увеличены только у половины субъектов после лечения мебендазолом.
Образец цитирования: Ян C-A, Liang C, Lin C-L, Hsiao C-T, Peng C-T, Lin H-C, et al. (2017) Влияние инфекции Enterobius vermicularis и лечения мебендазолом на кишечную микробиоту и иммунный ответ хозяина.PLoS Negl Trop Dis 11 (9): e0005963. https://doi.org/10.1371/journal.pntd.0005963
Редактор: Македонка Митрева, Школа общественного здравоохранения Вашингтонского университета, США
Поступила: 17 мая 2017 г .; Принята к печати: 13 сентября 2017 г .; Опубликовано: 25 сентября 2017 г.
Авторские права: © 2017 Yang et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все данные о последовательностях и информация об образцах доступны в базе данных NCBI SRA: https://www.ncbi.nlm.nih.gov/Traces/study/?acc=SRP102265.
Финансирование: Эта работа была частично поддержана больницей Китайского медицинского университета (http://www.cmuh.cmu.edu.tw/), грант DMR-105-122 и Министерством науки и технологий (MOST), Тайвань, грант 106-2314-B-039-047-MY3 (https://www.most.gov.tw/). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Данные обратной эпидемиологии паразитозов и аутоиммунных заболеваний привели к гипотезе о том, что воздействие паразитов в детстве может иметь защитный эффект от развития аллергии и аутоиммунитета [1]. Иммуномодулирующая роль гельминтов хорошо изучена, и некоторые компоненты гельминтов могут регулировать иммунную систему [2, 3]. Enterobius vermicularis (человеческая острица) — наиболее распространенный паразит, встречающийся в развитых странах, и был предложен в качестве хорошего кандидата для проверки связи между «гигиенической гипотезой» и заболеванием [4]. На Тайване энтеробиоз выявляется примерно у 0,6–3% детей младшего школьного возраста [5, 6]. Предыдущее исследование с использованием перианальных тестов и анкет с участием детей начальной школы в Тайбэе показало отрицательную корреляцию между инфекцией остриц и аллергическими заболеваниями дыхательных путей [7].Аналогичным образом было обнаружено, что энтеробиоз связан со снижением риска аллергического свистящего дыхания у турецких детей школьного возраста [8]. Однако крупное популяционное когортное исследование по сбору данных о назначении мебендазола и хронических воспалительных заболеваниях в Дании показало, что энтеробиоз не снижает риск астмы, диабета 1 типа (СД 1 типа), артрита или воспалительного заболевания кишечника (ВЗК) [9]. . В этих вышеупомянутых отчетах отсутствовали механистические исследования и не изучалось взаимодействие между острицами и кишечной микробиотой.
Дисбаланс провоспалительных и противовоспалительных кишечных бактерий или дисбактериоз связан с аутоиммунными заболеваниями, такими как СД 1 типа, ВЗК, ревматоидный артрит (РА), а также с провоспалительными состояниями, такими как ожирение, атеросклероз и толстая кишка. рак [10–12]. Поскольку паразиты и кишечные комменсальные бактерии обитают в одной среде, взаимодействие между этими двумя микроорганизмами возможно. Сообщалось, что у людей гельминтозы могут увеличивать разнообразие кишечных бактерий и изменять состав микробиоты [13–15].Предполагается, что микробиота кишечника вызывает ответы Т-хелперов типа 1 (Th2) у инфекций Trichuris muris у мышей, а Schistosoma mansoni , как предполагается, вызывает Th2-опосредованное воспаление и образование гранулем через изменение микробиоты [16, 17]. Кроме того, сообщалось, что защитный иммунный ответ слизистой оболочки против Toxoplasma gondii обеспечивается микрофлорой кишечника, которая стимулирует дендритные клетки [18]. Недавно Раманан и др. . сообщили, что гельминтозы могут восстанавливать количество бокаловидных клеток за счет подавления кишечных провоспалительных видов Bacteroides и, таким образом, защищать генетически восприимчивых мышей от развития болезни Крона [19].Следовательно, чистый иммуномодулирующий эффект острицы на человека может зависеть от его взаимодействия с кишечной микробиотой этого человека.
В этом исследовании мы изучили влияние воздействия Enterobius на состав микрофлоры кишечника, а также изучили взаимодействие между острицами, микробиотой и иммунными ответами хозяина в предполагаемой когорте из 109 детей младшего школьного возраста. Наблюдая за различиями в численности пробиотических бактерий и изменениями в кишечнике уровней защитного секреторного IgA (SIgA), мы выдвинули гипотезу о возможных корреляциях воздействия остриц и мебендазола с воспалительным статусом кишечника.
Методы
Заявление об этике
Когорта исследования состояла из 109 детей младшего школьного возраста (1 -й и 4 -й классы), которые прошли скрининг на остриц в 2015 году, Тайчжун, Тайвань. Исследование было одобрено Комитетом по этике исследований больницы Китайского медицинского университета (CMUh204-REC1-115). Письменное информированное согласие было получено от родителей.
Дизайн исследования
В общей сложности 30 детей дали отрицательный результат на энтеробиоз, а 79 детей дали положительный результат при скрининге анальной ленты.У детей с положительными результатами анальной ленты острицы дополнительные образцы стула собирали в пробирки для концентрации яйцеклеток с наконечником, окрашивали и фиксировали свежеприготовленным мертиолат-йодформальдегидом (MIF). После дальнейшего смешивания с этилацетатом и центрифугирования при 1500 об / мин в течение 5 минут отложения тщательно исследовали под световым микроскопом, чтобы обнаружить наличие коинфицированных яиц гельминтов или простейших, как описано ранее [20]. Образцы стула были снова собраны у 65 инфицированных острицами людей через 2 недели после лечения 100 мг мебендазола, которые подверглись MIF-микроскопическому исследованию и секвенированию гена 16s рРНК.Мы не обнаружили коинфекции другими гельминтами или простейшими с помощью метода MIF-концентрация-седиментация в образцах остриц (+) до и после лечения мебендазолом (Таблица 1). Как показано на блок-схеме (S1 Рис.), Метагеномический анализ был проведен на 30 образцах остриц (-), 65 парных остриц (+) мебендазола (-) и остриц (+) мебендазола (+).
Извлечение ДНК и секвенирование генов
образцов стула были собраны дома и доставлены в нашу лабораторию в течение 3 часов во льду и помещены в пробирки Transwab (Sigma, Дорсет, Великобритания).Экстракцию ДНК проводили с использованием набора QIAamp DNA Stool Mini Kit (Qiagen, Калифорния, США). Праймеры для ПЦР F515 (5’-GTGCCAGCMGCCGCGGTAA-3 ’) и R806 (5’-GGACTACHVGGGTWTCTAAT-3’) были разработаны для амплификации домена V4 бактериального гена 16S рибосомной РНК, как описано ранее [21]. Последовательность адаптера Nextera (Illumina, Калифорния, США) добавляли к 5’-концу набора праймеров для подготовки библиотеки. ПЦР с использованием 50 ~ 150 нг ДНК выполняли с 1 циклом 98 ° C в течение 30 секунд, 30 циклами 98 ° C в течение 10 секунд, 60 ° C в течение 30 секунд, 72 ° C в течение 30 секунд и конечным продлением 72 ° C в течение 5 мин.Ампликоны очищали с использованием гранул AMPure XP (Beckman Coulter, Индианаполис, США) и количественно определяли с помощью нанофотометра (IMPLEN, München, Германия). Для создания библиотеки использовали набор Illumina Nextera Index Primer. Качество и количество очищенных библиотек проверяли электрофорезом в 2% агарозном геле, методами Qubit (Thermo Fisher Scientific, Массачусетс, США) и количественной ПЦР. Наконец, библиотеки были нормализованы до той же концентрации и секвенированы секвенатором Illumina Miseq.
Биоинформатический анализ данных секвенирования гена 16S рРНК
FASTX-Toolkit (http: // hannonlab.cshl.edu/fastx_toolkit) использовался для обработки файлов сырых данных чтения. Качество последовательностей проверяли в 3 этапа: (i) минимально приемлемый показатель качества последовательностей Phred составлял 20 (с более чем 70% оснований последовательностей ≥ 20). (ii) После качественной обрезки хвоста последовательности были сохранены последовательности размером более 100 п.н. и последовательности с приемлемым показателем качества Phred, равным 20. (iii) чтения прямого и обратного секвенирования, которые отвечали первому и второму требованиям, сохраняли для последующих анализов.
UPARSE [22] был использован для создания кластеризации операционных таксономических единиц (OTU). Затем Bowtie2 [23] использовали для выравнивания OTU с последовательностями генов 16S рРНК бактерий. Эти последовательности были взяты из базы данных последовательностей рибосомных РНК SILVA (версия 115). После сбора данных о последовательностях последовательности экстрагировали с помощью прямого праймера V4 и обратного праймера. Чтобы предотвратить повторное назначение последовательностей, последовательности V4 из SILVA были затем сгруппированы в несколько кластеров с 97% -ным сходством с использованием UCLUST.Применялся стандарт 97% сходства с базой данных.
Кишечный SIgA и обнаружение цитокинов
Образцы фекалий взвешивали перед добавлением равных количеств стерильного PBS вместе с ингибитором протеиназы Пирса (Thermo Fisher Scientific). После тщательного перемешивания и центрифугирования при 10000 g в течение 10 минут фекальные супернатанты хранили при -80 ° C до анализа. Секреторный IgA в кале (SIgA) анализировали с использованием набора Immundiagnostik ELISA (Bensheim, Германия), уровни IL-1 и IL-4 измеряли с помощью наборов Quantikine ELISA (R&D Systems, Миннеаполис, США) в соответствии с инструкциями производителя.
Далее мы сгруппировали образцы по уровням SIgA, IL-1ß и IL-4. На основании обнаруженных средних уровней SIgA считался высоким при> 150 мкг / мл и низким при <80 мкг / мл; IL-1ß был высоким при> 10 пг / мл и низким при <0,5 пг / мл; и IL-4 был высоким при> 10 пг / мл и низким при <5 пг / мл. В парных образцах (собранных до и после лечения мебендазолом) уровень SIgA считался повышенным, учитывая увеличение более чем в 1,1 раза.
Статистический анализ
Процесс разрежения был применен для нормализации таблицы операционных таксономических единиц (OTU) после присвоения таксономии в биоинформатическом анализе.Было рассчитано альфа-разнообразие (индекс Шеннона, обратный индекс Симпсона и богатство). Были выполнены бета-разнесение с использованием взвешенных показателей расстояния UniFrac [24], анализа главных координат (PCoA) и неконтролируемой кластеризации. Процедура перестановки множественных ответов (MRPP) в «веганском» R-пакете (https://cran.r-project.org/web/package=vegan) была проведена для оценки разницы между сообществами в PCoA. Тест суммы рангов Вилкоксона использовался для сравнения непарных переменных (например, P- и P + M-), а знаковый ранговый критерий Вилкоксона использовался для сравнения парных переменных (например, P- и P + M-).g., P + M- v.s. П + М +). Дифференциально экспрессируемые бактерии были отфильтрованы по следующим критериям: (i) значение P <0,05 (ii) складчатость> 1,40 или <0,71 (iii) по крайней мере одна группа достигла средней относительной численности 0,5%. Были скорректированы половые и парные факторы. Для множественных групповых сравнений уровень ложного обнаружения (FDR) контролировался с помощью множественного теста FDR с поправкой Бенджамини-Хохберга (BH). Анализ обогащения пути был выполнен с использованием пакета R «Tax4Fun» [25]. Для расчета разницы в обогащении использовали тест ANOVA.U-тесты Манна-Уитни с использованием GraphPad Prism версии 5 были выполнены для сравнения фекальных цитокинов и уровней SIgA между группами. Для анализа парных данных SIgA стула до и после лечения мебендазолом использовали знаковый ранговый критерий Вилкоксона.
Результаты
Исследуемая популяция и характеристика кишечной микробиоты
Мы проанализировали влияние инфекции остриц на микробиом кишечника в когорте из 109 детей в первом или четвертом классе начальной школы. Эффекты степени и пола были незначительными среди групп (p = 0.650, p = 0,403 соответственно, таблица 1). В группе остриц (+) были собраны дополнительные образцы стула для выполнения процедуры осаждения с концентрацией MIF для выявления сопутствующей инфекции другими паразитами. Как показано в таблице 1, коинфекции не было обнаружено. В группе остриц (-) были зарегистрированы возможные мешающие факторы, включая преимущественно мясную диету, недавний (в течение этих 2 месяцев) гастроэнтерит, недавнюю инфекцию дыхательных путей при пероральном приеме лекарств и недавнее подтвержденное использование антибиотиков, а также анализ разнообразия кишечника. микробиота показала, что недавнее инфицирование дыхательных путей пероральными препаратами может снизить микробное разнообразие кишечника (таблица 1).Дальнейший дифференциальный анализ численности на уровне филума показал, что дети с недавней инфекцией дыхательных путей и пероральным лечением (8 из 10 могли использовать антибиотики) имели тенденцию коррелировать с относительно меньшей численностью Fusobacteria (0,01% ± 0,18% против 1,65%). % ± 4,62%, p = 0,03, FDR = 0,17). Информация о вышеупомянутых смешивающих факторах не была доступна в группе остриц (+).
Альфа-разнообразие группы остриц (+) мебендазола (+) было значительно выше, чем группы остриц (-) (обратный индекс Симпсона, p = 0.002), а альфа-разнообразие было лишь незначительно выше при сравнении микробного состава группы остриц (+) мебендазола (-) и группы остриц (-) (p = 0,061, рис. 1a). Анализ основных координат также показал значительную разницу в бета-разнообразии между 3 группами (группа остриц (+) мебендазола (+) и группа остриц (-), p = 0,001, рис. 1b).
Рис. 1. Сравнение сообществ кишечной микробиоты в группах лечения острицы и мебендазола.
а .Коробчатая диаграмма альфа-разнообразия (обратный индекс Симпсона) показана на уровне родов. **: p <0,01 по тесту ANOVA. P-: острица отрицательная, n = 30; P + M-: положительный результат на острицы до лечения мебендазолом, n = 65; P + M +: положительный результат на острицу после лечения мебендазолом, n = 65. b . Анализ основных координат взвешенного бета-разнообразия UniFrac между субъектами, окрашенного подгруппами сообщества. с . Распределение относительной численности бактерий по подгруппам сообщества и дифференциально выраженным типам.*: p <0,05 по критерию Краскела-Уоллиса.
https://doi.org/10.1371/journal.pntd.0005963.g001
Анализ операционных таксономических единиц (OTU) кишечного микробиома нашей когорты выявил следующие основные бактериальные типы: Bacteroidetes , Firmicutes , Proteobacteria , Актинобактерии , Веррукобактерии и Фузобактерии . Характер микробного распределения филума значительно различается по доле актинобактерий (острица (+) мебендазол (+) vs.острица (-), 1,08% ± 1,15% против 4,23% ± 5,52%, кратность = 2,56, P = 5,19 x 10 -4 , FDR = 0,012, рис. 1c) и Fusobacteria (острица (+) мебендазол ( +) против острицы (-), 0,04% ± 0,17% против 1,10% ± 3,82%, кратность = 0,04, P = 3,30 x 10 -3 , FDR = 0,012, рис. 1c).
Влияние инфекции остриц и лечения дегельминтизации мебендазолом на микробный состав кишечника
На уровне рода наблюдается тенденция к более высокой относительной численности Alistipes (кратность = 2.56, p = 0,008) и Faecalibacterium (кратность = 1,64, p = 0,004) и уменьшенная доля Fusobacterium (кратность = 0,18, P = 0,050), Veilonella (кратность = 0,25, p = 0,042) , Megasphaera (кратность = 0,28, p = 0,021) и Acidaminococcus (кратность = 0,56, p = 0,030) были обнаружены в группе остриц (+) мебендазола (-) по сравнению с группой остриц (-) ( Рис 2а). Однако все скорректированные значения p (FDR) для всех дифференциально распределенных таксонов были> 0.05. У 65 пациентов с острицами (+) мебендазолом (+) разнообразие кишечных бактерий еще больше увеличилось и коррелировало со значительно более многочисленными Collinsella (кратность = 3,04, p = 1,58 x 10 −4 , FDR = 0,028). , Streptococcus (кратность = 2,94, p = 1,32 x 10 −3 , FDR = 0,043), Blautia (кратность = 1,71, p = 1,22 x 10 −3 , FDR = 0,043), а также меньшая доля Suterrella (кратность = 0,30, p = 1,32 x 10 −3 , FDR = 0.043) по сравнению с микробным составом группы остриц (+) мебендазола (-), рис. 2б. Относительное количество пробиотика Bifidobacterium увеличилось после заражения острицами и стало еще выше в группе, получавшей мебендазол (острица (+) мебендазол (+) по сравнению с острицами (-), 7,32% ± 9,28% против 2,86% ± 3,67%, p = 1,97 · 10–3, FDR = 0,100, рис. 2а и 2б).
Рис. 2. Визуализация дифференциально экспрессируемых бактерий на уровне рода на вулканических участках.
Красные точки представляют важные таксоны, проанализированные с помощью теста суммы рангов Вилкоксона (острица (+) мебендазол (-) vs.острица (-)) и знаковый ранговый тест Вилкоксона (парная острица (+) мебендазол (+) vs. острица (+) мебендазол (-)). После корректировки значения p эти таксоны, оставшиеся значимыми (FDR <0,05), отображаются красным цветом, а виды бактерий с FDR> 0,05 — синим. Границы значительного кратного изменения и значения p критериев Вилкоксона показаны пунктирными линиями. Размер точки представляет собой среднюю относительную численность. а . Влияние инфекции острицы на микробиом кишечника. Было проведено сравнение между группой P + M- и группой P-. б . Влияние мебендазола на микробиом кишечника. Было проведено сравнение между группой P + M + и группой P + M-. P-: острица отрицательная, n = 30; P + M-: положительный результат на острицы до лечения мебендазолом, n = 65; P + M +: положительный результат на острицы после лечения мебендазолом, n = 65.
https://doi.org/10.1371/journal.pntd.0005963.g002
На уровне видов заражение острицами было связано с тенденцией к увеличению доли Faecalibacterium prausnitzii , Ruminococcus flavefaciens , Alistipes purtred Bifidobacterium longum и некультивируемые Oscillospira sp .(Рис. 3a, проценты и значения p показаны в таблице S1), а также тенденция к снижению относительной численности Acidaminococcus кишечник , Megasphaera elsdenii , Veillonella dispar и Fusobacterium varium (рис. 3b и таблица S1 ). Относительная численность Faecalibacterium prausnitzii и Ruminococcus flavefaciens была ниже, тогда как доля Bifidobacterium longum и некультивируемых Oscillospira sp была ниже.были выше после дегельминтизации мебендазолом (рис. 3а, таблица S1). Дегельминтизация мебендазолом не была связана с увеличением относительной численности Acidaminococcus Кишечник , Megasphaera elsdenii , Veillonella dispar и Fusobacterium varium по сравнению с группой остриц (+) мебедазола (-).
Рис. 3. Изменения в соотношении видов кишечных бактерий после заражения острицами или дегельминтизации мебендазолом.
а .После заражения острицами количество бактерий увеличилось. б . После заражения острицами количество бактерий уменьшилось. с . После дегельминтизации мебендазолом количество бактерий увеличилось. ***: p <0,001, **: p <0,01, *: p <0,05 по критерию суммы рангов Вилкоксона (P- против P + M-, P- против P + M +) или по критерию знаковых рангов Вилкоксона (P + M- против P + M +, в паре). Столбики представляют собой среднее значение ± стандартная ошибка среднего.
https://doi.org/10.1371/journal.pntd.0005963.g003
Кроме того, как показано на рис. 3c, относительная численность Collinsella aerofaciens и Streptococcus thermophilus существенно не изменилась после заражения острицами; однако увеличение доли этих 2 видов было обнаружено через 2 недели после дегельминтизации мебендазолом ( Collinsella aerofaciens : острица (+) мебендазол (+) vs.острица (+) мебендазол (-), 3,07% ± 5,52% против 1,00% ± 2,00%, кратность = 3,08, p = 9,18 x 10 -5 , FDR = 0,034; Streptococcus thermophiles : острица (+) мебендазол (+) против острицы (+) мебендазол (-), 0,89% ± 2,04% против 0,31% ± 0,42%, кратность = 2,93, p = 0,003, FDR = 0,158, рис. 3в).
Обогащение микробиома за счет заражения острицами и лечения мебендазолом
Обогащенный анализ на основе таксономических аннотаций показал, что численность грамположительных и эндоспорообразующих бактерий была увеличена в группе остриц (+) мебендазола (+) по сравнению с группой остриц (-) (p = 0.0001 и p = 0,001 соответственно, S2a и S2b (рис.). Дальнейший анализ обогащения путей показал, что обогащенный микробиом кишечника, включающий путь всасывания и переваривания жира (ko04975), был связан с инфекцией острицы (острица (+) мебендазол (-) по сравнению с острицей (-), кратность = 2,49, p = 0,014, S2c Рис. ), и статистическая значимость оставалась при сравнении микробиоты группы, получавшей мебендазол, с группой, не инфицированной острицами (кратность = 2,54, p = 0,007, S2c, фиг.). Кроме того, было обнаружено, что воздействие острицы и мебендазола коррелирует с обогащением микробиома кишечника, включая путь удлинения жирных кислот (ko00062, острица (+), мебендазол (+) vs.острица (-), fold = 2,01, p = 0,001, S2d рис.) и путь метаболизма кофеина (ko00232, острица (+) мебендазол (+) по сравнению с острицами (-), кратность = 2,04, p = 0,002, S2e рис). .
Связь фекального SIgA и уровней цитокинов с инфекцией остриц и численностью кишечных бактерий
Для анализа влияния воздействия Enterobius на иммунный ответ кишечника хозяина были собраны образцы стула от неинфицированных острицами, инфицированных острицами и нелеченых, инфицированных острицами и обработанных групп и измерены их SIgA, IL-1ß и IL. -4 уровня.Было обнаружено, что инфекция острицы связана со значительным снижением уровней SIgA кишечника (средний уровень в группе неинфицированных и остриц (+) мебендазола (-): 125,59 мкг / мл против 109,56 мкг / мл, p <0,01, рис. 4a) . Количество фекальных IL-1β и IL-4 было одинаковым до и после заражения острицами (рис. 4b и 4c).
Рис. 4. Связь уровней SIgA / цитокинов с инфекцией остриц и с относительной численностью кишечных бактерий.
а . Фекальный SIgA, b .фекальный IL-1ß и c . уровни IL-4 в фекалиях в группах P-, P + M- и P + M +. **: p <0,01 по U-критерию Манна-Уитни. Линии представляют собой медианы. г . Корреляция относительной численности Prevotella с уровнями SIgA в кишечнике и корреляция относительной численности Collinsella в группе P (низкий SIgA: <80000 нг / мл, n = 5; средний-высокий SIgA: ≥ 150000 нг / мл, n = 22; низкий уровень ИЛ-4: <5 пг / мл, n = 12, средний-высокий: ≥5, n = 11). Столбики представляют собой среднее значение ± стандартная ошибка среднего. *: р <0.05, **: p <0,01 по критерию суммы рангов Вилкоксона с поправкой на следующие факторы: недавний гастроэнтерит и недавняя инфекция дыхательных путей при пероральном приеме лекарств.
https://doi.org/10.1371/journal.pntd.0005963.g004
Кроме того, уровни SIgA и цитокинов в кале были сгруппированы на низкие, средние и высокие, как описано в разделе «Методы». В группе остриц (-) были собраны возможные смешивающие факторы, такие как недавний гастроэнтерит и инфекция дыхательных путей при пероральном приеме лекарств; и в этой группе корреляционные исследования уровней SIgA и цитокинов с кишечными микробными таксонами выявили связь более высокой доли Prevotella со сниженным количеством кишечного SIgA (относительное содержание Prevotella в SIgA средне-высокое по сравнению сSIgA низкий, 6,22% ± 2,97% против 26,46% ± 11,52%, p = 0,006 (с поправкой на факторы респираторной и желудочно-кишечной инфекции), рис. 4d), и связь более высокого содержания Collinsella со сниженным количеством кишечного IL- 4 (относительное содержание Collinsella в IL-4 средне-высокое по сравнению с низким IL-4, 0,36% ± 0,21% против 1,69% ± 0,84%, p = 0,043 (с поправкой на факторы респираторной и желудочно-кишечной инфекции), рис. 4d ).
Микробиота, связанная с повышением уровня SIgA после лечения мебендазолом
После дегельминтизации мебендазолом количество кишечного SIgA увеличилось только у половины лечившихся субъектов (рис. 5а).Затем мы исследовали микробный состав фекалий в образцах, обработанных мебендазолом, с восстановлением SIgA и без него. До дегельминтизации мебендазолом группа без повышенного SIgA была связана с более высокой долей кишечного патогена Salmonella (без повышения SIgA по сравнению с группой с повышенным SIgA, 1,40% ± 3,21% против 0,18% ± 0,45%, p = 0,012, рис. 5b) и более низкое содержание комменсала Klebsiella по сравнению с группой с повышенным SIgA (0,00% ± 0,00% против 0,74% ± 2.84%, p = 0,010, рис. 5б). Кроме того, дегельминтизация мебендазолом была связана с повышенным процентным содержанием Bifidobacterium и Streptococcus в образцах с повышенным уровнем SIgA (P + M + против P + M-, Bifidobacterium : 9,96% ± 12,53% против 5,83% ± 8,47%). , p = 0,037; Streptococcus : 1,58% ± 3,23% против 0,27% ± 0,35%, p = 0,004, рис. 6a), а также пониженная относительная численность Salmonella у субъектов без увеличения SIgA (P + M + по сравнению с P + M-, 0,12% ± 0,48% по сравнению с1,40% ± 3,21%, p = 0,010, рис. 6б). Связанное с мебендазолом дегельминтизация увеличение доли Collinsella наблюдалось как в группах с повышенным уровнем SIgA, так и в группе без повышения уровня SIgA (P + M + по сравнению с P + M-, группа с повышенным SIgA: 2,08% ± 3,43%). против 0,43% ± 0,69%, p = 0,002; группа без увеличения SIgA: 3,71% ± 5,95% против 1,38% ± 2,43%, p = 0,018, рис. 6a и 6b).
Рис. 5. Различия в микробном составе кишечника в группах с повышенным и не повышенным SIgA.
а .48 парных образцов фекалий остриц (+), мебендазола (-) и остриц (+), мебендазола (+) были оценены на уровень SIgA. 24 субъекта показали увеличение SIgA более чем в 1,1 раза после дегельминтизации мебендазолом (группа с повышенным SIgA, отмечена красным), а остальные 24 субъекта попали в группу без увеличения SIgA (отмечены черным). б . График вулкана, показывающий дифференциально экспрессируемые бактерии на уровне рода, сравнивающий необработанные, инфицированные острицами P + M- образцы группы без увеличения SIgA и образцы P + M- группы с повышенным SIgA.Значимые микробы, проанализированные с помощью теста суммы рангов Вилкоксона, показаны красными точками. Границы значительного изменения кратности и значения p показаны пунктирными линиями. Размер точки представляет собой среднюю относительную численность.
https://doi.org/10.1371/journal.pntd.0005963.g005
Рис. 6. Сдвиги микробиоты кишечника после дегельминтизации мебендазолом в группах с повышенным уровнем SIgA (а) и без повышения уровня SIgA (b).
Дифференциально экспрессируемые роды бактерий при сравнении образцов P + M + с образцамиОбразцы P + M- показаны на графиках вулканов.
https://doi.org/10.1371/journal.pntd.0005963.g006
На уровне видов более высокая доля Salmonella enterica была отмечена в образцах до обработки группы без увеличения SIgA (кратность = 7,81, p = 0,012), и она уменьшилась после дегельминтизации мебендазолом (кратность = 0,08, p = 0,010) (S3a и S3b, рис.). Связь повышенной относительной численности пробиотических бактерий Streptococcus thermophilus и Bifidobacterium longum с дегельминтизацией мебендазолом была обнаружена только в группе с повышенным уровнем SIgA ( Streptococcus thermophilus : раз = 5.84, р = 0,006; Bifidobacterium longum : кратность = 1,67, p = 0,046, S3c (рис.).
Обсуждение
Мы изучили влияние инфекции Enterobius vermicularis и эффект дегельминтизации мебендазолом на микробный состав кишечника и иммунные ответы слизистых оболочек у 109 детей младшего школьного возраста. И энтеробиоз, и дегельминтизация мебендазолом были связаны с изменением кишечного микробиома.
В соответствии с предыдущим исследованием микробиоты, инфицированной гельминтами [14], инфекция остриц в нашем исследовании была связана с увеличением разнообразия кишечных бактерий.Кроме того, сообщалось, что анкилостомоз у людей с глютеновой болезнью может не только увеличить микробное богатство кишечника, но и регулировать воспаление, вызванное глютеном [26]. Мы не проводили испытания инфекции острицами на людях с хроническими воспалительными заболеваниями. Однако в нашем исследовании мы обнаружили, что Enterobiasis был связан с повышенной относительной численностью видов Faecalibacterium prausnitzii и видов Alistipes . Было показано, что Faecalibacterium prausnitzii недостаточно представлен в кишечнике пациентов с ВЗК, СД 2 типа и ожирением; а Alistipes spp .сообщается, что он чрезмерно представлен у пациентов с синдромом раздраженного кишечника (СРК), сообщающих о боли в животе, и у депрессивных людей, что предполагает возможную роль в нарушении серотонинергической системы кишечника [10, 27–31]. Провоспалительная роль Alistipes spp . остается спекулятивным. Что касается бактериальных таксонов, которые показали более низкий процент после заражения острицами, оба Veillonella spp . и Fusobacterium spp . предположительно коррелируют с провоспалительными состояниями, такими как язвенный колит и рак толстой кишки, и Veillonella dispar и Fusobacterium varium были обнаружены при карциноме толстой кишки в аденоме [32–34].Способствует ли вид бактерий, измененных острицами, противовоспалительному профилю, требует дальнейших исследований.
Энтони и др. . (2007) отметили, что основным иммунным ответом, вызываемым против гельминтозной инфекции, является ответ типа Th3, состоящий из экспансии Th3-хелперных Т-клеток, эозинофилов, тучных клеток, базофилов, повышенного уровня IgE, IL-4 и других цитокинов, включая IL- 5 и Ил-13 [2]. Предыдущее исследование детей в центральной Греции показало, что реакция на остриц, ориентированная на Th3-тип, основана на повышенных сывороточных уровнях IgE и катионного белка эозинофилов (ECP) [35].Однако мы не обнаружили различий в уровнях ИЛ-4 в кале среди групп остриц (-), остриц (+) мебендазола (-) и остриц (+) мебендазола (+). В нашем исследовании было обнаружено, что дегельминтизация мебендазолом связана с увеличением доли Collinsella . Интересно, что в группе остриц (-) после коррекции возможных сопутствующих факторов, включая недавний гастроэнтерит и респираторную инфекцию с помощью пероральных препаратов (и возможное использование антибиотиков), была обнаружена обратная корреляция между численностью Collinsella и уровнем IL-4 в кишечнике.Необходимы дополнительные исследования на стерильных животных, чтобы оценить влияние острицы и мебендазола на уровни кишечника Collinsella и IL-4.
IL-1ß — еще один цитокин, который может изменяться паразитами, и его сверхактивация связана с хроническими воспалительными заболеваниями [36]. Чтобы установить хронический характер инфекции, мышиный гельминт Heligmosomoides polygyrus bakeri (Hp) подавлял реакцию хозяина на IL-4, способствуя выработке IL-1ß [37].Напротив, паразит Fasciola hepatica , как было установлено, непосредственно ингибирует секрецию хозяина IL-1ß [38]. Мы обнаружили, что одна только инфекция острицы существенно не изменяет фекальный IL-1ß.
Основным иммуноглобулином, участвующим в борьбе с кишечной микробной инфекцией и поддержании гомеостаза слизистой оболочки с помощью комменсальных бактерий, является SIgA, который опосредует противовоспалительные функции через множество механизмов [39]. Недостаток SIgA также может вызывать воспалительные заболевания [40, 41]. Сообщалось, что колонизация Bacteroides thetaiotaomicron у мышей повышает уровни SIgA за счет притока IgA-продуцирующих B-клеток и увеличения полимерного рецептора иммуноглобулина (pIgR), который опосредует транспорт IgA через эпителий [42]. В этом исследовании было обнаружено, что инфекция остриц коррелирует с более низким уровнем SIgA в кишечнике. Кроме того, было обнаружено, что количество кишечного SIgA отрицательно связано с относительной численностью Prevotella . Неясно, влияет ли это взаимодействие острицы и микробов на продукцию SIgA в кишечнике.Следует отметить, что после лечения дегельминтизацией мебендазолом уровни SIgA повысились у половины пациентов, инфицированных острицами. Мы заметили, что кишечный патоген Salmonella enterica был чрезмерно представлен в группе без увеличения SIgA по сравнению с группой с повышенным SIgA. Хотя относительная доля Salmonella enterica была ниже после дегельминтизации мебендазолом в образцах без увеличения SIgA, увеличение пробиотических видов Streptococcus thermophilus и Bifidobacterium longum после лечения мебендазолом наблюдалось только в группе с повышенным SIgA. .Наши результаты предполагают, что относительное количество Salmonella может иметь отрицательный эффект на вызванное мебендазолом дегельминтизацию увеличение количества SIgA и пробиотических видов в кишечнике.
Мебендазол — это классический противоглистный препарат, который хорошо переносится [43] и обычно назначается детям школьного возраста с положительной реакцией на острицы. В датском исследовании инфекции остриц и риска хронических воспалительных заболеваний даже использовался анамнез лечения мебендазолом в качестве суррогата для диагноза энтеробиоза [9].Результаты нашего исследования показывают, что повышенный процент известных видов пробиотиков, Streptococcus thermophilus , и другой противовоспалительной бактерии, Collinsella aerofaciens [44], может быть связан с дегельминтизацией мебендазолом, но не только с инфекцией острицы. Наше исследование ограничено тем, что мы не использовали анальную ленту, более чувствительный метод обнаружения яиц остриц, чем осаждение с концентрацией MIF, для оценки эффективности дегельминтизации мебендазолом. Однако Wang CC et al. .сообщается в J Microbiol Immunol Infect . 2009 г., что эффективность лечения мебендазолом в искоренении острицы у детей начальной школы в Тайчжуне, Тайвань, составила 96% [6]. Мебендазол обладает противовоспалительной, антиангиогенезной и онкоген-супрессивной активностями на мышиной модели инициации рака толстой кишки [45]. Прямое влияние мебендазола на состав микробиоты кишечника еще предстоит исследовать. Анализ путей обогащения микробиома в нашем исследовании показал, что увеличение процента микробов, участвующих в метаболизме удлинения жирных кислот и кофеина после заражения острицами, стало значительным только при сравнении остриц (+) мебендазола (+) группа и группа остриц (-).Необходимы дальнейшие исследования метаболомики, чтобы оценить, может ли лечение острицы и мебендазолом изменить метаболизм комменсальных бактерий и впоследствии повлиять на иммунную систему хозяина.
В нашем исследовании изменение микробного состава, обнаруженное через две недели после введения мебендазола детям, инфицированным острицами, могло быть связано с поздними проявлениями энтеробиоза. Более крупное проспективное когортное исследование с более длительным периодом наблюдения за микробиомами кишечника поможет более точно определить продолжительность и динамику изменения микробиоты и уровней SIgA после лечения от гельминтов мебендазолом.Генетика хозяина и диета являются смешивающими факторами для долгосрочного наблюдения. Было обнаружено, что вариации в геноме человека способствуют колонизации различной кишечной микробиоты [46]. Было показано, что диета с высоким содержанием жиров и низким содержанием клетчатки связана с уменьшением количества полезных микробов, продуцирующих короткоцепочечные жирные кислоты (SCFA), и, таким образом, такая диета увеличивает риск воспалительных и аутоиммунных заболеваний [47]. Кроме того, наши результаты показали, что недавняя инфекция дыхательных путей при использовании пероральных препаратов в исследуемой популяции может быть обратно коррелирована с микробным разнообразием кишечника и сниженной относительной численностью Fusobacterium и Acidaminococcus , что может повлиять на эффект инфекции острицы. .Таким образом, различная генетика хозяина, образ жизни, частота инфекций дыхательных путей и использование лекарств могут способствовать непоследовательной связи энтеробиоза и риска воспалительных заболеваний, наблюдаемых в педиатрических когортах различных стран.
В заключение, инфекция Enterobius vermicularis связана с повышенным микробным разнообразием кишечника и снижением уровней SIgA в кишечнике. Несколько бактериальных таксонов продемонстрировали различную численность групп остриц (-), остриц (+) мебендазола (-) и остриц (+) мебендазола (+).Дегельминтизация мебендазолом коррелировала с повышенным уровнем SIgA в кишечнике и более высокой долей пробиотических бактерий у половины инфицированных субъектов. Чтобы лучше понять причинно-следственную связь инфекции остриц и лечения мебендазолом с микробным составом кишечника и иммунными реакциями хозяев, необходимы дополнительные эксперименты, включая исследования на животных.
Дополнительная информация
S2 Рис. Микробиологические характеристики и анализ обогащения путей.
А-Б .Коробчатые диаграммы, показывающие анализ обогащения микробиологических характеристик на основе окрашивания по Граму ( a ) и особенностей образования эндоспор ( b ). ***: p <0,001 по тесту ANOVA. с-е . Анализ обогащения путей показывает значительное увеличение метаболизма жиров ( c ), удлинения жирных кислот ( d ) и метаболизма кофеина ( e ) после инфекции остриц в сочетании с лечением мебендазолом. Пакет R «Tax4Fun» использовался для преобразования таблицы OTU в значение активности пути.***: p <0,001, **: P <0,01, *: P <0,05 по тестам ANOVA.
https://doi.org/10.1371/journal.pntd.0005963.s003
(TIF)
S3 Рис. Различия в видовом составе кишечных бактерий в группах с повышенным и не повышенным SIgA.
Графики вулкана, показывающие дифференциально экспрессируемые бактерии на уровне видов, сравнивающие необработанные, инфицированные острицами P + M- образцы группы без увеличения SIgA и образцы P + M- группы с повышенным SIgA ( a ), P + M + образцы vs.Образцы P + M- в группе без увеличения SIgA ( b ) и образцы P + M + по сравнению с образцами P + M- в группе с повышенным SIgA ( c ). Красные точки представляют важные таксоны, проанализированные тестами Вилкоксона. После корректировки значения p эти таксоны, оставшиеся значимыми (FDR <0,05), отображаются красным цветом, виды бактерий с FDR> 0,05 — синим. Границы значительного изменения кратности и значения p показаны пунктирными линиями. Размер точки представляет собой среднюю относительную численность.
https: // doi.org / 10.1371 / journal.pntd.0005963.s004
(TIF)
Благодарности
Мы хотели бы поблагодарить г-жу Пи-Чун Ма, Джр-Хан Ю и И-Лу Лай за помощь в наборе участников.
Список литературы
- 1. Elliott DE, Weinstock СП. Где мы на червях? Курр Опин Гастроэнтерол. 2012. 28 (6): 551–556. pmid: 23079675
- 2. Энтони Р.М., Рутицки Л.И., Урбан Дж. Ф. младший, Штадекер М.Дж., Гаузе WC. Защитные иммунные механизмы при гельминтозной инфекции.Nat Rev Immunol. 2007; 7 (12): 975–987. pmid: 18007680
- 3. Харнетт У., Харнетт ММ. Иммуномодуляторы гельминтов: может ли понимание глистов произвести таблетки? Nat Rev Immunol. 2010. 10 (4): 278–284. pmid: 20224568
- 4. Гейл EA. Недостающее звено в гипотезе гигиены? Диабетология. 2002. 45 (4): 588–594. pmid: 12032638
- 5. Чанг Т.К., Ляо К.В., Хуанг Ю.К., Чанг СС, Чжоу С.М., Цай Х.С. и др. Распространенность инфекции Enterobius vermicularis среди детей дошкольного возраста в детских садах города Тайбэй, Тайвань, в 2008 г.Корейский J Parasitol. 2009. 47 (2): 185–187. pmid: 19488428
- 6. Ван СС, Ли Ю.Ф., Чанг СС, Ли Н.С., Чен П.Й., Хуанг Флорида и др. Текущее состояние инфекции Enterobius vermicularis у младших школьников в округах Мяоли и Тайчжун, Тайвань. J Microbiol Immunol Infect. 2009. 42 (5): 420–426. pmid: 20182672
- 7. Хуанг С.Л., Цай П.Ф., Йе Ю.Ф. Отрицательная связь заражения Enterobius с астмой и ринитом у детей начальной школы в Тайбэе. Clin Exp Allergy.2002. 32 (7): 1029–1032. pmid: 12100049
- 8. Bahceciler NN, Ozdemir C, Kucukosmanoglu E, Arikan C, Over U, Karavelioglu S, et al. Связь между предыдущим энтеробиозом и текущим хрипом: оценка 1018 детей. Allergy Asthma Proc. 2007. 28 (2): 174–182. pmid: 17479601
- 9. Bager P, Vinkel Hansen A, Wohlfahrt J, Melbye M. Гельминтная инфекция не снижает риск хронического воспалительного заболевания в популяционном когортном исследовании. Гастроэнтерология.2012. 142 (1): 55–62. pmid: 21983081
- 10. Forbes JD, Van Domselaar G, Bernstein CN. Микробиота кишечника при иммуноопосредованных воспалительных заболеваниях. Front Microbiol. 2016; 7: 1081. pmid: 27462309
- 11. Гилберт Дж. А., Куинн Р. А., Дебелиус Дж., Сюй З. З., Мортон Дж., Гарг Н. и др. Исследования ассоциаций микробиома связывают динамические микробные консорциумы с болезнью. Природа. 2016; 535 (7610): 94–103. pmid: 27383984
- 12. Костич А.Д., Геверс Д., Сильяндер Х., Ватанен Т., Хиотилайнен Т., Хамалайнен А.М. и др.Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Клеточный микроб-хозяин. 2015. 17 (2): 260–273. pmid: 25662751
- 13. Кей Г.Л., Миллард А., сержант М.Дж., Мидзи Н., Гвисай Р., Мдулуза Т. и др. Различия в фекальном микробиоме у детей, инфицированных Schistosoma haematobium, и неинфицированных детей. PLoS Negl Trop Dis. 2015; 9 (6): e0003861. pmid: 26114287
- 14. Ли С.К., Тан М.С., Лим Ю.А., Чой С.Х., Курц З.Д., Кокс Л.М. и др.Колонизация гельминтами связана с увеличением разнообразия микробиоты кишечника. PLoS Negl Trop Dis. 2014; 8 (5): e2880. pmid: 24851867
- 15. Купер П., Уокер А.В., Рейес Дж., Чико М., Солтер С.Дж., Вака М. и др. Запатентованные инфекции человека, вызываемые власоглавом, Trichuris trichiura, не связаны с изменениями в фекальной микробиоте. PLoS One. 2013; 8 (10): e76573. pmid: 24124574
- 16. Houlden A, Hayes KS, Bancroft AJ, Worthington JJ, Wang P, Grencis RK и др.Хроническая инфекция Trichuris muris у мышей C57BL / 6 вызывает значительные изменения в микробиоте и метаболоме хозяина: эффекты, обратимые удалением патогенов. PLoS One. 2015; 10 (5): e0125945. pmid: 25938477
- 17. Holzscheiter M, Layland LE, Loffredo-Verde E, Mair K, Vogelmann R, Langer R и др. Отсутствие микробиоты кишечника хозяина изменяет иммунные реакции и формирование кишечных гранулем при шистосомозе. Clin Exp Immunol. 2014. 175 (2): 246–257. pmid: 24168057
- 18. Бенсон А., Пайфер Р., Берендт К.Л., Хупер Л.В., Яровинский Ф.Комменсальные бактерии кишечника направляют защитный иммунный ответ против Toxoplasma gondii. Клеточный микроб-хозяин. 2009. 6 (2): 187–196. pmid: 19683684
- 19. Раманан Д., Боукатт Р., Ли С.К., Тан М.С., Курц З.Д., Дин И и др. Инфекция гельминтов способствует устойчивости к колонизации через иммунитет 2 типа. Наука. 2016; 352 (6285): 608–612. pmid: 27080105
- 20. Саперо Дж. Дж., Лоулесс ДК. Техника сохранения окраски MIF для идентификации кишечных простейших. Am J Trop Med Hyg.1953; 2 (4): 613–619. pmid: 13065626
- 21. Weng SL, Chiu CM, Lin FM, Huang WC, Liang C, Yang T и др. Бактериальные сообщества в сперме мужчин из бесплодных пар: метагеномное секвенирование показывает взаимосвязь семенной микробиоты с качеством спермы. PLoS One. 2014; 9 (10): e110152. pmid: 25340531
- 22. Эдгар RC. UPARSE: высокоточные последовательности OTU, полученные при считывании микробного ампликона. Нат методы. 2013; 10 (10): 996–998. pmid: 23955772
- 23. Лангмид Б, Зальцберг С.Л.Быстрое согласование с пропуском чтения с Bowtie 2. Натр. Методы. 2012. 9 (4): 357–359. pmid: 22388286
- 24. Lozupone C, Lladser ME, Knights D, Stombaugh J, Knight R. UniFrac: эффективный показатель расстояния для сравнения микробного сообщества. ISME J. 2011; 5 (2): 169–172. pmid: 20827291
- 25. Asshauer KP, Wemheuer B, Daniel R, Meinicke P. Tax4Fun: прогнозирование функциональных профилей на основе данных метагеномной 16S рРНК. Биоинформатика. 2015. 31 (17): 2882–2884. pmid: 25957349
- 26.Giacomin P, Zakrzewski M, Croese J, Su X, Sotillo J, McCann L, et al. Экспериментальная анкилостомическая инфекция и возрастающие проблемы с глютеном связаны с увеличением микробного богатства у пациентов с глютеновой болезнью. Научный доклад 2015; 5: 13797. pmid: 26381211
- 27. Sokol H, Pigneur B, Watterlot L, Lakhdari O, Bermudez-Humaran LG, Gratadoux JJ, et al. Faecalibacterium prausnitzii — это противовоспалительная комменсальная бактерия, идентифицированная анализом кишечной микробиоты пациентов с болезнью Крона.Proc Natl Acad Sci U S. A. 2008; 105 (43): 16731–16736. pmid: 18936492
- 28. Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F и др. Метагеномное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. 2012. 490 (7418): 55–60. pmid: 23023125
- 29. Ле Шателье Э, Нильсен Т., Цинь Дж., Прифти Э, Хильдебранд Ф, Фалони Дж. И др. Богатство микробиома кишечника человека коррелирует с метаболическими маркерами. Природа. 2013; 500 (7464): 541–546. pmid: 23985870
- 30.Saulnier DM, Riehle K, Mistretta TA, Diaz MA, Mandal D, Raza S и др. Сигнатуры желудочно-кишечного микробиома педиатрических пациентов с синдромом раздраженного кишечника. Гастроэнтерология. 2011. 141 (5): 1782–1791. pmid: 21741921
- 31. Jiang H, Ling Z, Zhang Y, Mao H, Ma Z, Yin Y и др. Измененный состав фекальной микробиоты у пациентов с большим депрессивным расстройством. Иммунное поведение мозга. 2015; 48: 186–194. pmid: 25882912
- 32. Allen-Vercoe E. Fusobacterium varium при язвенном колите: популяционный? Dig Dis Sci.2015; 60 (1): 7–8. pmid: 25311584
- 33. Feng Q, Liang S, Jia H, Stadlmayr A, Tang L, Lan Z, et al. Развитие кишечного микробиома по последовательности колоректальной аденомы-карциномы. Nat Commun. 2015; 6: 6528. pmid: 25758642
- 34. Касаи К., Сугимото К., Моритани И., Танака Дж., Оя Й., Иноуэ Х. и др. Сравнение микробиоты кишечника человека у контрольных субъектов и пациентов с колоректальной карциномой в аденоме: полиморфизм длины конечных рестрикционных фрагментов и анализ секвенирования следующего поколения.Онкол Реп. 2016; 35 (1): 325–333. pmid: 26549775
- 35. Пацантара Г.Г., Пипераки Е.Т., Цумака-Бакула С., Канариу М.Г. Иммунные ответы у детей, инфицированных острицами Enterobius vermicularis в центральной Греции. J Helminthol. 2016; 90 (3): 337–341. pmid: 25989836
- 36. Осава Р., Уильямс К.Л., Сингх Н. Путь регуляции воспаления и инфекции: роль в патофизиологии и клинических последствиях. J Infect. 2011. 62 (2): 119–129. pmid: 20950647
- 37.Заисс М.М., Масловски К.М., Москони И., Генат Н., Марсланд Б.Дж., Харрис Н.Л. IL-1beta подавляет врожденную продукцию IL-25 и IL-33 и поддерживает хроническое течение гельминтов. PLoS Pathog. 2013; 9 (8): e1003531. pmid: 23935505
- 38. Альварадо Р., То Дж., Лунд М.Э., Пинар А., Мэнселл А., Робинсон М.В. и др. Иммуномодулирующий пептид FhHDM-1, секретируемый гельминтом Fasciola hepatica, предотвращает активацию воспаления NLRP3, подавляя эндолизосомное закисление в макрофагах. FASEB J.2017; 31 (1): 85–95. pmid: 27682204
- 39. Кортези Б. Многогранные функции секреторного IgA на поверхности слизистой оболочки. Фронт Иммунол. 2013; 4: 185. pmid: 23874333
- 40. Франц А.Л., Бруно М.Э., Рожье Э.В., Тунец Х., Коэн Д.А., Бондада С. и др. Многофакторные паттерны экспрессии генов в эпителиальных клетках толстой кишки предсказывают фенотипы заболевания при экспериментальном колите. Воспаление кишечника. 2012. 18 (11): 2138–2148. pmid: 23070952
- 41. Матисяк-Будник Т., Моура И.К., Аркос-Фахардо М., Лебретон С., Менард С., Кандал С. и др.Секреторный IgA опосредует ретротрансцитоз интактных пептидов глиадина через рецептор трансферрина при целиакии. J Exp Med. 2008. 205 (1): 143–154. pmid: 18166587
- 42. Хупер Л.В., Вонг М.Х., Телин А., Ханссон Л., Фальк П.Г., Гордон Дж. Молекулярный анализ комменсальных взаимоотношений между хозяином и микробом в кишечнике. Наука. 2001. 291 (5505): 881–884. pmid: 11157169
- 43. Кац М. Антигельминтики. Наркотики. 1977. 13 (2): 124–136. pmid: 319991
- 44. Ли Би Джей, Бак ЮТ.Синдром раздраженного кишечника, кишечная микробиота и пробиотики. J Neurogastroenterol Motil. 2011. 17 (3): 252–266. pmid: 21860817
- 45. Уильямсон Т., Бай Р.Ю., Стадтке В., Хусо Д., Риггинс Г.Дж. Мебендазол и нестероидные противовоспалительные средства объединяются для уменьшения инициации опухоли на доклинической модели рака толстой кишки. Oncotarget. 2016; 7 (42): 68571–68584. pmid: 27612418
- 46. Блехман Р., Гудрич Дж. К., Хуанг К., Сан К., Буковски Р., Белл Дж. Т. и др. Генетическая изменчивость хозяев влияет на состав микробиома на разных участках тела человека.Genome Biol. 2015; 16: 191. pmid: 26374288
- 47. Ричардс Дж. Л., Яп Ю. А., МакЛеод К. Х., Маккей С. Р., Марино Э. Диетические метаболиты и микробиота кишечника: альтернативный подход к контролю воспалительных и аутоиммунных заболеваний. Clin Transl Immunology. 2016; 5 (5): e82. pmid: 27350881
приводят к нарушению настроения, поведения и сна, особенно у детей. 50% детей заболеют глистами. Могли ли ваши дети болеть глистами?
Может быть, черви?
Паразитарные инфекции, часто протекающие бессимптомно, могут приводить к нарушению настроения, поведения и сна, особенно у детей с глистами.
Самая распространенная глистная инфекция среди австралийских детей — нитчатая (острица, Enterobius vermicularis). Другие черви, такие как круглые черви, анкилостомы и ленточные черви, встречаются гораздо реже.
По оценкам, 50% детей будут инфицированы острицами. Чаще всего встречается у школьников 5-10 лет.
Что такое черви?
Острицы — это крошечные белые черви, обитающие в толстой и прямой кишках. Несмотря на все наши усилия в школах, детских садах и детских садах, черви легко передаются благодаря тесному личному контакту между детьми.
Передача инфекции происходит через яйца паразитов, прямо или косвенно, при контакте с руками или через зараженную одежду, постельные принадлежности или пищу. Чаще всего виноват в том, что немытые руки в ванной касаются дверных ручек. Хотя вы можете быть уверены, что научили своих детей эффективным методам гигиены, мы не можем гарантировать, что делают их одноклассники!
Яйца паразитов могут выжить до ДВУХ НЕДЕЛЬ на одежде, постельных принадлежностях и других предметах. Это делает стойкое повторное инфицирование обычным явлением, а стандартное лечение часто неэффективным.
Личинки вылупляются в тонком кишечнике, прежде чем пробираться в прямую кишку. Однако они были обнаружены в окрестностях. Некоторые примеры включают: сокрытие в аппендиксе и в женских половых путях (из-за близости прямой кишки и влагалища, что приводит к перекрестной инфекции).
Какие симптомы мне следует искать?
Симптомы заражения острицами обычно легкие и часто проявляются ночью, так как именно тогда самка выходит из прямой кишки, чтобы отложить яйца.
Симптомы включают:
- Боль в животе (имитирующая аппендицит)
- Зуд в анусе
- Шлифовка зубов
- Постельное недержание мочи или частое мочеиспускание (энурез)
- Бессонница, беспокойный или нарушенный сон
- Похудание / трудности с набором веса
- Раздражительность, перепады настроения и беспокойство
- Стойкие случаи инфекций мочевыводящих путей (особенно у девочек)
Хронические инфекции могут привести к нарушению работы кишечных бактерий и нарушить обмен сигналами между желудочно-кишечным трактом и мозгом.Измененная связь по оси кишечник-мозг была связана с поведенческими расстройствами, расстройствами настроения, депрессией и тревогой, а также проблемами с обучением и памятью.
Поскольку острицы ведут ночной образ жизни, их активность в ночное время вызывает беспокойство, зуд, раздражение и в целом плохое качество сна. Недостаточный и беспокойный сон хорошо известен своим негативным влиянием на настроение и поведение детей, что в значительной степени связано с плохим познанием, обучением и успеваемостью.Рекомендуемая продолжительность сна для детей школьного возраста составляет от 9 до 11 часов, при этом продолжительность сна меньше 7 часов способствует ухудшению психического здоровья, поведения и успеваемости.
Диагностика
Анализ образцов кала на самом деле в значительной степени неточен, поскольку яйца можно обнаружить только в 5% образцов кала. Это может объяснить распространенность недообнаружения и недооценки паразитарных инвазий среди детей.
Самым точным исследованием на самом деле является самое простое и экономичное — скотч-тест.Это включает в себя именно то, что вы думаете, это наложение липкой ленты на перианальную область сразу после вставания в течение трех дней подряд. Затем исследуйте наличие яиц или настоящих червей.
Натуропатическое лечение
Мы используем особый состав лекарственных трав для лечения паразитарных инфекций у детей и взрослых. Метод дозирования так же важен, как и используемые лекарства.
У паразитарных инфекций есть жизненный цикл, который может сделать фармацевтическое лечение неэффективным.Однократная доза таблетки от гельминтов может убить личинок и взрослых остриц, что может привести к временному уменьшению симптомов. Однако в конечном итоге из оставшихся инфекционных яиц вылупятся яйца, и цикл продолжится.
Мы лечим пациентов противопаразитарными травами в течение 2 недель, чтобы эффективно убить живых паразитов. После этого у нас есть двухнедельный перерыв, чтобы дать яйцам время вылупиться. Затем мы начинаем второй двухнедельный цикл лечения, чтобы убить личинок до того, как они созреют и снова начнут размножаться.
Все время вместе с ними прописываются штаммы пробиотиков, чтобы заселить кишечник микробами, в которых мы хотим жить. Если у нас есть здоровый и устойчивый микробиом, полный полезных бактерий, мы уменьшаем вероятность повторного заражения. Заселение кишечника полезными веществами так же важно, как и избавление от болезнетворных микроорганизмов!
Последнее слово…
Хотя глисты у детей часто проявляются слабо выраженными симптомами, они могут перейти в хроническую форму, если их не лечить.Это не самая красивая статья для написания (или для чтения, я уверен!). Но это имеет большое клиническое значение — в основном потому, что эти инфекции довольно часто игнорируются или игнорируются.
В Институте тела мы надеемся, что в этой статье подчеркивается важность эффективной диагностики и лечения этих инфекций в связи с широким спектром проблем, которые могут возникнуть в результате этой распространенной детской инфекции.
Если вы готовы обратиться за лечением, запишитесь на прием к нашему детскому натуропату Эшли онлайн здесь.
— Эшли Йейтс, детское здоровье, натуропат, бакалавр наук (натуропатия)
Незваные гости: 7 худших паразитических червей
Что такое слизистое и бесхребетное, что хочет паразитировать на вас? (Они не баллотируюсь в офис, если это сужает круг.) Черви! Не беспокойся о мясистом маленькие вигглеры, которые появляются после дождя … им хорошо, что они просто тусуются грязь. Но некоторым из их кузенов просто не терпится превратить вашу смертную оболочку в «шведский стол» для родовспоможения.Взгляните на некоторые из трубчатых ужасов ниже.
Гвинея червь
дракункулезСамка дракункулеза ( Dracunculus medinensis ), выходящая из ноги человека, страдающего дракункулезом.
Центр Картера / Центры по контролю и профилактике заболеванийПередается, когда а человек напитки вода, содержащая инфицированных водяных блох, или Циклоп , Гвинея черви причиняют невыносимую боль, когда они вырывают себе путь из своего человеческого тела. хозяева, чтобы отложить яйца.К счастью, заражение этими ужасными существа существенно уменьшились в виде результат из усилия по искоренению Мир Здоровье Организация и НАС. Центры для Болезнь Контроль а также Профилактика.
Ленточный червь
цестодозСколекс (голова) ленточного червя Taenia solium . Крючки сколекса позволяют ленточному червю прикрепляться к стенке кишечника.
Доктор Мэй Мелвин / Центры по контролю и профилактике заболеваний (CDC) (Номер изображения: 1515)Существует около 5000 видов этих кишечных паразитов, но Только три — свинина, говядина и рыба ленточные черви — регулярно создать магазин в человеческом теле.Если ты думаешь, что не может быть хуже, чем если одно из этих ужасных существ прикрепится к стенке вашего кишечника, подумай еще раз. Если случайно съесть эмбрион, личинка может зарыться в норку. в ваши мышцы, кожу, глаза или мозг.
Острица
острицаОстрица ( Enterobius vermicularis ).
Walter DawnПагубная острица — самый распространенный из ее собратьев, которые заражаются. люди в Соединенных Штатах.Пока их хозяева спят, материнские острицы совершить утомительный прорыв из своего жилища в толстую кишку к анальному отверстию, где они откладывают яйца — процесс, вызывающий ощущение зуда. Яйца подбираются под ногти и повторно проглатываются пострадавшим. Есть причина Зачем это паразит наиболее распространен среди детей.
Heartworm
HeartwormСердце, инфицированное сердечными червями ( Dirofilaria immitis ).
МэндиСердечные черви могут жить за пять к Семь годы. Годы. В сердце вашей собаки. В личиночной форме передается комарами, черви длиной в фут могут в конечном итоге вызвать сердечно-сосудистую блокировку. Ежемесячно профилактический лечение необходимо даже для домашних животных. Кошки тоже могут их достать и страдают даже сильнее, чем собаки.О, и они были найдены в человеческий мозг, глаза, легкие и яички.
- Ascaris нематода
Нематода ( Ascaris lumbricoides ).
Хавьер Палаус Солер / Агентство ОстманОгромная часть населения мира инфицирована этим крупный червь нематода. По некоторым оценкам, количество инфекций — в основном развивающихся странах — более миллиарда, а число смертей ежегодно в десятки тысяч.Эти крупные жители кишечник — который, согласно Britannica, «характеризуются ртом, окруженным тремя губы »- передается при случайном проглатывании яиц, обычно через почва загрязнена фекалиями.
Власоглав
ВласоглавВласоглав ( Trichuris trichiura ).
ANWОколо миллиарда человек инфицированы власоглавы, который находятся относительно крошечный — около четыре сантиметры долго — и отвратительно плодовитый.Зрелые самки могут откладывать тысячи яиц каждый день в толстая кишка инфицированных людей.
- Toxocara Toxocara
Аскариды собак ( Toxocara canis ).
Джоэл МиллсСобаки и кошки имеют свой собственный вид Toxocara . Как и многие из вышеперечисленных паразитов, они передаются при употреблении в пищу яйца из почвы или зараженного животного-жертвы.Собачий виды также могут передаваться в матка. О 14 процентов американцев, по крайней мере, были разоблачены к, если не зараженный от, это червь в соответствии к исследованиям антител.
Острицы | Часто задаваемые вопросы
Острицы Домашние ресурсы
Что нужно знать: Острицы / инфекции остриц
Что такое острицы? Что вызывают острицы?
Инфекции острицы — распространенные кишечные инфекции, вызываемые паразитом Enterobius vermicularis .
Каковы симптомы заражения острицами?
Большинство симптомов заражения острицами легкие; у многих инфицированных людей симптомы отсутствуют.Если присутствует, основным симптомом является зуд прямой кишки, особенно сильный ночью или ранним утром. Другие возможные симптомы включают: раздражительность, беспокойство, боль в животе и воспаление области влагалища.
Насколько распространены инфекции острицы?
Это легко передаваемая инфекция, очень часто встречающаяся в семьях с маленькими детьми.
Острицы — наиболее распространенная глистная инфекция в США. По оценкам экспертов, острицами заражается каждый десятый человек в мире.
Как люди заражаются острицами?
Взрослые острицы живут в толстом кишечнике. Готовясь отложить яйца, самка выползает из анального отверстия и откладывает яйца на перианальной (то есть в области вокруг ануса) коже. Одна самка может произвести более 10 000 яиц. Яйца распространяются, когда человек почесывает эту область и передает яйца в рот или другому человеку. Загрязненное постельное белье, продукты питания, одежда и другие предметы могут косвенно переносить яйца. Яйца могут жить в помещении около двух недель.
Как мне защитить свою семью от остриц?
Поскольку руки инфицированного человека неизменно будут загрязнены яйцами, обучение маленьких детей правильному мытью рук, особенно перед едой и после посещения туалета, помогает предотвратить повторное заражение и передачу яиц другим людям.
Если кому-то из членов семьи поставили диагноз острицы, все простыни, одеяла, полотенца и одежду в доме следует выстирать в горячей воде и высушить при максимально высокой температуре.Ногти всех людей (на которых могут быть скоплены яйца глистов) следует тщательно очистить и коротко подстричь. Очищайте и пылесосите жилые и спальные зоны еженедельно в течение следующих 1-2 недель после лечения.
Как мне защитить других от остриц?
Если у ребенка диагностирована инфекция острицы, известите его или ее детский сад. Учреждение проинформирует вас о правилах посещения детских садов и заражении острицами.
Как диагностируется инфекция острицы?
Поскольку самки остриц откладывают яйца в ранние утренние часы, родители ребенка должны исследовать перианальную кожу на наличие признаков инфекции.Яйца на коже перианальной области можно обнаружить, используя кусок целлофановой ленты, прикрепленный к деревянному палочке-аппликатору липкой стороной наружу. Затем ленту прижимают к перианальной коже, а затем исследуют на наличие яиц. Лучше всего это делать, как только ребенок проснется. Взрослые черви также можно увидеть в перианальной области. Кожу ребенка можно проверить с помощью фонарика ночью и первым делом утром. Ищите белые шевелящиеся нити.
Как лечат инфекции острицы?
У детей старше двух лет лечение обычно включает мебендазол (вермокс) или пин-Х (пирантел памоат), безрецептурную альтернативу вермоксу, которая доступна в виде жидкости.Врачи расходятся во мнениях относительно того, нужно ли лечить всех членов семьи. Некоторые врачи предпочитают лечить членов семьи только в постоянных случаях. Проконсультируйтесь с вашим лечащим врачом по поводу оптимального курса лечения.
Острицы (энтеробиоз) МКБ-9 127.4; МКБ-10 B80
остриц | Чарльз Ривер
КлассификацияВнутренний паразит многоклеточных животных
СемьяOyxuridae
Затронутые видыSyphacia obvelata , S.muris и Aspiculuris tetraptera — наиболее распространенные острицы у крыс и мышей. У кроликов преобладает острица Passalurus ambiguus ; у песчанок — Dentostomella translucida , хотя сообщалось об инфицировании S. obvelata и S. muris ; а у хомяков — S. criceti и S. mesocriceti , хотя сообщалось о S. obvelata и S. muris . Настоящая острица не была описана у морских свинок, хотя сообщалось о черве слепой кишки из семейства Heterakoidea, Paraspidodera uncinata .
ЧастотаОстрицы распространены среди диких и домашних животных, но в разной степени распространены среди лабораторных животных.
ТрансмиссияОстрицы имеют прямой жизненный цикл, то есть им не нужно проходить через промежуточного хозяина, чтобы стать заразными. Острицы передаются фекально-оральным путем (заглатывание яиц с зародышем). Яйца остриц имеют тенденцию быть липкими и долгоживущими, поэтому могут сохраняться в окружающей среде. Передача также может происходить через фомит.В некоторых случаях жизненный цикл конкретного паразита может быть достаточно коротким, чтобы допустить ретроинфекцию, когда яйца цепляются за шерсть, а затем вылупляются и снова ползают в животном.
Клинические признаки и пораженияУ иммунокомпетентных животных инфекция обычно протекает бессимптомно. В некоторых отчетах описывается выпадение прямой кишки, плохой волосяной покров и потеря веса как признаки инфекции острицы, но у животных в этих отчетах могли быть и другие сопутствующие заболевания.
ДиагностикаДиагностика остриц может быть выполнена путем обнаружения яйцеклеток с помощью теста перианальной ленты (для Syphacia spp.только), мазок из анального отверстия, флотации фекалий и / или центрифугирования (в первую очередь эффективен для видов, отличных от Syphacia), или путем исследования содержимого слепой кишки и толстой кишки на наличие взрослых животных. Исследование содержимого слепой кишки и толстой кишки является наиболее чувствительным методом по сравнению с другими диагностическими инструментами и чувствительным для всех видов остриц; однако, в отличие от других техник, это требует смерти животного.
У более старых иммунокомпетентных животных разовьется иммунитет к острице, опосредованный Th3-ответом, и они могут либо избавиться от инфекции, либо остаться инфицированными небольшим количеством паразитов.Обнаружение острицы лучше всего проводить у только что отлученных от груди животных или животных младшего возраста.
Помехи в исследованияхПоскольку у большинства инфицированных животных (даже у животных с иммунодефицитом) клинические признаки проявляются редко, состояние тела или общее состояние здоровья обычно не препятствуют использованию этих животных в исследованиях. Инфекция остриц может иметь более тонкие эффекты, обычно влияющие на природу иммунного ответа, что может сделать животных непригодными для использования. Например, у мышей, инфицированных острицами, чаще наблюдались аутоиммунные заболевания, у голых животных с инфекциями острицы увеличивалась распространенность лимфомы, было обнаружено, что инфекция острицы у одной линии мышей влияет на гемато- и лимфопоэз, а у мышей были обнаружены инфекции острицы. иметь повышенную аллергическую реакцию на диетический антиген.Инфекция остриц в колонии также может считаться маркером неадекватных методов биозащиты.
Профилактика и лечениеИнфекции острицы лучше всего предотвратить, исключив инфицированных животных из помещений. Животные, поступающие на территорию учреждения, должны быть получены от поставщиков с хорошей репутацией. Животные, поступающие из других учреждений, должны быть помещены в карантин и проверены или обработаны перед выпуском из карантина.
Схемы лечения мышей и крыс описаны в справочной литературе.Для мышей и крыс лечение обычно включает еженедельный режим кормления, а также недельный перерыв с кормом, содержащим фенбендазол. Этот корм легко доступен в продаже. Лечение остриц у песчанок, кроликов, хомяков и морских свинок следует проводить после обзора справочной литературы, поскольку режимы для этих животных могут немного отличаться от рекомендованных для мышей и крыс. Хотя инфекцию острицы можно лечить, схемы лечения могут не сработать, и это следует учитывать при принятии решения о лечении.Повторное выделение колонии избавит животных от остриц, но животные могут заразиться повторно, если не будут предприняты попытки строгой дезинфекции окружающей среды. Яйца остриц устойчивы к обезвоживанию и многим распространенным дезинфицирующим средствам, но чувствительны к высоким температурам.
.
 е. с резинками не только на поясе, но и вокруг ног.
е. с резинками не только на поясе, но и вокруг ног.