Диагностика гельминтов
Не могу не обратиться к читающей нас аудитории о разных вариантах паразитологических исследований.
При клиническом подозрении на паразитарное заболевание у детей и взрослых диагностика может проводиться путем исследования кала на яйца гельминтов и соскобов на энтеробиоз. Расширить диагностические возможности позволяет анализ крови на некоторые виды гельминтов: печеночные сосальщики, аскаридоз, лямблиоз, и на наличие тканевых гельминтов (токсокары, эхинококки и трихинеллы), когда в анализе крови определяют антитела к данным паразитам.
Надо сказать, что 100% точности ни один из методов не имеет, и 100% гарантии при отрицательных результатах тоже нет. Многие лабораторные исследования обязательно должны соотноситься с клиническими данными. Анализы необходимо проводить многократно, повышая вероятность получения правильного результата. Отличие диагностических возможностей зависит от специфики гельминтов.
При обнаружении подозрительных включений в кале (что-то похожее на паразита) – описать доктору, сфотографировать включения, принести в лабораторию на исследование и соотнести с клиническими жалобами. Только после тщательного разбора всей информации доктор назначит лечение, проведет эпидемиологическое расследование и контроль результата терапии.
Только после тщательного разбора всей информации доктор назначит лечение, проведет эпидемиологическое расследование и контроль результата терапии.
Распространенность гельминтозов высокая, выявляемость низкая, о профилактике и превентивном лечении поговорим позже.
Практические вопросы диагностики и лечения гельминтозов у детей Текст научной статьи по специальности «Клиническая медицина»
®
ребенка
КлУчш лекцп / Clinical Lectures
УДК 616.995.1-036-07-08-053.2
ШААРИН О.Г., КОВАЛЬЧУК A.A., ДЮКАРЕВА C.B., ФИСУН B.H.
ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», г. Киев
ПРАКТИЧЕСКИЕ ВОПРОСЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ГЕЛЬМИНТОЗОВ У ДЕТЕЙ
Резюме. В статье изложены основные сведения о гельминтозах человека. С современных позиций освещены вопросы этиологии, клинической картины, диагностики и лечения наиболее распространенных гельминтозов, особенности их течения у детей. Ключевые слова: дети, гельминтозы, диагностика, лечение.
В статье изложены основные сведения о гельминтозах человека. С современных позиций освещены вопросы этиологии, клинической картины, диагностики и лечения наиболее распространенных гельминтозов, особенности их течения у детей. Ключевые слова: дети, гельминтозы, диагностика, лечение.
Проблема гельминтозов обусловлена распространенностью этой патологии и несет серьезную угрозу здоровью детского населения. По данным Всемирной организации здравоохранения (ВОЗ), среди инфекционных заболеваний по распространенности паразитозы занимают 3-е место (после диареи и туберкулеза), а среди причин смерти — 4-е, пропустив вперед только ишемическую болезнь сердца.
На сегодняшний день доказано паразитирование в организме человека около 350 видов гельминтов. По мнению многих авторов, более 40 видов паразитов канцерогенны для человека и животных. По оценке ВОЗ, 1,5 млн случаев онкопатологии можно предупредить, проводя профилактику паразитозов.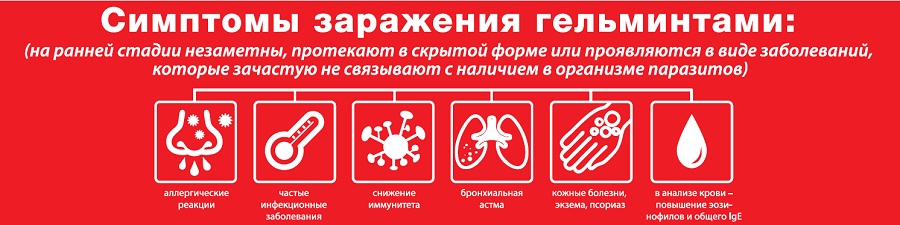 В Украине идентифицируют около 30 их видов, а согласно экспертным оценкам ежегодно регистрируется около 500 тысяч случаев гельминтозов, из них 80 % — у детей. Особенностью многих паразитозов является их многолетнее присутствие в организме, что связано с длительным сроком жизни многих паразитов и их частой реинвазией. При этом на организм ребенка имеют постоянное патологическое влияние метаболиты паразитов, что наиболее часто проявляется аллергизацией, иммунодепрессией, авитаминозами, поражением пищеварительной системы и многих других органов. Кроме того, паразиты влияют на функциональное состояние организма ребенка, приводя к развитию предрасположенности к широкому кругу заболеваний. Многочисленность видов паразитарных заболеваний, разнообразие путей и факторов их передачи указывают на постоянную необходимость усовершенствования путей и методов диагностики и борьбы с паразитарными инвазиями с учетом местных природно-климатиче-
В Украине идентифицируют около 30 их видов, а согласно экспертным оценкам ежегодно регистрируется около 500 тысяч случаев гельминтозов, из них 80 % — у детей. Особенностью многих паразитозов является их многолетнее присутствие в организме, что связано с длительным сроком жизни многих паразитов и их частой реинвазией. При этом на организм ребенка имеют постоянное патологическое влияние метаболиты паразитов, что наиболее часто проявляется аллергизацией, иммунодепрессией, авитаминозами, поражением пищеварительной системы и многих других органов. Кроме того, паразиты влияют на функциональное состояние организма ребенка, приводя к развитию предрасположенности к широкому кругу заболеваний. Многочисленность видов паразитарных заболеваний, разнообразие путей и факторов их передачи указывают на постоянную необходимость усовершенствования путей и методов диагностики и борьбы с паразитарными инвазиями с учетом местных природно-климатиче-
ских, а также социальных условий жизни и деятельности местного населения.
Помимо значимости для общественного здравоохранения, паразитарные заболевания наносят огромный экономический ущерб и тормозят в целом социально-экономическое развитие.
Важность проблемы гельминтозов объясняется двумя причинами: высокой распространенностью среди детского населения и значительным влиянием на состояние здоровья. Среди всех инвазирован-ных на долю детей приходится 92,3 % случаев энте-робиоза, 71,1 % аскаридоза, 61,5 % трихоцефалеза и 66,2 % токсокароза. При этом чаще поражаются гельминтозом дошкольники и младшие школьники [1]. Важна и проблема полиинвазий, причем у детей школьного возраста она отмечается в 74 % случаев и чаще протекает без явных признаков с малоспецифической симптоматикой, а зачастую диагностируется случайно при диспансерных обследованиях либо обнаруживается больными [3].
Выделяют общие и специфические проявления большинства гельминтозов, которые объясняются особенностями жизненного цикла отдельных паразитов [2].
Адрес для переписки с авторами: Шадрин О.Г.
E-mail: [email protected]
© Шадрин О.Г., Ковальчук А.А., Дюкарева С.В.,
Фисун ВЛ., 2015 © «Здоровье ребенка», 2015 © Заславский А.Ю., 2015
артралгии, миалгии, абдоминальные боли, лимфа-денопатии, катаральные явления и более тяжелые поражения дыхательных путей. При массивной инвазии на неблагоприятном преморбидном фоне могут развиваться аллергический миокардит, пневмония и плеврит, менингоэнцефалит, гепатит.
Нередко миграционная стадия гельминтоза протекает под масками аллергических заболеваний кожи и слизистых — это специфические проявления.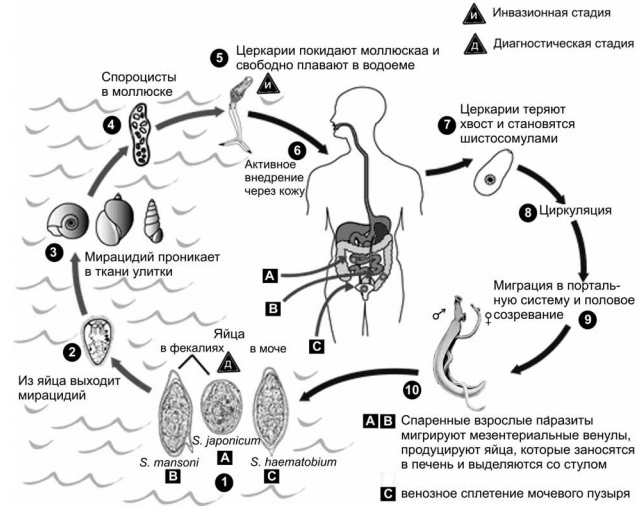 У врача должен вызвать сомнение диагноз атопического дерматита у ребенка без предшествующего аллергического анамнеза, появление множественных положительных аллергопроб. В то же время нельзя отрицать факт коморбидности гельминтозов и аллергических заболеваний. Антигены гельминтов и продукты их жизнедеятельности, например аскарон, выделяемый аскаридами, вызывают сенсибилизацию, поэтому гельминтозы ассоциируются с аллергической патологией. Так, у детей с атопическим дерматитом гельминтозы обнаруживаются в 52,9 % случаев, что в 4 раза выше показателя у детей без аллергического фона. Достаточно специфическими признаками ранней стадии гельминтозов являются гиперэозинофилия до 50 %, значительное повышение уровней общего иммуноглобулина Е в крови и эозинофильного катионного белка [2, 8].
У врача должен вызвать сомнение диагноз атопического дерматита у ребенка без предшествующего аллергического анамнеза, появление множественных положительных аллергопроб. В то же время нельзя отрицать факт коморбидности гельминтозов и аллергических заболеваний. Антигены гельминтов и продукты их жизнедеятельности, например аскарон, выделяемый аскаридами, вызывают сенсибилизацию, поэтому гельминтозы ассоциируются с аллергической патологией. Так, у детей с атопическим дерматитом гельминтозы обнаруживаются в 52,9 % случаев, что в 4 раза выше показателя у детей без аллергического фона. Достаточно специфическими признаками ранней стадии гельминтозов являются гиперэозинофилия до 50 %, значительное повышение уровней общего иммуноглобулина Е в крови и эозинофильного катионного белка [2, 8].Для поздних стадий или хронических гельминто-зов характерны железодефицитная анемия, полиги-повитаминозы, изменения реактивности организма, снижение аппетита, отставание в физическом развитии.
Высокая частота анемий при гельминтозах объясняется рядом факторов: для осуществления своей жизнедеятельности гельминты активно используют железо, поступающее с пищей. Сопутствующий дисбактериоз кишечника при гельминтозах усугубляет железо- и витаминодефицитные состояния. Дефицитные состояния у детей развиваются постепенно и проявляются бледностью, сухостью и шелушением кожи, заедами, выпадением и ломкостью волос, утомляемостью, повышенной возбудимостью или слабостью, снижением аппетита с последующим отставанием в физическом развитии. Под влиянием продуктов жизнедеятельности гельминтов повышается или понижается порог возбудимости, изменяются поведенческие реакции, хроническая интоксикация приводит к астенизации, невротическим состояниям, энурезу и энкопрезу.
В 75,3 % случаев паразитозы сопровождаются различными заболеваниями желудочно-кишечного тракта (чаще болями в животе, диспептическими симптомами и нарушением всасывания в кишечнике). Под влиянием продуктов жизнедеятельности гельминтов нарушается баланс в организме, запускаются многие патологические процессы, ведущие к рецидивированию болезней и их хронизации.
Под влиянием продуктов жизнедеятельности гельминтов нарушается баланс в организме, запускаются многие патологические процессы, ведущие к рецидивированию болезней и их хронизации.
Таким образом, сложность проблемы своевременной диагностики паразитоза заключается во многих факторах, таких как стадия заболевания,
Диагностика гельминтозов должна включать предварительную клиническую оценку в сочетании с лабораторными методами. Это макро- и микроскопические исследования фекалий, биологических жидкостей и тканей организма, серологические исследования, клинико-лабораторные, эндоскопические, ультразвуковые методы и др. [4, 8].
Наиболее распространенным методом, используемым в практике, является копрологическое исследование. Его осуществляют макроскопически (осмотр с помощью увеличителя) и микроскопически (с помощью микроскопа), когда яйца гельминта и личинки определяются количественным и качественным путем. С целью повышения эффективности диагностики используют толстый мазок испражнений с целлофаном (метод Като). При малой интенсивности инвазии более эффективен метод по Шульману. Кроме того, применяют различные способы и приемы, увеличивающие возможности микроскопии (метод обогащения), методы осаждения, флотации.
Его осуществляют макроскопически (осмотр с помощью увеличителя) и микроскопически (с помощью микроскопа), когда яйца гельминта и личинки определяются количественным и качественным путем. С целью повышения эффективности диагностики используют толстый мазок испражнений с целлофаном (метод Като). При малой интенсивности инвазии более эффективен метод по Шульману. Кроме того, применяют различные способы и приемы, увеличивающие возможности микроскопии (метод обогащения), методы осаждения, флотации.
Методы диагностики гельминтозов делят на прямые (метод нативного мазка; метод обогащения Фюллеборна, Калантарян; метод Бермана для диагностики стронгилоидоза, анкилостомоза) и специальные (соскоб из перианальных складок; метод Гиммельфарба; исследование анальной слизи; изучение обсемененных кожных покровов с помощью липкой ленты; исследование мокроты (аскариды, анкилостомы, стронгилоиды), желчи (лямблии, фасциолы, анкилостомы, описторхи), мочи (мочеполовой шистосомоз), биоптатов тканей (трихинеллы)) [4, 8].
Информативным является общеклинический анализ крови:
— анемия — аскаридоз, дифиллоботриоз, трихо-цефалез, тениаринхоз, тениоз;
— эозинофилия — аскаридоз, токсокароз, строн-гилоидоз, анкилостомидоз.
Толстая капля крови — филяриоз.
Важны инструментальные методы исследования: офтальмоскопия — при цистицеркозе глаз; рентгенография и ультразвуковое исследование органов брюшной полости — при эхинококкозе, ци-стицеркозе и трихинозе.
Иммунологические методы диагностики и серологическое исследование в последнее время нашли более широкое применение и основаны на обнаружении в крови специфических антител и антигенов определенных паразитов с помощью специальных наборов химических реагентов и препаратов-маркеров. Кроме того, определение в крови антител к нематодам с помощью лабораторных методов актуально только в первые 1—2 месяца (т.е. в личиночной стадии). Позже антитела исчезают из системного кровотока, сосредоточиваются в просвете кишечника и вырабатываются уже непосредственно
Кроме того, определение в крови антител к нематодам с помощью лабораторных методов актуально только в первые 1—2 месяца (т.е. в личиночной стадии). Позже антитела исчезают из системного кровотока, сосредоточиваются в просвете кишечника и вырабатываются уже непосредственно
в кишечной стенке. Более ценными в данной ситуации являются определение уровня специфических иммуноглобулинов в просвете пищеварительного тракта и полимеразная цепная реакция. Очень часто для диагностики гельминтозов используют одновременно несколько методов. При некоторых видах гельминтозов ведущим в диагностике является иммунологический метод, в частности иммуно-ферментный анализ. В отношении определенных видов гельминтоза не существует надежных методов диагностики. Так, диагностика глазного токсо-кароза происходит только при гистологическом исследовании. Окончательный диагноз гельминтоза устанавливают при обнаружении возбудителя или его серологического маркера. Эпидемиологический анамнез, клинические проявления и данные параклинических исследований позволяют лишь заподозрить гельминтоз, а клинические симптомы имеют диагностическую значимость только при массивной инвазии и ответной реакции организма на них.
Вышеизложенное делает особо актуальным вопрос лечения гельминтозов у детей. В настоящее время в арсенале врачей есть большое количество антигельминтных препаратов. При выборе метода лечения гельминтозов необходимо учитывать его специфическую активность, эффективность, переносимость и фоновое состояние организма ребенка [5].
Классификация противоглистных средств [7]:
1. По механизму действия:
— клеточные яды: четыреххлористый этилен;
— нарушающие нервно-мышечную передачу у круглых червей: этиленпиперазин, левамизол, на-фтамон, альбендазол;
— нарушающие нервно-мышечную передачу у плоских червей и разрушающие их покровные ткани: препараты мужского папоротника, фенасал, альбендазол;
— нарушающие энергетические процессы гельминтов: пирвиния памоат, левамизол, кислород, мебендазол, альбендазол.
По спектру действия:
— средства широкого спектра действия;
— препараты для лечения кишечных гельминто-зов;
— средства для лечения внекишечных гельмин-тозов.
Антигельминтные препараты должны соответствовать следующим требованиям: высокая активность, широкий спектр действия, отсутствие резорбтивного эффекта и повреждающего воздействия на органы и ткани человека, быстрое выведение из организма, отсутствие кумуляции. При выборе антигельминтного препарата также важны эффективность и быстрота лечения, удобство дозировки и комфортность приема, доступная цена [6, 7].
В настоящее время в мире одним из наиболее распространенных средств является альбендазол,
который соответствует всем этим требованиям, назначается как при моно-, так и при полиинвазиях, оказывая ларвицидное, овицидное и вермицидное действие (уничтожает взрослых паразитов, яйца и их личинки). Это дает возможность широкого использования альбендазола при проведении не только лечения, но и профилактических мероприятий. В Украине выпускается отечественный альбен-дазол — Альдазол (Киевский витаминный завод), имеющий комплексный механизм воздействия на паразитов, а именно: ингибирует полимеризацию бета-тубулина, разрушает цитоплазматические микроканальцы клеток кишечного тракта гельминта, подавляет утилизацию глюкозы, блокирует передвижение секреторных гранул в мышечных клетках круглых гельминтов. Выпускается в виде таблеток, покрытых пленочной оболочкой, обеспечивающей комфортный прием без жевания, но при необходимости возможно измельчение таблеток. Во время лечения препаратом Альдазол не требуется проведения очистительных клизм, приема слабительных средств и специальной диеты.
Это дает возможность широкого использования альбендазола при проведении не только лечения, но и профилактических мероприятий. В Украине выпускается отечественный альбен-дазол — Альдазол (Киевский витаминный завод), имеющий комплексный механизм воздействия на паразитов, а именно: ингибирует полимеризацию бета-тубулина, разрушает цитоплазматические микроканальцы клеток кишечного тракта гельминта, подавляет утилизацию глюкозы, блокирует передвижение секреторных гранул в мышечных клетках круглых гельминтов. Выпускается в виде таблеток, покрытых пленочной оболочкой, обеспечивающей комфортный прием без жевания, но при необходимости возможно измельчение таблеток. Во время лечения препаратом Альдазол не требуется проведения очистительных клизм, приема слабительных средств и специальной диеты.
Схемы лечения гельминтозов должны включать комплексный подход и этапность, так как целью является не только уничтожение паразитов, но и ликвидация последствий их жизнедеятельности. Так, в статье [9] авторы доказали, что паразитарные инвазии матери передаются интраплацентарно плоду. В связи с этим важно проводить дегельминтизацию матерей перед планированием беременности. В.А. Склярова [10] доказала эффективность применения отечественного противоглистного препарата Альдазол в комплексном лечении ассоциированных с гельминтозами гинекологических заболеваний. В связи с этим дегельминтизация матери имеет прямое отношение к здоровью ребенка.
Так, в статье [9] авторы доказали, что паразитарные инвазии матери передаются интраплацентарно плоду. В связи с этим важно проводить дегельминтизацию матерей перед планированием беременности. В.А. Склярова [10] доказала эффективность применения отечественного противоглистного препарата Альдазол в комплексном лечении ассоциированных с гельминтозами гинекологических заболеваний. В связи с этим дегельминтизация матери имеет прямое отношение к здоровью ребенка.
С данными отечественных ученых перекликаются рекомендации ВОЗ от 17.06.2015 г. [11], изданные на основе двойного слепого плацебо-контролируе-мого рандомизированного исследования дегельминтизации в раннем послеродовом периоде. ВОЗ рекомендует проведение дегельминтизации единой дозой альбендазола у женщин репродуктивного возраста из группы высокого риска инфицирования нематодами. В исследовании также доказана связь между инфицированием гельминтами кормящих матерей и развитием у них анемии, которая приводит к гиполактазии и сокращению периода лактации [11].
Опыт применения альбендазола в педиатрии освещен достаточно широко отечественными учеными [2—6, 8]. Так, И.Б. Ершова и Г.Г. Бондаренко изучили эффективность применения альбендазо-ла в терапии аскаридоза и энтеробиоза у 77 детей в возрасте от 7 до 15 лет. Лечение альбендазолом приводило к раннему исчезновению патологических симптомов заболевания и способствовало нормализации клеточного иммунитета, восстановлению процессов липидной пероксидации и ферментативного звена антиоксидантной защиты [5].
Наш опыт применения отечественного препарата Альдазол позволяет констатировать его высокую эффективность при выявлении гельминтозов и у детей раннего возраста.
Список литературы
1. Печкуров Д.В., Тяжева А.А. Глистные инвазии у детей: клиническое значение, диагностика и лечение // Здоров ‘я УкраГни. — 2014. — № 3. — С. 49-50.
— 2014. — № 3. — С. 49-50.
2. Зайков С.В. Гельминтозы и аллергические заболевания // Клжчна iмунологiя. Алергологы. Iнфектологiя. — 2009. — № 2. — С. 1-12.
3. Майданник В.Г. Аскаридоз у детей // Здоров ‘я Украши. — 2012. — № 5. — С. 14-16.
4. Крамарев С.О. Гельмштози у дтей // Украинская медицинская газета. — 2006. — № 7—8. — С. 31.
5. Ершова И.Б., Бондаренко Г.Г. Лечение гельминтозов у детей // Современная педиатрия. — 2005. — № 1 (6). — С. 3-5.
6. Бодня Е.И. Проблема профилактики паразитозов в современных условиях // Новости медицины и фармации. — 2005. — № 20-22. — С. 8.
7. Чекман И. С. Фармакология. Рецептура. Практические занятия. — К.: ООО «Рада», 2003. — 831 с.
8. Майданник В.Г, Хайтович Н.В., Юхименко Г.Г. Гельминтозы у детей. — К.: Дорадо-Друк, 2012. — 601 с.
9. Бодня Е.И, Склярова В.А. Врожденная передача кишечных нематодозов//Актуальна iнфектологiя. — 2013. — № 1 (1).
10. Склярова В.О. Застосування протиглисного препарату Альдазол в комплексному лжувант асоцшованих з гельмштозами гiнекологiчних захворювань // Здоровье женщины. — 2011. — № 3 (59).
11. Mofid L.S., Casapia M, Montresor A. et al. Maternal De-worming Research Study (MADRES) protocol: a double-blind, placebo-controlled randomised trial to determine the effectiveness of de-worming in the immediate postpartum period// BMJ Open. — 2015, Jun 17. — 5 (6).
Получено 26.12.14 ■
Шадр1н О.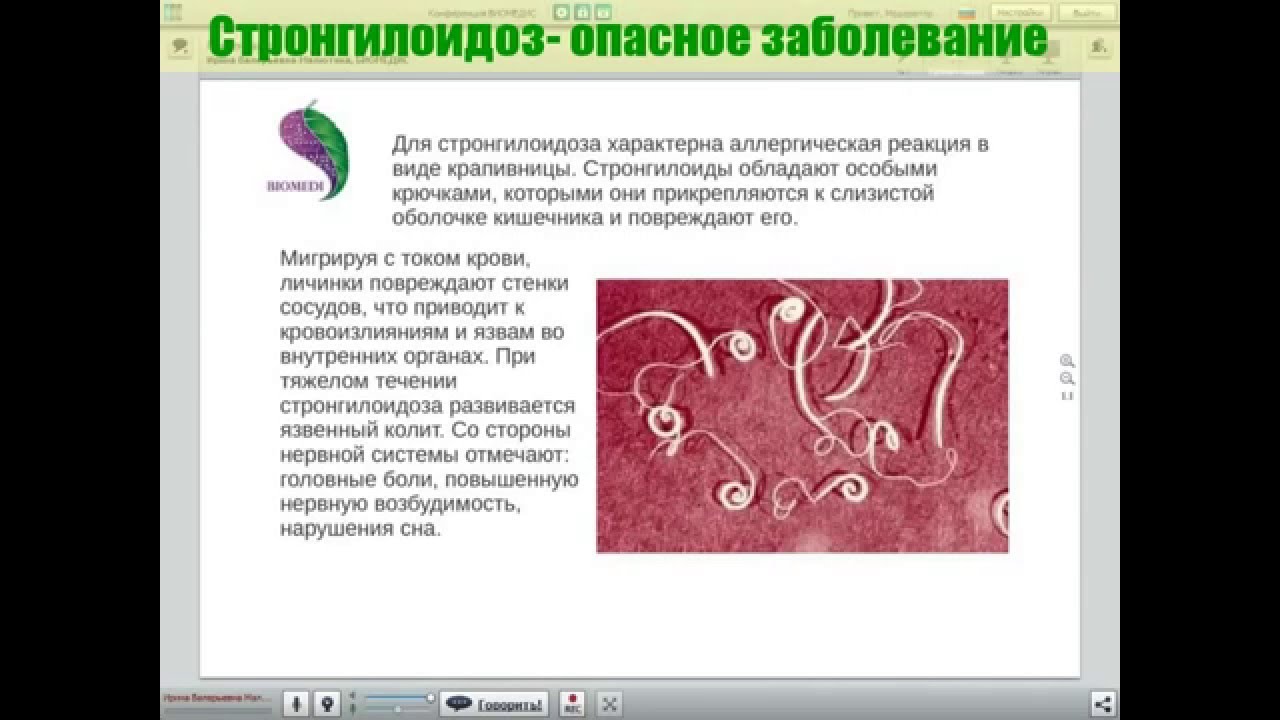 ван-ня.
ван-ня.
Shadrin O.H., KovalchukA.A., Diukareva S.V., Fisun V.M. State Institution «Institute of Pediatrics, Obstetrics and Gynecology of National Academy of Medical Sciences of Ukraine», Kyiv, Ukraine
PRACTICAL QUESTIONS OF DIAGNOSIS AND TREATMENT OF HELMINTHIASIS IN CHILDREN
Summary. The article presents basic information about human helminthiasis. The questions of aetiology, clinical presentation, diagnosis and treatment of the most common helminthiasis, features of their course in children are considered from modern perspectives.
Key words: children, helminthiasis, diagnosis, treatment.
Пройти анализы на паразитов в Екатеринбурге
Паразитарные заболевания остаются самыми недооцененными в мире по уровню опасности для здоровья. Патологии имеют универсальную клиническую картину, подходящую под любые штаммы гриппа, ОРЗ, ОРВИ и других видов сезонных простуд. Типичные признаки – головокружение, слабость, тошнота, субфебрильная лихорадка, насморк, сухой кашель. Анализ крови на паразитов поможет подтвердить или исключить из анамнеза гельминтозную инфекцию, что крайне важно в разработке эффективной схемы лечения. Стандартный комплекс исследований включает соскоб, выявление в кале яиц гельминтов и тест на антитела. Сдать кровь на паразитов рекомендуется каждые 6-12 месяцев, чтобы полностью исключить вероятность развития опасных, тяжело диагностируемых осложнений.
Патологии имеют универсальную клиническую картину, подходящую под любые штаммы гриппа, ОРЗ, ОРВИ и других видов сезонных простуд. Типичные признаки – головокружение, слабость, тошнота, субфебрильная лихорадка, насморк, сухой кашель. Анализ крови на паразитов поможет подтвердить или исключить из анамнеза гельминтозную инфекцию, что крайне важно в разработке эффективной схемы лечения. Стандартный комплекс исследований включает соскоб, выявление в кале яиц гельминтов и тест на антитела. Сдать кровь на паразитов рекомендуется каждые 6-12 месяцев, чтобы полностью исключить вероятность развития опасных, тяжело диагностируемых осложнений.
В медицинском центре «Шанс» можно сдать анализы на паразитов в Екатеринбурге и получить точные результаты в течение 1-7 дней. Это позволит лечащему врачу поставить достоверный диагноз и назначить адекватное лечение. В лаборатории клиники проводятся исследования на все виды глистных инвазий. Анализы на паразитов (кал и кровь) помогают выявить:
-
бычьего и свиного цепня;
-
кишечную нематоду, в том числе остриц;
-
паразитических человечьих червей аскарид;
-
ленточных червей;
-
жгутиковых протистов (лямблии).

Комплексный анализ на паразитов по крови в Екатеринбурге позволяет обнаружить простейших гельминтов, которые обитают за пределами ЖКТ и не доступны к обнаружению в каловых массах. Исследование крови на антитела классов IgM и IgG имеют самый высокий уровень точности, достигающий 99%. Тесты помогают диагностировать такие бессимптомные, но крайне опасные заболевания, как токсоплазмоз, трихинелла, демодекс, лямблиоз. Своевременно проведенный анализ крови на паразитов поможет в короткие сроки устранить инфекцию.
KDL. Паразитарные инвазии (гельминты). Анализы и цены
Алергология. ImmunoCAP. Индивидуальные аллергены, IgE
Аллергокомпоненты ImmunoCAP
Аллергокомпоненты деревьев
Аллергокомпоненты животных и птиц
Аллергокомпоненты плесени
Аллергокомпоненты трав
Пищевые аллергокомпоненты
Аллергология. ImmunoCAP. Комплексные исследования IgE (результат по каждому аллергену)
Аллергология. ImmunoCAP. Панели аллергенов IgE, скрининг (результат СУММАРНЫЙ)
ImmunoCAP. Панели аллергенов IgE, скрининг (результат СУММАРНЫЙ)
Аллергология. ImmunoCAP. Фадиатоп
Аллергология. Immulite. Индивидуальные аллергены
Аллергены гельминтов, IgE
Аллергены грибов (кандида и плесневых), IgE
Аллергены деревьев, IgE
Аллергены животных и птиц, IgE
Аллергены клещей домашней пыли, IgE
Аллергены лекарств и химических веществ, IgE
Аллергены насекомых, IgE
Аллергены пыли, IgE
Аллергены ткани, IgE
Аллергены трав, IgE
Бактериальные аллегены (стафилококк), IgE
Пищевые аллергены, IgE
Пищевые аллергены, IgG
Аллергология. Immulite. Комплексы аллергенов, IgE (результат по каждому аллргену)
Аллергология. Immulite. Панели аллергенов, скрининг (результат СУММАРНЫЙ)
Аллергены деревьев, IgE (панель)
Аллергены животных и птиц, IgE (панель)
Аллергены трав, IgE (панель)
Ингаляционные аллергены, IgE (панель)
Пищевые аллергены, IgE (панель)
Аллергология. Immulite. Панели пищевых аллергенов IgG (результат СУММАРНЫЙ)
Immulite. Панели пищевых аллергенов IgG (результат СУММАРНЫЙ)
Аллергология. ImmunoCAP. Индивидуальные аллергены, IgE
Аллергены деревьев, IgE
Аллергены животных и птиц, IgE
Аллергены пыли, IgE
Аллергены трав, IgE
Пищевые аллергены, IgE
Аллергология. RIDA. Комплексы аллергенов, IgE
Аллергология. RIDA. Комплексы аллергенов, IgE (результат по каждому аллргену)
Аллергология. Местные анестетики, IgE
Биохимические исследования крови
Диагностика анемий
Липидный обмен
Обмен белков
Обмен пигментов
Обмен углеводов
Специфические белки
Ферменты
Электролиты и микроэлементы
Биохимические исследования мочи
Разовая порция мочи
Суточная порция мочи
Витамины, аминокислоты, жирные кислоты
Гематология
Гемостаз (коагулограмма)
Генетические исследования
HLA-типирование
Исследование генетических полиморфизмов методом пиросеквенирования
Исследование генетических полиморфизмов методом ПЦР
Молекулярно-генетический анализ мужского бесплодия
Гистологические исследования
Гистологические исследования лаборатории UNIM
Гормоны биологических жидкостей
Гормоны гипофиза и гипофизарно-адреналовой системы
Гормоны крови
Гормоны гипофиза и гипофизарно-адреналовой системы
Маркеры остеопороза
Пренатальная диагностика
Ренин-альдостероновая система
Тесты репродукции
Функция органов пищеварения
Функция щитовидной железы
Гормоны мочи
Диагностика методом ПЦР
COVID-19
Андрофлор, иследование биоценоза (муж)
Вирус герпеса VI типа
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус простого герпеса I, II типа
Вирус Эпштейна-Барр
Вирусы группы герпеса
Возбудитель туберкулеза
ВПЧ (вирус папилломы человека)
Грибы рода кандида
Листерии
Парвовирус
Респираторные инфекции
Стрептококки (вкл. S.agalactie)
S.agalactie)
Токсоплазма
Урогенитальные инфекции, ИППП
Урогенитальные инфекции, комплексные исследования
Урогенитальные инфекции, условные патогены
Фемофлор, исследование биоценоза (жен)
Флороценоз, иследование биоценоза (жен)
Цитомегаловирус
Диагностика методом ПЦР, кал
Кишечные инфекции
Диагностика методом ПЦР, клещ
Клещевые инфекции
Диагностика методом ПЦР, кровь.
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус простого герпеса I, II типа
Вирус Эпштейна-Барр
ВИЧ
Возбудитель туберкулеза
Гепатит D
Гепатит G
Гепатит А
Гепатит В
Гепатит С
Листерии
Парвовирус
Токсоплазма
Цитомегаловирус
Жидкостная цитология
Изосерология
Иммуногистохимические исследования
Иммунологические исследования
Иммунограмма (клеточный иммунитет)
Интерфероновый статус, базовое исследование
Интерфероновый статус, чувствительность к препаратам
Оценка гуморального иммунитета
Специальные иммунологические исследования
Исследование абортуса
Исследование мочевого камня
Исследование парапротеинов. Скрининг и иммунофиксация
Скрининг и иммунофиксация
Исследования слюны
Исследования слюны
Комплексные исследования
Лекарственный мониторинг
Маркеры аутоиммунных заболеваний
Антифосфолипидный синдром (АФС)
Аутоиммунные заболевания легких и сердца
Аутоиммунные неврологические заболевания
Аутоиммунные поражения ЖКТ и целиакия
Аутоиммунные поражения печени
Аутоиммунные поражения почек и васкулиты
Аутоиммунные эндокринопатии и бесплодие
Диагностика артритов
Пузырные дерматозы
Системные ревматические заболевания
Эли-тесты
Микробиологические исследования (посевы)
Посев крови на стерильность
Посев на гемофильную палочку
Посев на грибы (Candida)
Посев на грибы (возбудители микозов кожи и ногтей)
Посев на дифтерию
Посев на микоплазмы и уреаплазмы
Посев на пиогенный стрептококк
Посев на стафилококк
Посевы кала
Посевы мочи
Посевы на микрофлору (конъюнктива)
Посевы на микрофлору (отделяемое)
Посевы на микрофлору (урогенитальный тракт женщины)
Посевы на микрофлору (урогенитальный тракт мужчины)
Посевы на микрофлору ЛОР-органы)
Ускоренные посевы с расширенной антибиотикограммой
Неинвазивная диагностика болезней печени
Программы неинвазивной диагностики болезней печени
Неинвазивный пренатальный ДНК-тест (НИПТ)
Неинвазивный пренатальный тест (пол/резус плода)
Общеклинические исследования
Исследование назального секрета
Исследование секрета простаты
Исследования кала
Исследования мочи
Исследования эякулята
Микроскопическое исследование биологических жидкостей
Микроскопия на наличие патогенных грибов и паразитов
Микроскопия отделяемого урогенитального тракта
Онкогематология
Иммунофенотипирование при лимфопролиферативных заболеваниях
Миелограмма
Молекулярная диагностика миелопролиферативных заболеваний
Цитохимические исследования клеток крови и костного мозга
Онкогенетика
Онкомаркеры
Пищевая непереносимость, IgG4
Полногеномные исследования и панели наследственных заболеваний
Пренатальный скрининг
Серологические маркеры инфекций
Аденовирус
Бруцеллез
Вирус HTLV
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус Коксаки
Вирус кори
Вирус краснухи
Вирус эпидемического паротита
Вирус Эпштейна-Барр
Вирусы простого герпеса I и II типа
ВИЧ
Гепатит D
Гепатит А
Гепатит В
Гепатит Е
Гепатит С
Грибковые инфекции
Дифтерия
Кишечные инфекции
Клещевые инфекции
Коклюш и паракоклюш
Коронавирус
Менингококк
Паразитарные инвазии
Парвовирус
Респираторные инфекции
Сифилис
Столбняк
Токсоплазма
Туберкулез
Урогенитальные инфекции
Хеликобактер
Цитомегаловирус
Специализированные лабораторные исследования.
Дыхательный тест
Микробиоценоз по Осипову
Тяжелые металлы и микроэлементы
Тяжелые металлы и микроэлементы в волосах
Тяжелые металлы и микроэлементы в крови
Тяжелые металлы и микроэлементы в моче
Услуги
Выезд на дом
ЭКГ
Установление родства
Химико-токсикологические исследования
Хромосомный микроматричный анализ
Цитогенетические исследования
Цитологические исследования
Глистная инвазия (паразиты) у детей
Заражение детей паразитами, к сожалению, всегда было большой проблемой. В прошлые времена, рожденные в СССР помнят, что детям в садах два раза в год давали препараты от глистов с целью общей профилактики, но тогда никто не спрашивал у родителей информированное согласие. Конечно, это было не совсем правильно, так как у ребенка могла быть, например, аллергия на этот препарат.
Хотя, по опыту практического педиатра и аллерголога я могу подтвердить мнение, что весьма часто наиболее весомой причиной внезапной аллергии у ребенка является как раз глистная (паразитарная) инвазия.
Какие глисты поражают детей
Самыми частыми возбудителями гельминтозов у детей являются, безусловно, острицы. Это такие маленькие паразиты, плохо различимые невооруженным глазом, однако вызывающие сильнейший зуд в области анального прохода и вокруг него обычно в ранние утренние часы. В испражнениях у ребенка они могут быть незаметны, так как выползают наружу только для откладывания яиц, и соответственно в обычном анализе кала (копрологии) чаще всего не обнаруживаются. Для диагностики энтеробиоза (остриц) существует анализ, который называется перианальный соскоб. Но забор материала для этого исследования должен проходить утром, до подмывания ребенка и до посещения им туалета, что бывает очень затруднительно.
Токсокароз у детей
Специфической формой гельминтозов, поражающих не только детей, но и взрослых, является токсокароз. Токсокара – это паразит, основным хозяином которого являются животные, но для человека опасны в основном только токсокары, обитающие в кишечнике у собак. В кишечнике человека токсокары паразитируют только в личиночной стадии, не выделяясь наружу. Зато после проглатывания человеком эти личинки паразитов-токсокар проникают через слизистую оболочку тонкой кишки в кровеносные сосуды и разносятся с кровотоком по всему организму, вплоть до головного мозга.
В кишечнике человека токсокары паразитируют только в личиночной стадии, не выделяясь наружу. Зато после проглатывания человеком эти личинки паразитов-токсокар проникают через слизистую оболочку тонкой кишки в кровеносные сосуды и разносятся с кровотоком по всему организму, вплоть до головного мозга.
Такое распространение личинок паразитов по разным органам называется висцеральной формой заболевания, и проявляется обычно стойким субфебрильным повышением температуры тела до 37.5 – 37.6 градусов, но при массивной инвазии лихорадка может быть высокой с пиком во второй половине дня и сопровождаться ознобом.
Как правило, одновременно с лихорадкой выявляются симптомы поражения дыхательных путей: кашель, бронхит, иногда – обструктивный бронхит и даже приступ бронхоспазма по типу астматического. Могут наблюдаться рецидивирующие обструктивные бронхиты.
Поражение кожи при токсокарозе встречается реже и отличается полиморфностью высыпаний: от эритем (красных пятен) до пятнисто-папулезных элементов и даже волдырей по типу крапивницы.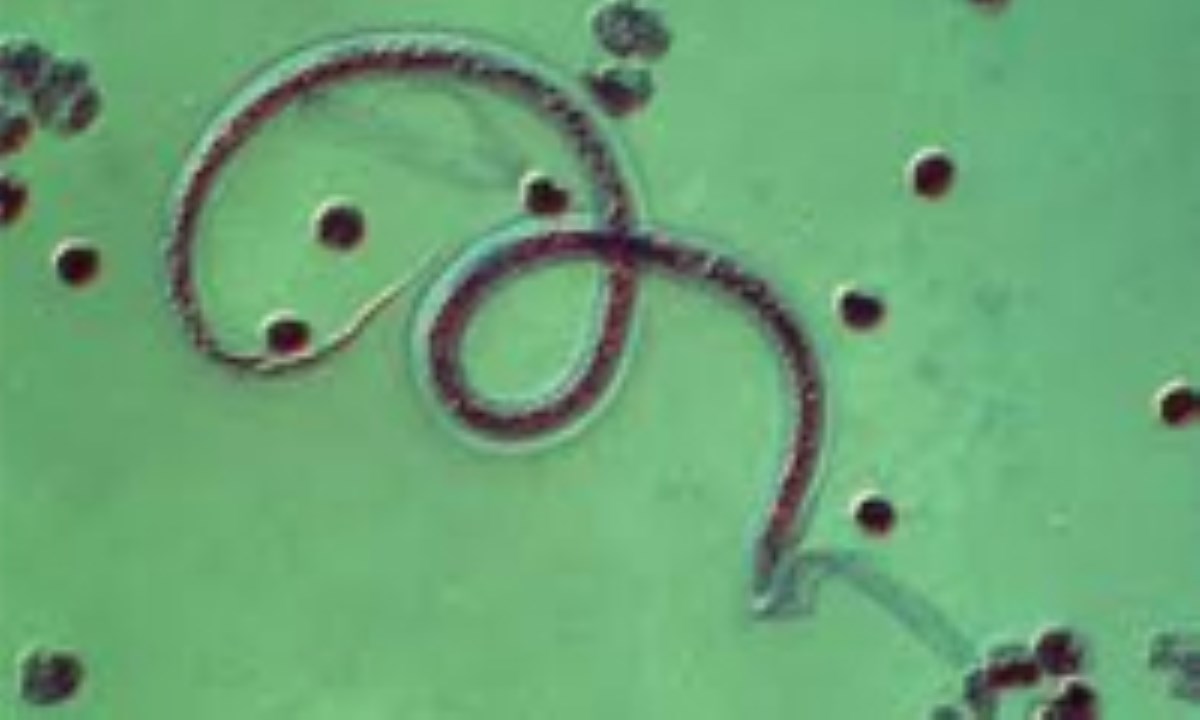
Диагностика токсокароза у детей
Одним из постоянных лабораторных изменений в клиническом анализе крови у больных токсокарозом является стойкий лейкоцитоз и стойкая длительная эозинофилия – повышение числа эозинофилов в крови до 30 – 90%.
Также отмечается высокий уровень общего иммуноглобулина Е.
Наиболее информативным анализом в диагностике токсокароза является иммунологический метод, а именно определение титра специфических иммуноглобулинов G – антител к токсокаре методом ИФА, обладающим высокой чувствительностью.
Лечение токсокароза
Лечение токсокароза должен проводить только врач, прошедший специальную подготовку, обычно — инфекционист-паразитолог или врач гастроэнтеролог или педиатр, прошедший специальный курс подготовки по клинической паразитологии. Заниматься самолечением в данной ситуации крайне опасно, а с учетом того, что заражение гельминтами часто происходит от домашнего животного, то на прием к доктору необходимо обращаться всей семьей, включая четвероногого питомца, которого следует обязательно показать ветеринару.
Видно ли паразитов на УЗИ брюшной полости? Признаки наличия паразитов в организме, какие методы исследования подходят
Оглавление
Глисты (гельминты) – группа паразитических организмов (червей), которые обитают в человеческом теле и вызывают заболевания и поражение различных органов: печени, желудочно-кишечного тракта и других. Также они могут существовать в частях тел животных, растений.
Заразиться паразитами возможно различными способами:
- При непосредственном контакте с зараженным человеком или животным
- Из-за употребления зараженных продуктов – плохо обработанное мясо, птица, рыба
- Через воду, почву, песок (в том числе во время плавания в открытом водоеме)
- Укусы насекомых (кроме тех, кто таким методом откладывает собственные личинки)
Дети подвержены риску заражения гораздо сильнее, чем взрослые, за счет более слабого иммунитета.
Признаки наличия паразитов в организме
Симптомы заражения гельминтами бывают двух видов: видимые и скрытые.
Первая группа состоит из таких явлений:
- Зуд и жжение в области заднего прохода
- Потеря веса, которая не сопровождается очевидными причинами
- Анемия, слабость
- Постоянная усталость
Вторая же представляет собой обострение ряда иных заболеваний:
- Инфекция – гайморит, стоматит и иные
- Обострение хронических недомоганий
- Признаки аллергии – зуд, высыпания, ринит
- При появлении кишечных паразитов проявляется расстройство желудочно-кишечного тракта – рвота, боли в области живота, понос или запор
- Интоксикация и сопутствующее ей ослабление организма – головокружения, тошнота, мигрень, угнетение нервной системы
Можно ли увидеть гельминтов на УЗИ?
Ультразвуковое исследование – анализ при помощи воздействия звуковых волн высокой частоты, которые испускаются датчиком. Его действие основано на том, что ткани человеческих органов имеют отличную друг от друга структуру и поэтому по-разному отражают такие волны. Результаты отображаются на мониторе врача-диагноста в реальном времени.
Его действие основано на том, что ткани человеческих органов имеют отличную друг от друга структуру и поэтому по-разному отражают такие волны. Результаты отображаются на мониторе врача-диагноста в реальном времени.
Это одно из самых безопасных обследований, которое можно проводить очень часто.
УЗИ брюшной полости позволяет обнаружить паразитов, а также изменения органов, которые эти существа провоцируют. Некоторые виды гельминтов отображаются сами по себе. В иных случаях их можно обнаружить по относительным признакам, которые ультразвук помогает выявить в качестве патологических изменений в органах.
Это могут быть образования или воспаления в печени, поджелудочной железе, желчном пузыре и даже легких и мозге человека.
В отличие от иных способов, данный метод позволяет обнаружить паразитов и в тех случаях, когда они находятся не в желудочно-кишечном тракте. Если ранее наличие глистов уже было установлено, УЗИ можно использовать для нахождения мест их локализации, а также определить обширность поражения.
Какие органы обследуют при подозрении на гельминтов
При обследовании пациента при помощи УЗИ брюшной полости можно обнаружить глистов или результаты их жизнедеятельности. Они располагаются в таких органах, как:
- Печень
- Желчный пузырь и протоки
- Поджелудочная железа
- Желудочно-кишечный тракт
При наличии предпосылок стоит осмотреть при помощи ультразвука и иные органы:
- Мышцы
- Легкие
- Мозг
УЗИ помогает определить структуру вышеперечисленных органов, их однородность, наличие или отсутствие в них новообразований, кист и иных нарушений, а также патологическое увеличение или уменьшение их размеров. При появлении симптомов различных заболеваний данный анализ способствует уточнению клинической картины и более точной постановке диагноза и выяснению причин патологического состояния органов.
Признаки паразитов на ультразвуковой сонограмме
При обследовании организма при помощи УЗИ брюшной полости на наличие глистов врач обращает внимание на следующие изменения в строении органов:
- Увеличение печени – оно может стать свидетельством поражения паразитами, которые могут спровоцировать проявление ранее не диагностированного или обострение уже обнаруженного гепатита
- Проблемы в функционировании желчного пузыря и его протоков
- Наличие плотных, воспаленных кист
- Различного рода уплотнения и узлы в поджелудочной железе
Некоторые признаки поражения могут быть найдены и в виде проблем с иными органами:
- Поражение и воспаление легких
- Нарушения в работе мозга
Какие еще методы исследования следует применять?
Часто на УЗИ брюшной полости отображаются не сами паразиты, а признаки их наличия и жизнедеятельности. Поэтому необходимо провести комплекс анализов, не ограничиваясь только ультразвуком.
Поэтому необходимо провести комплекс анализов, не ограничиваясь только ультразвуком.
В группу обследований при подозрении на гельминтов входят:
- Анализ кала на содержание данных организмов и их яиц
- Забор крови на степень содержания эозинофилов – тип лейкоцитов, который убивает чужеродные белки
- Исследование мочи
- Анализ содержимого кишечника
- Исследование желчного пузыря
- Осмотр мышечной ткани
- Состав отделяющейся мокроты из бронхов и легких
- Компьютерная томография – используют и при поиске паразитов в головном мозге, легких, глазах
- Эндоскопия – с ее помощью можно обнаружить паразитов в кишечнике и желудке
- Рентген – чаще всего необходим при диагностике гельминтов в легких, так как в этом органе они наиболее отчетливо видны на результатах лучевой диагностики
Для постановки наиболее точного диагноза врачи рекомендуют использовать не только УЗИ, но и иные методы. Важнее всего, чтобы больной не занимался самолечением, а вовремя обратился к профессионалам, чтобы не навредить самому себе.
Важнее всего, чтобы больной не занимался самолечением, а вовремя обратился к профессионалам, чтобы не навредить самому себе.
Преимущества проведения процедуры в МЕДСИ
- Сеть клиник МЕДСИ проводит УЗИ брюшной полости для диагностики паразитов в 20-ти отделениях по всей Москве
- Опытные врачи проводят полный комплекс процедур для постановки наиболее точного диагноза и назначения корректного лечения обнаруженных заболеваний
- Для записи на прием существует «горячая линия» (по бесплатному телефону 8 (495) 7-800-500)
- В распоряжении персонала клиник современное оборудование для УЗИ и иных исследований, что повышает качество получаемых результатов и точность диагноза
Аллергические реакции при паразитозах у детей | Мазманян М.В., Тумольская Н.И.
Вповседневной практике педиатры нередко встречаются саллергической патологией, при которой выявляются положительные серологические реакции спаразитарными антигенами. Зачастую эти реакции трактуются неверно, что приводит ксерьезным диагностическим ошибкам инеадекватному лечению. Действительно, некоторые гельминтозы, особенно вострой стадии, могут сопровождаться различными аллергическими проявлениями, иногда они бывают единственными клиническими симптомами.
Зачастую эти реакции трактуются неверно, что приводит ксерьезным диагностическим ошибкам инеадекватному лечению. Действительно, некоторые гельминтозы, особенно вострой стадии, могут сопровождаться различными аллергическими проявлениями, иногда они бывают единственными клиническими симптомами.
Иммунологические механизмы защиты при паразитозах имеют свои особенности. Ход иммунологических реакций зависит от вида паразитарного возбудителя, стадии его развития, локализации, различных «стратегий», применяемых возбудителем для выживания [11].
Ткани и продукты обмена веществ паразита вследствие сложности строения и химического состава могут быть источником большого числа антигенов, которые классифицируют на эндогенные и экзогенные. Разнообразие антигенов в значительной мере определяет многообразие реакций гиперчувствительности, развивающихся в организме человека при инвазии гельминтами.
Иммунологические реакции при паразитозах характеризуются слабыми иммуногенностью и специфичностью, относительно слабой степенью напряженности иммунного ответа [1]. Для многих паразитарных возбудителей характерна межклеточная локализация. В большинстве случаев в теле хозяина они не размножаются, поэтому паразитарные возбудители в основном обладают слабой иммуногенностью.
Для многих паразитарных возбудителей характерна межклеточная локализация. В большинстве случаев в теле хозяина они не размножаются, поэтому паразитарные возбудители в основном обладают слабой иммуногенностью.
На протяжении своей жизни гельминт последовательно проходит ряд стадий развития, при этом перескок через стадию невозможен. Мы наблюдаем изменение антигенного состава гельминта в течение жизненного цикла, на каждую стадию организм человека откликается различным иммунным ответом. Гетерогенностью паразитарного антигенного комплекса определяется слабая специфичность иммунного ответа. При этом наибольшей напряженностью отличается иммунитет на личиночную стадию, что обусловлено высокой антигенной активностью секретов и экскретов личинок, особенно в период линьки.
Большинство гельминтов располагаются вне клетки и имеют немалые размеры, что обусловливает их слабую иммуногенность, делает невозможным уничтожение посредством фагоцитоза и создает трудности для элиминации.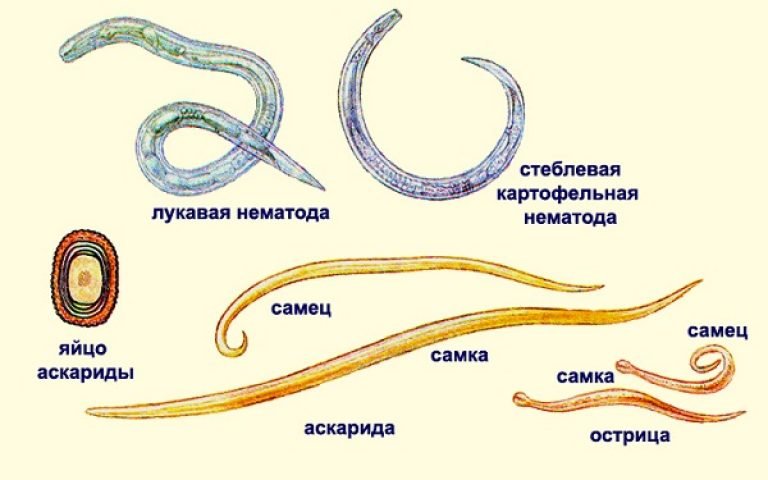
Фагоциты могут уничтожить гельминтов с помощью внеклеточного механизма, прикрепившись к ним своими Fc-γ-рецепторами. Так, натуральные клетки-киллеры способны поражать клетки-мишени, нагруженные антителами. Благодаря своим рецепторам они связывают антитела, образовавшие иммунные комплексы с антигенами на поверхности клеток-мишеней, т. е. реализуется антителозависимая клеточноопосредованная цитотоксичность (АЗКЦ) [28].
Паразит применяет целый ряд «уловок» для того, чтобы избежать иммунного ответа хозяина, направленного на изгнание паразита — в первую очередь иммуносупрессию. Подавлением активности иммунной системы человека сопровождаются все паразитарные болезни. Иммуноповреждающее действие особенно выражено при гельминтозах. Паразитарные болезни приводят к разнообразным формам приобретенного иммунодефицита, связанного с выключением ответа Т-системы иммунитета на любые антигены, включая антигены самого возбудителя заболевания (лейшманиозы, шистосомозы), и поликлональной активации В-системы (малярия, висцеральный лейшманиоз, африканский трипаносомоз, эхинококкоз, трихинеллез и т. д.), а также к менее выраженным дефектам иммунитета [26]. Например, протеины нематод связывают интегрин СR3 и ингибируют миграцию нейтрофилов, а личинки печеночного сосальщика выделяют фермент, который расщепляет антитела [8].
д.), а также к менее выраженным дефектам иммунитета [26]. Например, протеины нематод связывают интегрин СR3 и ингибируют миграцию нейтрофилов, а личинки печеночного сосальщика выделяют фермент, который расщепляет антитела [8].
Иммуносупрессия приводит к хронизации инфекции, создает риск развития других инфекций и онкологических заболеваний. Большая продолжительность индивидуальной жизни паразитов — это во многом компенсация за низкую вероятность нахождения нового хозяина [7]. Некоторые паразитозы (эхинококкоз) вызывают хронические поражения иммунной системы по типу трансплантационной болезни [10].
Для того чтобы избежать иммунного ответа со стороны хозяина, некоторые паразиты покрываются его антигенами. Например, у цестод тегумент включает белки хозяина, а трематоды всасывают его белки, что иммунологически воспринимается организмом хозяина как собственная ткань. Некоторые паразиты, например шистосомы, покрываются антигенами хозяина и тем самым избегают повреждений, вызванных его иммунными реакциями.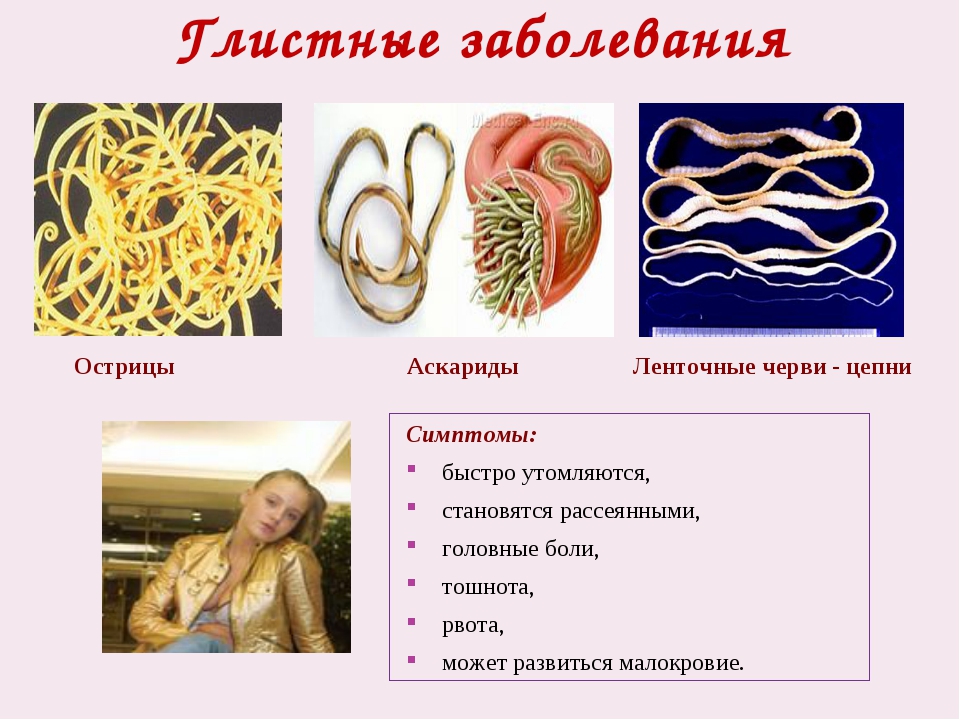 Линька приводит к изменению поверхности гельминта и ее антигенного состава, что, например, наблюдается у трематод, нематод [8].
Линька приводит к изменению поверхности гельминта и ее антигенного состава, что, например, наблюдается у трематод, нематод [8].
У некоторых паразитов можно наблюдать антигенную мимикрию, когда меняется антигенная структура гельминта, утрачиваются его рецепторы, вызывающие активность эффекторных механизмов иммунного ответа, приобретаются рецепторы, сходные с рецепторами хозяина, что изменяет его иммунный ответ. (Некоторые считают это адаптацией хозяина к паразиту.) Например, установлено наличие у гельминтов веществ, подобных групповым антигенам крови человека (системы АВО, Н) [5].
Протеин дисульфид изомераза (PDI), продуцируемая микро- и макрофиляриями Onchocerca volvulus (возбудителями онхоцеркоза — «речной слепоты»), идентична белку R-cognin, входящему в состав сетчатки глаза и основному белку мембраны фибробластов роговицы. Длительное паразитирование приводит к развитию кератита и слепоте. Парамиозин Trichinella spiralis служит индуктором развития миокардита и системных поражений иммунологической природы, что является следствием антигенного родства парамиозинов гельминтов и α-миозина сердечной мышцы человека [6]. Вследствие этого иммунитет при большинстве гельминтозов характеризуется относительно слабой степенью напряженности, особенно при однократном заражении малым количеством инвазионного материала.
Вследствие этого иммунитет при большинстве гельминтозов характеризуется относительно слабой степенью напряженности, особенно при однократном заражении малым количеством инвазионного материала.
Возбудители паразитозов избегают защитных механизмов организма, т. к. защищены физическим барьером. Именно таким барьером может служить формирующаяся совместно с организмом хозяина капсула вокруг гельминтов [12].
Личинка Echinococcus granulosus формирует 3-слойную оболочку, состоящую из внутренней зародышевой оболочки самой личинки, хитиновой кутикулы паразита и дополнительной наружной фиброзной капсулы, образующейся в результате реакции со стороны окружающих его тканей человека. Эта 3-слойная структура выполняет двоякую функцию, защищая паразита от воздействия хозяина и организм человека от аллергического и токсического воздействия метаболитов гельминта [2, 9].
Личинка Trichinella spiralis внедряется в мышечное волокно поперечно-полосатой мускулатуры хозяина, вызывает его разрушение, миозит. В результате вокруг личинки формируется соединительнотканная капсула. С 6–24 мес. может начаться обызвествление капсулы. Она настолько хорошо защищает паразита, что личинка трихинеллы сохраняет жизнеспособность в течение многих месяцев даже после смерти хозяина. С момента образования капсул резко снижаются клинические проявления трихинеллеза [13, 14].
В результате вокруг личинки формируется соединительнотканная капсула. С 6–24 мес. может начаться обызвествление капсулы. Она настолько хорошо защищает паразита, что личинка трихинеллы сохраняет жизнеспособность в течение многих месяцев даже после смерти хозяина. С момента образования капсул резко снижаются клинические проявления трихинеллеза [13, 14].
Защитой от аллергических реакций могут служить миграция возбудителя или продукция определенных ферментов, например, передвижения нематод по кишечнику или секреция филяриями антиоксидантов. Некоторые кишечные нематоды вызывают у хозяина развитие воспалительной реакции и иммуноглобулин (Ig) E-опосредованной реакции гиперчувствительности немедленного типа, что способствует их элиминации [18, 31]. Преобладающим является иммунный ответ, опосредованный Т-хелперами (Th3) с выработкой интерлейкинов (ИЛ) -4, -5, -6, -9 и -13 [21].
Таким образом, особенностями иммунных механизмов защиты при гельминтозах являются:
- Невозможность реализации фагоцитоза.

- Характерные реакции АЗКЦ.
- Развитие реакций воспаления и гиперчувствительности (аллергические реакции):
- при острых гельминтозах — IgE- и эозинофильно-опосредованные реакции, направленные на изгнание паразита;
- при хронических гельминтозах:
- гиперчувствительность замедленного типа / макрофаги = образование гранулем в тканях;
- Th3 / B-лимфоциты: IgE, мастоцитарные клетки, эозинофилы = аллергическое воспаление.
- Индукция Th3-ответа с выработкой ИЛ-4, -5, -6, -9, -13, эозинофилов и IgE.
Таким образом, большую роль в формировании патологического процесса при гельминтозах играют различные иммунные механизмы, включая аллергические реакции немедленного и гиперчувствительность замедленного типов. Ими обусловлена стереотипность клиники гельминтозов и их сходство с аллергическими заболеваниями.
Существует предположение, что аллергические реакции немедленного типа эволюционно сформировались в процессе филогенеза как защитные реакции против паразитов, в которых участвуют клетки-эффекторы — эозинофилы, тучные клетки, базофилы, В-лимфоциты, IgE-антитела [22, 24]. При отсутствии своевременного воздействия соответствующих антигенов атопия не защищает, а приводит к развитию аллергических заболеваний [30]. Авторы полагают, что основной причиной роста распространенности аллергических заболеваний, в т. ч. и бронхиальной астмы (БА), стало улучшение эпидемиологической обстановки. Согласно инфекционной теории, за последние 30–40 лет благодаря широкому применению антибиотиков и успехам в борьбе с такими инфекционными заболеваниями, как туберкулез, малярия и др., а также вследствие повышения качества санитарно-гигиенических условий жизни произошло изменение бактериально-вирусного спектра в окружающей среде. Сокращение инфекционной и паразитарной нагрузки на организм, изменение пищевого рациона и состава кишечного микробиоценоза привели к тому, что нарушился Th2/Th3 баланс и сформировался фенотип с преобладанием иммунного ответа Th3-типа. Следствием этих изменений явился рост распространенности атопии и аллергических заболеваний.
При отсутствии своевременного воздействия соответствующих антигенов атопия не защищает, а приводит к развитию аллергических заболеваний [30]. Авторы полагают, что основной причиной роста распространенности аллергических заболеваний, в т. ч. и бронхиальной астмы (БА), стало улучшение эпидемиологической обстановки. Согласно инфекционной теории, за последние 30–40 лет благодаря широкому применению антибиотиков и успехам в борьбе с такими инфекционными заболеваниями, как туберкулез, малярия и др., а также вследствие повышения качества санитарно-гигиенических условий жизни произошло изменение бактериально-вирусного спектра в окружающей среде. Сокращение инфекционной и паразитарной нагрузки на организм, изменение пищевого рациона и состава кишечного микробиоценоза привели к тому, что нарушился Th2/Th3 баланс и сформировался фенотип с преобладанием иммунного ответа Th3-типа. Следствием этих изменений явился рост распространенности атопии и аллергических заболеваний.
Несмотря на то, что многие из механизмов иммунной регуляции при гельминтозах изучены, вопрос о взаимовлиянии аллергических и паразитарных заболеваний остается дискутабельным.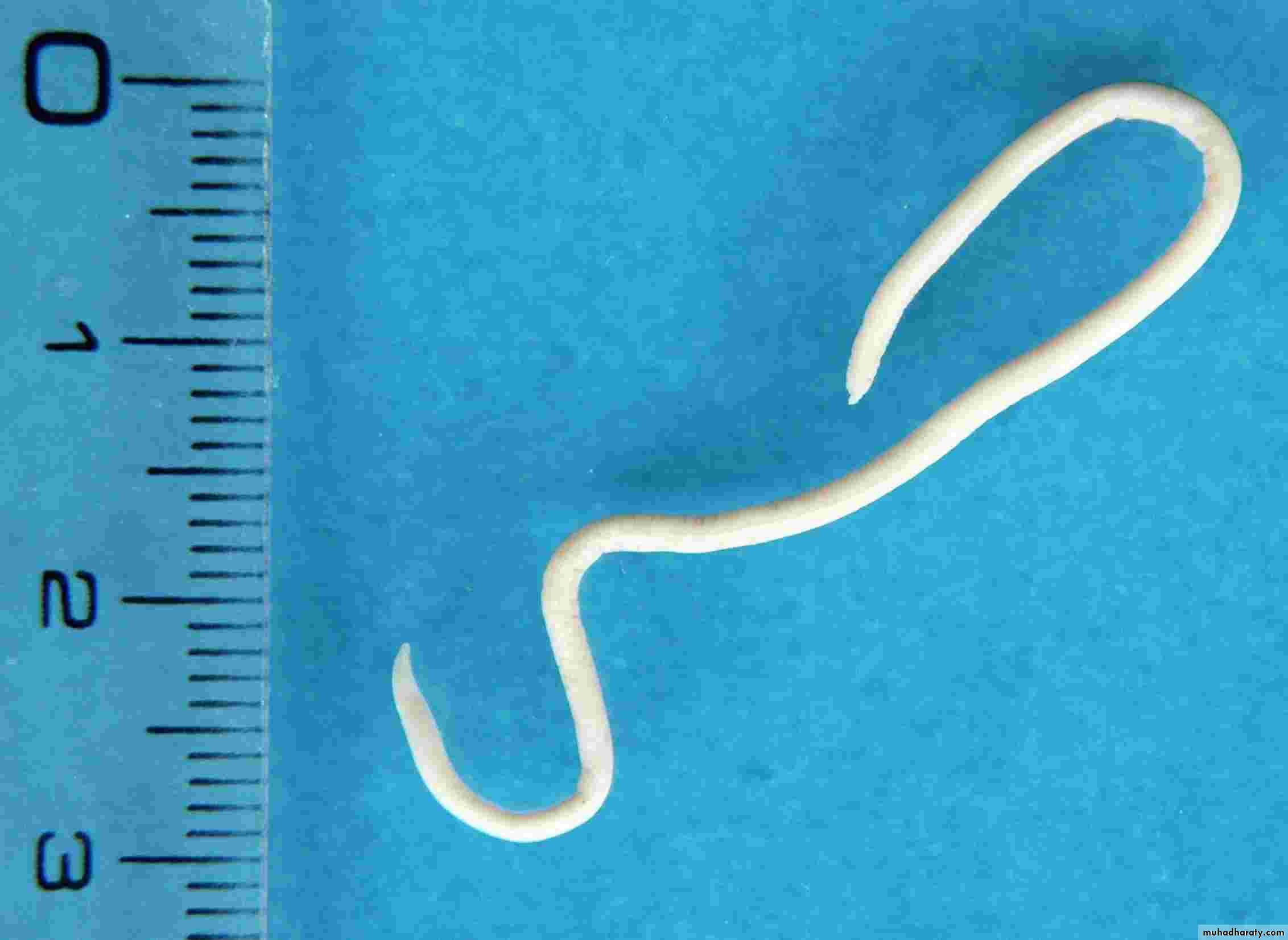 На основании эпидемиологических, экспериментальных и клинических исследований отстаивают взаимоисключающие точки зрения [25]:
На основании эпидемиологических, экспериментальных и клинических исследований отстаивают взаимоисключающие точки зрения [25]:
- Атопическая предрасположенность препятствует заражению гельминтами.
- Гельминтозы препятствуют/снижают развитие атопических болезней.
- Гельминтозы способствуют развитию атопических болезней или усиливают их проявления.
В пользу первой теории свидетельствуют, например, экспериментальные данные о том, что у мышей с определенной генетической направленностью иммунного ответа по Th3-типу (по типу атопии) наблюдается самоизлечение при заражении нематодами. Это происходит за счет продукции соответствующих ИЛ (ИЛ-4, -5, -6, -9, -10), выработки IgE, развития эозинофилии. Th3-цитокины могут вызывать мастоцитоз, эозинофилию, синтез IgE и предотвращать заражение некоторыми кишечными гельминтами [20].
Доказательствами второй теории являются экспериментальные и эпидемиологические данные, свидетельствующие об уменьшении симптомов бронхообструкции после заражения шистосомозом [23].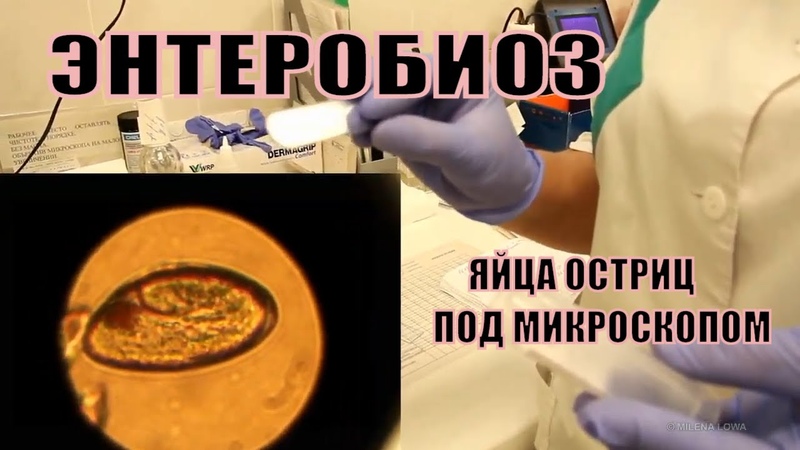
Более важными с позиций аллерголога в клиническом отношении представляются теории, предполагающие влияние паразитарных возбудителей на развитие аллергического процесса, подтверждение которых побудило бы к поиску новых путей лечения аллергии или расширило бы круг поиска причинных аллергенов или триггеров аллергии.
Известна способность гельминтов индуцировать синтез общего IgE, продукция которого как при гельминтозах, так и при аллергических реакциях регулируется лимфокинами, высвобождаемыми Th3-популяцией лимфоцитов [17]. Антигены гельминтов используются в эксперименте в составе конъюгатов для индукции IgE-ответа к гаптенам. В серии экспериментов у мышей с исходным IgE-ответом заражение токсокарозом приводило к развитию в легочной ткани персистирующей воспалительной ИЛ-5-зависимой реакции с преимущественным содержанием эозинофилов, вызывающих повышение реактивности бронхов [14].
Системные аллергические реакции могут развиваться при эхинококкозе в тех случаях, когда происходит разрыв эхинококковой кисты.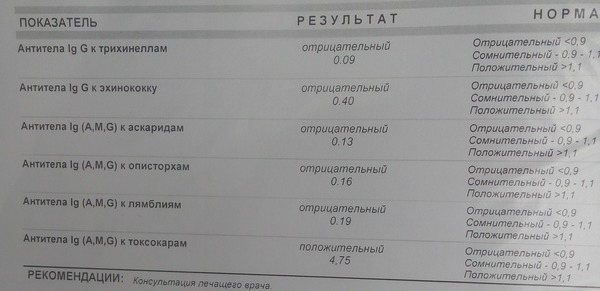 При слабовыраженных реакциях появляется только уртикарная сыпь. Если прорыв содержимого эхинококковой кисты произойдет в сосудистое русло или во внутренние полости организма больного, возможен анафилактический шок и летальный исход заболевания [27].
При слабовыраженных реакциях появляется только уртикарная сыпь. Если прорыв содержимого эхинококковой кисты произойдет в сосудистое русло или во внутренние полости организма больного, возможен анафилактический шок и летальный исход заболевания [27].
Приводим клиническое наблюдение.
Больная Д., 7 лет. Окончательный диагноз: эхинококкоз, эхинококковая киста левого легкого с прорывом в плевру и бронх, эхинококковая киста печени.
Заболела остро в январе 2014 г. Наблюдались насморк, кашель с отделением мокроты, высыпания по типу крапивницы по всему телу. Данное состояние сохранялось 4 дня. На 5-й день появились боли в области грудной клетки слева, повышение температуры тела до 38,7°С. По экстренным показаниям госпитализирована с подозрением на пневмонию.
УЗИ органов брюшной полости выявило в правой доле печени под диафрагмой округлое аваскулярное образование с четкими гиперэхогенными контурами, жидкостным содержимым со множественными перегородками, размерами 32×29 мм.
На компьютерной томографии грудной клетки: в задненижних отделах левой плевральной полости определяется округлое образование диаметром 75 мм, аваскулярное, с внутренними пристеночными перегородками и гиперэхогенными сигналами в капсуле. Образование располагается в безвоздушной паренхиме нижней доли. Вероятно нарушение проходимости нижнедолевого бронха.
Были проведены торакоскопическая цистэктомия, лапароскопическое склерозирование кисты печени. В настоящее время ребенок нуждается в реабилитации и длительном противорецидивном лечении.
С 2011 г. у больной наблюдались периодически возникающие мелкие зудящие нераспространенные высыпания на различных участках тела, которые проходили самостоятельно и не доставляли большого беспокойства. В анализе крови в 2011 г. была зарегистрирована эозинофилия — 21%. После пробного лечения пирантелом она снизилась до 9%.
На основании анамнестических данных и размеров эхинококковых кист можно предположить, что заражение эхинококкозом имело место уже в 2011 г. Клинические проявления в виде невыраженной крапивницы и повышение числа эозинофилов периферической крови могли помочь в своевременном распознании эхинококкоза, что позволило бы избежать угрожающего жизни состояния, тяжелой операции и дальнейшей длительной реабилитации.
Клинические проявления в виде невыраженной крапивницы и повышение числа эозинофилов периферической крови могли помочь в своевременном распознании эхинококкоза, что позволило бы избежать угрожающего жизни состояния, тяжелой операции и дальнейшей длительной реабилитации.
У сотрудников лабораторий, а также работников мясокомбинатов нередко развивается выраженная сенсибилизация к аскаридам человека или свиным аскаридам. Работа, подразумевающая контакт с этими гельминтами, может провоцировать ангионевротический отек и даже приступы бронхоспазма.
Приводим клиническое наблюдение.
Больной Е., 11 лет. Обратился с жалобами на сухой кашель, эпизоды затрудненного дыхания. Наследственность по аллергии отягощенная. У тети по матери — поллиноз. До 7 лет часто болел ОРВИ, ОРЗ, острым бронхитом. Болеет около 2-х нед. Обследован аллергологом. Общий иммуноглобулин — 628 МЕ/мл, специфические аллергены не выявлены. Обнаружены антитела к токсокаре в титрах 1:200, в фекалиях яйца аскарид. Диагноз: аскаридоз.
Диагноз: аскаридоз.
После проведения противопаразитарного лечения бронхообструктивный синдром был купирован. Положительная реакция к токсокаре наиболее вероятно была обусловлена перекрестной реакцией к антигенам аскарид.
Выраженные аллергические реакции различной степени тяжести характерны для трихинеллеза, токсокароза, стронгилоидоза. Имеются данные, что противопаразитарная терапия у больных токсокарозом купирует приступы БА [15].
По нашим наблюдениям, специфические IgE-АТ и положительные внутрикожные тесты с экскреторно-секреторным антигеном токсокар наблюдались у 27% детей с неинфекционно-аллергической формой БА. Сенсибилизация к токсокарозному аллергену сопровождалась поливалентной сенсибилизацией к непаразитарным аллергенам и более тяжелым течением БА. Противопаразитарное лечение оказывало положительное действие на течение астмы [3].
Приводим клиническое наблюдение.
Больной В., 5 лет. Обратился с жалобами на сухой кашель, преимущественно по ночам, приступы затрудненного дыхания, периодические подъемы температуры тела до 37,7°С, плохой аппетит. За 2 мес. до обращения перенес ОРВИ, после чего длительно сохранялись субфебрилитет, кашель. В возрасте до 1 года страдал аллергическим диатезом.
За 2 мес. до обращения перенес ОРВИ, после чего длительно сохранялись субфебрилитет, кашель. В возрасте до 1 года страдал аллергическим диатезом.
В периферической крови — эозинофильный лейкоцитоз (эозинофилов — 16%, лейкоцитов — 11,8×109). Обсуждались БА, ОРВИ, затяжное течение. На протяжении 2-х мес. ребенок получал антибактериальную терапию, противовирусное лечение, антигистаминные препараты без выраженного эффекта.
Выезжал на дачу в Смоленскую область, где много дворовых собак, кошек. Играл в песочницах.
При обследовании в отделении паразитологии выявлены антитела к антигену токсокар в титрах 1:1600. Окончательный диагноз: токсокароз, висцеральная форма с легочным синдромом. Получил 3 курса противопаразитарной терапии мебендазолом по 2 нед. в стандартной дозировке. После первого курса кашель прошел, бронхообструктивный синдром был купирован, температура нормализовалась. Показатели крови пришли в норму после третьего курса. Продолжает наблюдаться.
Бронхообструктивный синдром характерен для токсокароза, нередко проявляясь кашлем, приступами затрудненного дыхания, кратковременным повышением температуры тела.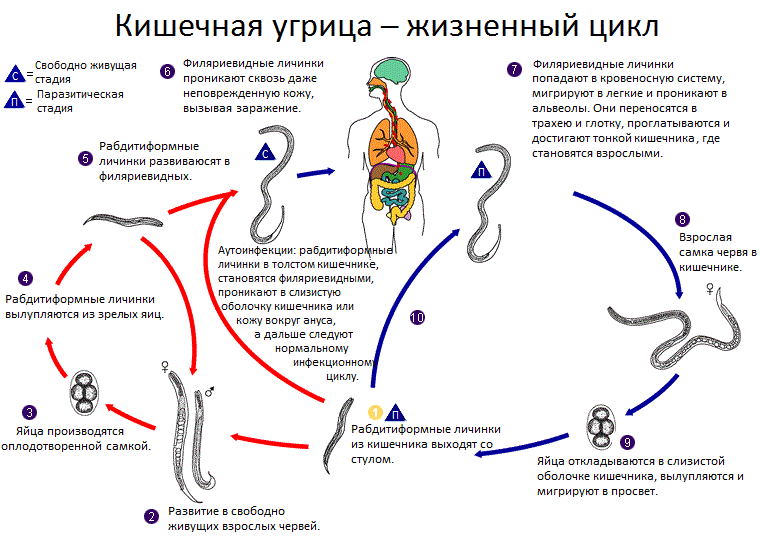 Перенесенная острая вирусная инфекция, отягощенный аллергологический анамнез изменили направление диагностического поиска, в результате чего диагноз был установлен через 2 мес. от начала клинических проявлений, проведено неадекватное лечение.
Перенесенная острая вирусная инфекция, отягощенный аллергологический анамнез изменили направление диагностического поиска, в результате чего диагноз был установлен через 2 мес. от начала клинических проявлений, проведено неадекватное лечение.
В ранней стадии стронгилоидоза ведущим клиническим синдромом может быть легочный синдром с сухим и влажным кашлем, приступами затрудненного дыхания, лихорадкой, одышкой, гиперэозинофильным лейкоцитозом, рентгенологической картиной мигрирующих эозинофильных инфильтратов. При их наличии необходимо проводить дифференциальную диагностику с заболеваниями аллергической природы, системными заболеваниями и другими гельминтозами.
Под наблюдением находился ребенок 4-х мес., цыган, проживал с родителями в районе г. Сочи (РФ) в палатках, часто лежал на земле. Заболел остро: лихорадка, одышка, сухие и влажные хрипы в легких. В крови — эозифинофильный лейкоцитоз. Госпитализирован с диагнозом «пневмония». Терапия антибиотиками — без эффекта. При исследовании мокроты обнаружены личинки стронгилид. После 2-х курсов противопаразитарной терапии наступило выздоровление.
При исследовании мокроты обнаружены личинки стронгилид. После 2-х курсов противопаразитарной терапии наступило выздоровление.
В данном наблюдении диагноз был установлен через 1 мес. от начала болезни. Причиной диагностических трудностей и ошибочного диагноза стал ранний возраст ребенка. Факт контакта 4-месячного ребенка с землей расценивался как маловероятный и мог быть установлен только при тщательном анализе условий быта семьи. Обнаружение личинок в мокроте явилось случайной для данного наблюдения находкой, позволившей установить диагноз.
При шистосоматидных церкариозах аллергические реакции часто являются единственными клиническими проявлениями. Эти заболевания известны также под названиями «зуд купальщиков», «зуд пловцов» и вызываются личинками шистосом многих млекопитающих и птиц. Паразиты проникают в кожу при купании в пресноводных или соленых водоемах, через 10–15 мин возникает чувство покалывания, затем появляется зудящая папулезная и уртикарная сыпь, которая может сохраняться в течение нескольких дней.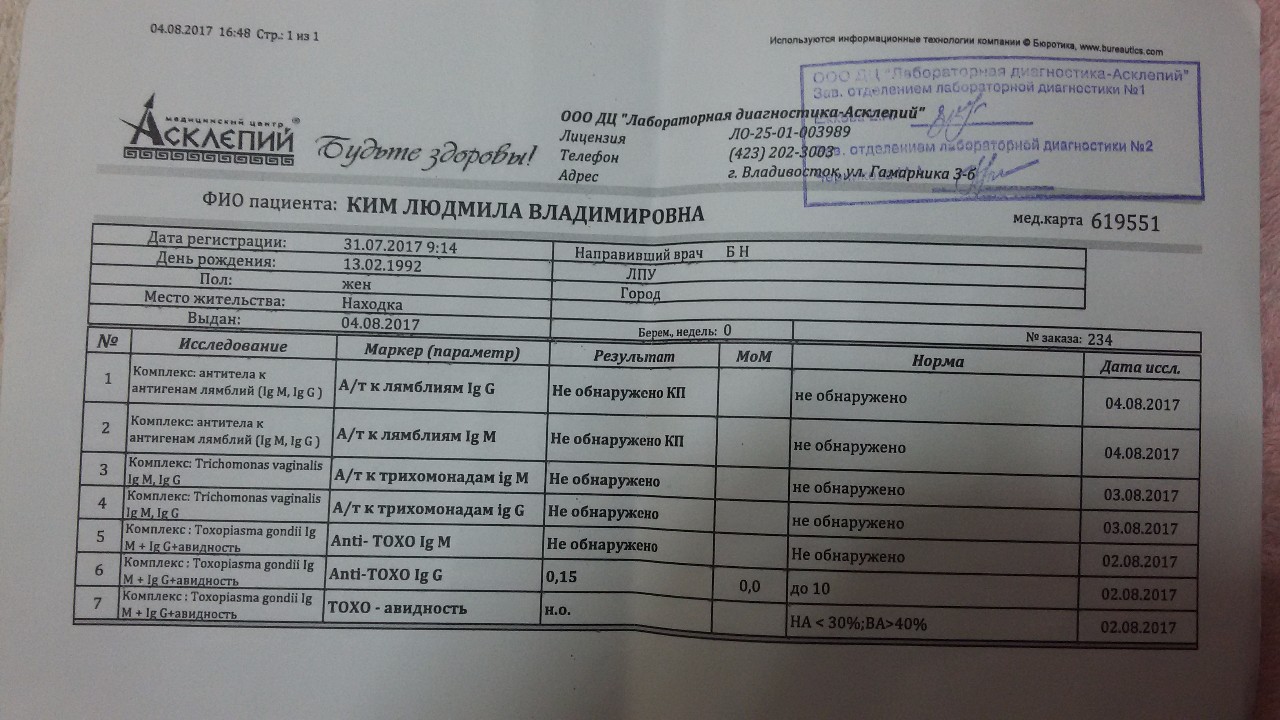
Зудящими высыпаниями, весьма схожими с аллергическим дерматитом, сопровождается проникновение под кожу человека чесоточного клеща. Нередко диагноз чесотки устанавливают несвоевременно, что приводит к длительным страданиям ребенка, нервозности, нарушению сна и аппетита, вторичной инфицированности кожи, необоснованному безуспешному лечению антигистаминными препаратами, наружными средствами, в т. ч. стероидными, инвазированию окружающих.
Приводим клиническое наблюдение.
Больной Ш., 3 года, проживает в Орловской области. 23.01.2009 г. обратился в поликлинику по месту жительства по поводу высыпаний на сгибательных поверхностях луче-запястных суставов, животе, кожного зуда, плохого аппетита, беспокойного сна. Был установлен диагноз «атопический дерматит», назначены антигистаминные препараты, наружные средства, в т. ч. топические кортикостероиды.
При обследовании выявлены эозинофилия периферической крови — 9%, лейкоциты периферической крови — 8,7×109, положительные антитела к антигену токсокар в титре 1:800, на основании чего установлен диагноз «токсокароз». Назначен противопаразитарный препарат альбендазол в дозе 10 мг/кг/сут в течение 10 дней. Состояние ребенка не улучшалось.
Назначен противопаразитарный препарат альбендазол в дозе 10 мг/кг/сут в течение 10 дней. Состояние ребенка не улучшалось.
В апреле 2009 г. с жалобами на общую слабость, снижение аппетита вплоть до полного отказа от еды, анурию в течение 1 сут поступил в Плещеевскую ЦРБ, где была проведена дезинтоксикационная терапия. Состояние ребенка улучшилось без исчезновения высыпаний и кожного зуда. В июне 2009 г. родители обратились в отделение медицинской паразитологии и тропической медицины КДЦ Первого МГМУ им. И. М. Сеченова с предварительным диагнозом «атопический дерматит. Токсокароз?».
При обследовании в кожном соскобе обнаружены чесоточные клещи, личинки и яйца в большом числе. Окончательный диагноз «чесотка» был установлен через 6 мес. после появления клинических симптомов. Трудности диагноза были обусловлены неправильной интерпретацией серологических реакций на токсокароз, сходством клинической симптоматики с проявлениями атопического дерматита, отсутствием указаний на контакт с больным чесоткой.
Картина, весьма схожая с рецидивирующими ангионевротическими отеками и конъюнктивитом, наблюдается при дирофиляриозе. Клинические признаки дирофиляриоза: перемещающийся ограниченный отек на различных участках тела — под кожей живота, бедра, наиболее часто на лице и под конъюнктивой глаза. В периферической крови возможна эозинофилия. Диагноз устанавливают на основании хирургического извлечения гельминта. Трудности диагностики дирофиляриоза объясняются отсутствием четкого эпиданамнеза, относительной редкостью данной патологии. Несмотря на расширение диагностических возможностей с внедрением молекулярно-биологических методов диагностики гельминтозов проблема дирофиляриоза становится все более актуальной [19].
Синдром cutaneоus larva migrans необходимо дифференцировать с аллергическим дерматитом, стрептодермией, герпетическими высыпаниями. В начальной стадии на месте проникновения личинки появляется зудящая везикула, которая затем выглядит как перемещающиеся нитевидные полосы с локализацией на стопах, ягодицах, в области промежности, реже на туловище.
Мы наблюдали 3-х детей, у которых диагноз не был установлен своевременно, несмотря на четкий эпиданамнез (пребывание в странах тропического пояса, хождение по пляжу босиком, игра в песке). В течение 2-х мес. до установления окончательного диагноза: cutaneous larva migrans дети не получали адекватного лечения, в 2-х случаях заболевание осложнилось бактериальной инфекцией (расчесы из-за сильного зуда), потребовавшей дополнительного длительного лечения.
Торпидность течения хронической рецидивирующей крапивницы у детей нередко бывает обусловлена псевдоаллергическими реакциями, вызванными кишечными гельминтами или патогенными простейшими. По некоторым эпидемиологическим исследованиям, цисты лямблий находят у 62% детей с хронической рецидивирующей крапивницей и отеком Квинке [16].
Приводим клиническое наблюдение.
Больной О., 15 лет. Обратился с жалобами на периодически возникающие высыпания по всему телу по типу волдырей, боли в животе, кашицеобразный стул, повышенный аппетит. За последние 3 мес. трижды были приступы острых болей в животе, сопровождающиеся субфебрильной температурой по вечерам, рвотой. Болеет 1 год. Был обследован аллергологом. Клинический диагноз: хроническая рецидивирующая крапивница. Антигистаминные препараты приводили к временному эффекту. Обнаружено повышенное содержание общего сывороточного IgE — 294 МE/мл, но причинно-значимые аллергены обнаружены не были. В фекалиях микроскопически выявлено большое количество цист лямблий. После проведения противопаразитарного лечения в течение 6 мес. наблюдения рецидивов крапивницы не отмечено.
За последние 3 мес. трижды были приступы острых болей в животе, сопровождающиеся субфебрильной температурой по вечерам, рвотой. Болеет 1 год. Был обследован аллергологом. Клинический диагноз: хроническая рецидивирующая крапивница. Антигистаминные препараты приводили к временному эффекту. Обнаружено повышенное содержание общего сывороточного IgE — 294 МE/мл, но причинно-значимые аллергены обнаружены не были. В фекалиях микроскопически выявлено большое количество цист лямблий. После проведения противопаразитарного лечения в течение 6 мес. наблюдения рецидивов крапивницы не отмечено.
Таким образом, в практике педиатра возникают серьезные трудности, обусловленные сходством клинической симптоматики паразитозов с симптомами аллергических заболеваний. В случаях неспецифических системных клинических проявлений при паразитарной патологии, выступающих на передний план, ведущую патогенетическую роль играют иммунные нарушения в виде аллергических реакций различной интенсивности в ранней стадии гельминтозов и иммунопатологические реакции при гельминтозах хронического течения и внутриклеточных паразитозах. Дифференциальная диагностика должна быть основана на исключении сенсибилизации антигенами непаразитарной природы и полноценном паразитологическом обследовании ребенка.
Дифференциальная диагностика должна быть основана на исключении сенсибилизации антигенами непаразитарной природы и полноценном паразитологическом обследовании ребенка.
Литература
- Лейкина Е. С. Роль аллергических реакций немедленного и замедленного типов в механизмах иммунитета при гельминтозах // Медицинская паразитология и паразитарные болезни. 1975. № 4. С. 477–483.
- Лукашенко Н.П., Брегадзе И. Л. Эхинококкоз и альвеококкоз // Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные: Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней / под ред. П. Г. Сергиева. М.,1968. Т. 9. С. 509–526.
- Мазманян М. В. Паразитарные инвазии у больных аллергией: Мат-лы VI Российского съезда врачей-инфекционистов. СПб., 2003. С. 222.
-
Меркушев А.В., Озерецковская Н. Н. Трихинеллез // Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные: Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней / под ред.
 П. Г. Сергиева. М., 1968. Т. 11. С. 601–615.
П. Г. Сергиева. М., 1968. Т. 11. С. 601–615. - Новолеска Л. Группоподобные антигены по системе АВО(Н) в эхинококковых пузырях // Известия Центральной гельминтологической лаборатории. 1970. № 14. С. 185–192.
- Озерецковская Н. Н. Механизмы развития органной патологии при трихинеллезе: Мат-лы VIII Всероссийской конференции по трихинеллезу. М., 2000. С. 33–51.
- Озерецковская Н. Н. Подходы отечественной школы паразитологов-иммунологов к терапии паразитарных болезней // Медицинская паразитология и паразитарные болезни. 1998. № 2. С. 12–15.
- Сергиев В.П., Филатов Н. Н. Инфекционные болезни на рубеже веков. Осознание биологической угрозы. М.: Наука, 2000. С. 92–1077.
- Тумольская Н. И. Клинические аспекты проблемы эхинококкозов и пути их решения // Медицинская паразитология и паразитарные болезни. 1992. № 5 (6). С. 5–9.
-
Шуйкина Э. Е. Патология иммунной системы при инфекционных болезнях // Итоги науки и техники. 1979. Т.
 С. 70–93.
С. 70–93. - Шуйкина Э. Е. Клинико-иммунологические аспекты отношений паразит — хозяин // Медицинская паразитология и паразитарные болезни. 1987. № 5. С. 3–8.
- Almeida F. and al. Morphometric characteristics of the metacestode Echinococcus vogeli Rausch & Bernstein, 1972 in human infections from the northern region of Brazil // J. Helmintol. 2014, May 22. Р. 1–7.
- Bruschi F., Chiumiento L. Trichinella inflammatory myopathy: host or parasite strategy? // Parasit Vectors. 2011, Mar 23. Vol. 4. Р. 42.
- Buijs J. and al. Toxocara-induced eosinophilic inflammation. Airway function and effect of anti-IL-5 // Am J Respir Crit Care Med. 1995 Mar. Vol. 151 (3 Pt 1). Р. 873–878.
- Buijs J. and al. Relationship between allergic manifestations and Toxocara seropositivity: a cross-sectional study among elementary school children // Eur. Respir. J. 1997 Jul. Vol. 10 (7). Р. 1467–1475.
-
Chirilă M., Panaitescu D., Căpraru T. Frequency of Giardia lamblia in certain allergic syndromes // Med Interne.
 1981 Oct-Dec. Vol. 19 (4). Р. 367–372.
1981 Oct-Dec. Vol. 19 (4). Р. 367–372. - Chen F. and al. An essential role for Th3-type responses in limiting acute tissue damage during experimental helminth infection // Nat Med. 2012 Jan 15. Vol. 18 (2). Р. 260–266.
- Cadman E.T. and al. Eosinophils are important for protection, immunoregulation and pathology during infection with nematode microfilariae // PLoS Pathog. 2014 Mar 13. Vol. 10 (3).
- Ermakova L.A. and al. Dirofilaria repens in the Russian Federation: current epidemiology, diagnosis, and treatment from a federal reference center perspective // Int J Infect Dis. 2014 Jun. Vol. 23. Р. 47–52.
- Finkelman F.D., Urban J. F. Jr. The other side of the coin: the protective role of the Th3 cytokines // J Allergy Clin Immunol. 2001 May. Vol. 107 (5). Р. 772–780.
-
Ilic N., Gruden-Movsesijan A., Sofronic-Milosavljevic L. Trichinella spiralis: shaping the immune response // Immunol Res. 2012 Apr. Vol. 52 (1–2). Р. 111–119. doi: 10.
 1007/s12026-012-8287-5.
1007/s12026-012-8287-5. - Knopf. P. M. Immunomodulation and allergy // Allergy Asthma Proc. 2000 Jul-Aug. Vol. 21 (4). Р. 215–220.
- Layland L.E. and al. Schistosoma mansoni-mediated suppression of allergic airway inflammation requires patency and Foxp3+ Treg cells // PLoS Negl Trop Dis. 2013 Aug 15. Vol. 7(8).
- Lynch N., Goldblatt J. and Le Souef P. N. Parasite infections and the risk of asthma and atopy // Thorax. Aug 1999. Vol. 54 (8). Р. 659–660.
- Moqbel R., Pritchard D. I. Parasites and allergy: evidence for a ’cause and effect’ relationship // Clin Exp Allergy. 1990 Nov. Vol. 20 (6). Р. 611–618.
- Nussenzweig R. S. Parasitic disease as a cause of immunosuppression // N Engl J Med. 1982 Feb 18. Vol. 306 (7). Р. 423–434.
- Ozkan F. and al. Anaphylaxis due to spontaneous rupture of primary isolated splenic hydatid cyst // 2 Int J Crit Illn Inj Sci. 2013 Apr. Vol. 3 (2). Р. 152–154.
- Rajan T.v. TheGell-Coombs classification of hypersensitivity reactions: a re-interpretation // Trends Immunol.
 2003 Jul. Vol. 24 (7). Р. 376–379.
2003 Jul. Vol. 24 (7). Р. 376–379. - Sudhakar N.R. and al. Characterization of excretory-secretory antigens of adult Toxocara canis by western blotting // J Parasit Dis. 2014 Jun. Vol. 38 (2). Р. 166–169.
- Varner A. E. The increase in allergic respiratory diseases: survival of the fittest? //
- Chest. 2002 Apr. Vol. 121 (4). Р. 1308–1316. Review.
- Winter W.E., Hardt N.S., Fuhrman S. Immunoglobulin E: importance in parasitic infections and hypersensitivity responses //Arch Pathol Lab Med. 2000 Sep. Vol. 124 (9). Р. 1382–1385. Review.
.
паразитарных инфекций | Определение и обучение пациентов
Что такое паразитарная инфекция?
Паразиты — это организмы, которые выживают за счет других организмов или хозяев. Некоторые паразиты не оказывают заметного воздействия на хозяев. Другие растут, размножаются или вторгаются в системы органов, от которых болеют их хозяева, что приводит к паразитарной инфекции.
Паразитарные инфекции — большая проблема в тропических и субтропических регионах мира.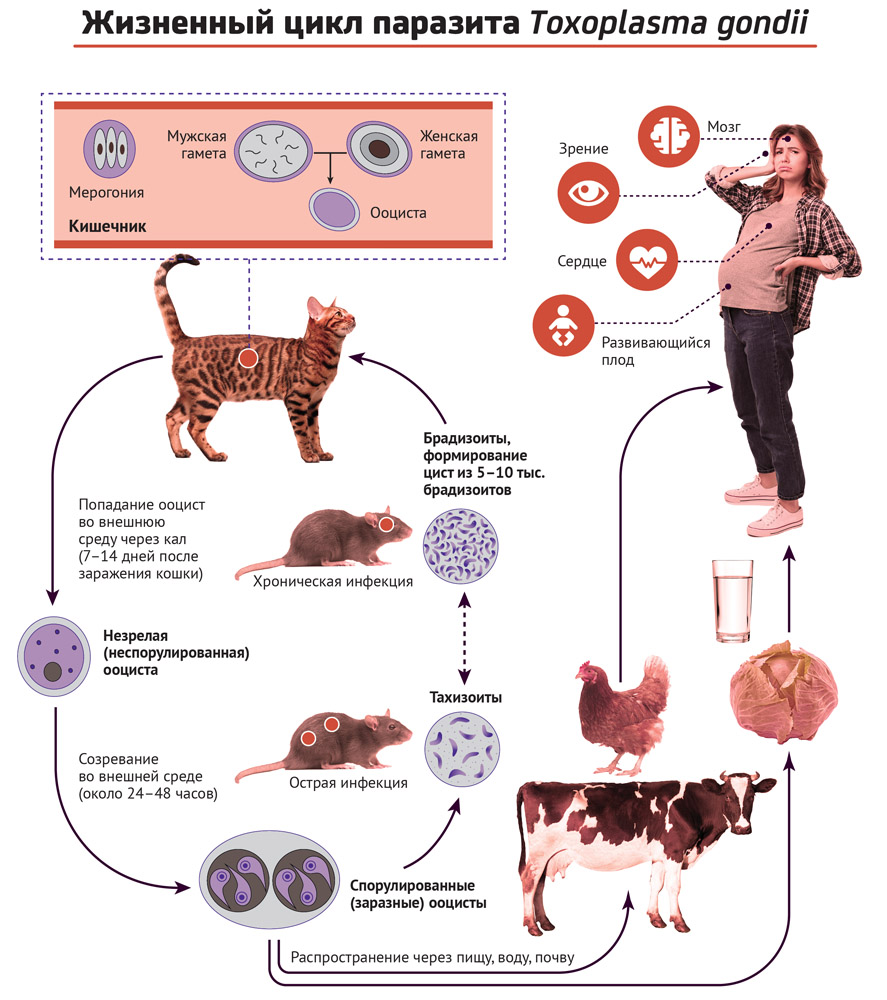 Малярия — одно из самых смертоносных паразитарных заболеваний.Паразитарные инфекции также могут возникать в Соединенных Штатах. Общие паразитарные инфекции, обнаруженные в Соединенных Штатах, включают:
Малярия — одно из самых смертоносных паразитарных заболеваний.Паразитарные инфекции также могут возникать в Соединенных Штатах. Общие паразитарные инфекции, обнаруженные в Соединенных Штатах, включают:
Симптомы паразитарных инфекций различаются в зависимости от организма. Например:
- Трихомониаз — это инфекция, передающаяся половым путем, вызываемая паразитом, который часто протекает бессимптомно. В некоторых случаях это может вызвать зуд, покраснение, раздражение и необычные выделения в области половых органов.
- Лямблиоз может вызывать диарею, газы, расстройство желудка, жирный стул и обезвоживание.
- Криптоспоридиоз может вызывать спазмы желудка, боль в животе, тошноту, рвоту, обезвоживание, потерю веса и лихорадку.
- Токсоплазмоз может вызывать симптомы гриппа, включая увеличение лимфатических узлов и боли в мышцах или боли, которые могут длиться более месяца.
Паразитарные инфекции могут быть вызваны тремя типами организмов:
- простейшие
- гельминты
- эктопаразиты
Простейшие — одноклеточные организмы, которые могут жить и размножаться внутри вашего тела. Некоторые инфекции, вызываемые простейшими, включают лямблиоз. Это серьезная инфекция, которой вы можете заразиться через питьевую воду, зараженную простейшими Giardia .
Некоторые инфекции, вызываемые простейшими, включают лямблиоз. Это серьезная инфекция, которой вы можете заразиться через питьевую воду, зараженную простейшими Giardia .
Гельминты — это многоклеточные организмы, которые могут жить в вашем теле или вне его. Их чаще называют черви. К ним относятся плоские черви, ленточные черви, колючие черви, и круглые черви.
Эктопаразиты — это многоклеточные организмы, которые живут на вашей коже или питаются ею. К ним относятся некоторые насекомые и паукообразные, такие как комары, блохи, клещи и клещи.
Паразитарные инфекции могут передаваться разными путями. Например, простейшие и гельминты могут передаваться через загрязненную воду, пищу, отходы, почву и кровь. Некоторые из них могут передаваться половым путем. Некоторые паразиты распространяются насекомыми, которые действуют как переносчики или переносчики болезни. Например, малярия вызывается паразитическими простейшими, которые передаются комарами, питающимися людьми.
Паразитарной инфекцией может заразиться любой человек. Но некоторые люди подвергаются большему риску, чем другие.Вы с большей вероятностью заразитесь паразитарной инфекцией, если:
- имеете ослабленную иммунную систему или уже болеете другим заболеванием
- живете или путешествуете в тропических или субтропических регионах мира
- испытываете недостаток чистой питьевой воды
- плавать в озерах, реках или прудах, где распространены Giardia или другие паразиты
- Работа по уходу за детьми, регулярная работа с почвой или работа в других условиях, где вы постоянно контактируете с фекалиями
На улице кошки могут контактировать с инфицированными грызунами и птицами.Это увеличивает вероятность заражения их владельцев токсоплазмозом, одним из видов простейших. Токсоплазмоз может быть очень вредным для беременных женщин и их развивающихся детей. Инфекция распространяется через кошачьи фекалии. Если вы беременны, важно, чтобы кто-нибудь ежедневно чистил туалетный лоток.
Паразитарные инфекции можно диагностировать несколькими способами. Например, ваш врач может выполнить или заказать:
- Анализ крови
- Исследование кала: в ходе такого обследования будет взят образец вашего стула и проверен на наличие паразитов и их яиц.
- Эндоскопия или колоноскопия: эти тесты могут быть назначены, если результаты исследования кала неубедительны. Пока вы находитесь под седативным действием, ваш врач проведет тонкую гибкую трубку через ваш рот или прямую кишку в пищеварительную систему, чтобы исследовать ваш кишечник.
- Рентгеновские снимки, магнитно-резонансная томография (МРТ) или компьютерная аксиальная томография (CAT): эти сканирования используются для выявления признаков повреждений или повреждений ваших органов, вызванных паразитами.
Ваш врач может также назначить анализы для проверки на наличие бактерий или других факторов, которые могут вызвать инфекции.
Ваш план лечения будет зависеть от вашего конкретного диагноза. Обычно врач прописывает вам лекарства. Например, они могут прописать лекарства для лечения трихомониаза, лямблиоза или криптоспоридиоза. Они, вероятно, не пропишут лекарства от токсоплазмоза, если вы не беременны и в остальном здоровы, если только у вас нет тяжелой и продолжительной инфекции.
Обычно врач прописывает вам лекарства. Например, они могут прописать лекарства для лечения трихомониаза, лямблиоза или криптоспоридиоза. Они, вероятно, не пропишут лекарства от токсоплазмоза, если вы не беременны и в остальном здоровы, если только у вас нет тяжелой и продолжительной инфекции.
Ваш врач может также порекомендовать другие методы лечения для облегчения ваших симптомов. Например, многие паразитарные инфекции могут вызывать диарею, которая часто приводит к обезвоживанию.Ваш врач, вероятно, посоветует вам пить много жидкости, чтобы восполнить потерю.
Есть несколько шагов, которые вы можете предпринять, чтобы снизить риск заражения паразитарной инфекцией:
- Практикуйте безопасный секс, используя презерватив.
- Регулярно мойте руки, особенно после работы с сырой пищей или фекалиями.
- Готовьте пищу до рекомендованной внутренней температуры.
- Пейте чистую воду, в том числе воду в бутылках, когда путешествуете.
- Не глотайте воду из озер, ручьев или прудов.

- Не используйте наполнитель для кошачьего туалета и фекалии во время беременности.
Если вы подозреваете, что у вас паразитарная инфекция, запишитесь на прием к врачу. Они могут помочь диагностировать причину ваших симптомов и порекомендовать план лечения. Получив раннее лечение, вы можете помочь остановить распространение инфекции среди других людей.
Желудочно-кишечные паразиты — обзор | Медицинские условия
Ключевые моменты
- Паразитарные инфекции желудочно-кишечного тракта наиболее распространены там, где имеется плохое качество воды, неадекватные санитарные условия и перенаселенность.
- Самый высокий уровень инфицирования наблюдается у детей, которые живут или путешествуют из стран Африки к югу от Сахары, Азии, Латинской Америки и Карибского бассейна.
- Дети с паразитарными инфекциями желудочно-кишечного тракта могут не иметь никаких симптомов или у них может быть рвота и / или диарея, нарушение нормального роста и другие признаки и симптомы, в зависимости от причины.

- Инфекция желудочно-кишечными паразитами может вызвать мальабсорбцию, недоедание и, как следствие, задержку роста и хроническую анемию, состояния, которые могут повлиять на физическое и умственное развитие ребенка.
- Исследования кала на яйцеклетки и паразиты иногда дают ложноотрицательные результаты. Для некоторых паразитов разработаны быстрые диагностические тесты, в том числе тесты стула на основе полимеразной цепной реакции (ПЦР).
- Лечение паразитов может улучшить рост и состояние питания, но лицензированные варианты лечения ограничены. Для некоторых инфекций требуются лекарства, которые доступны в Канаде только в рамках Программы особого доступа Министерства здравоохранения Канады.
- Скрининг с серологическими тестами на вид Schistosoma рекомендуется для беженцев и иммигрантов, недавно прибывших из эндемичных регионов, таких как Африка.Если результаты положительные, рекомендуется лечение, даже если у ребенка или подростка нет симптомов.

- Скрининг с серологическими тестами на Strongyloides stercoralis рекомендуется для беженцев и иммигрантов, недавно прибывших из эндемичных регионов, таких как Юго-Восточная Азия и Африка. Если результаты положительные, рекомендуется лечение, даже если у ребенка или подростка нет симптомов.
- Вакцины для предотвращения паразитарных инфекций желудочно-кишечного тракта отсутствуют.
Введение
Giardia и паразитарные гельминтозы (глисты), передаваемые через почву, вызываемые видами Strongyloides и Schistosoma , являются распространенными инфекциями среди беженцев.Около 2 миллиардов человек во всем мире инфицированы глистами, такими как Ascaris lumbricoides (круглые черви), Trichuris trichiura (власоглав) и Necator americanus и Ancylostoma duodenale (анкилостомы). По оценкам, 200 миллионов человек инфицированы видом Schistosoma и 100 миллионов — Strongyloides stercoralis . 1 Хотя эти инфекции часто протекают бессимптомно или субклинически, они также могут вызывать серьезные заболевания и даже смерть.Коинфекция множественными желудочно-кишечными паразитами часто встречается у детей из регионов высокого риска.
1 Хотя эти инфекции часто протекают бессимптомно или субклинически, они также могут вызывать серьезные заболевания и даже смерть.Коинфекция множественными желудочно-кишечными паразитами часто встречается у детей из регионов высокого риска.
Информация о кишечных паразитах, распространенных в различных регионах мира с высоким уровнем риска, может помочь врачу запросить соответствующие скрининговые тесты (Таблица 1). Когда микробиологическая лаборатория сообщает о паразитах в кале, таблица 2 может помочь в назначении соответствующей противопаразитарной терапии для различных типов патогенных паразитов. Непатогенные паразиты не требуют противопаразитарной терапии.(См. Рекомендации по лечению ниже.)
| Все районы | Африка | Азия | Латинская Америка | Ближний Восток | Восточная Европа |
|---|---|---|---|---|---|
A. lumbricoides Hymenolepis nana Большинство простейших, особенно Лямблии Кишечник ( лямблии ) | С.mansoni Taenia saginata (солитер, особенно в Эфиопии и Эритрее) | Fasciolopsis buski Юго-Восточная Азия: Opisthorchis viverrini Южная Азия: Taenia solium (свиной цепень) | Taenia solium | Эхинококк Лямблии | Diphyllobothrium latum Описторхис felineus |
Источник: CDC, ноябрь 2013 г. | |||||
| Патогенное | Спорный | Непатогенные | ||||
|---|---|---|---|---|---|---|
| Нематоды | Трематоды | Цестоды | Простейшие | Простейшие | Прочие | Простейшие |
| Ascaris lumbricoides Анкилостома ( Necator americanus & Ancylostoma ) Trichuris trichiura Strongyloides stercoralis | Schistosoma ( S.mansoni , S. haematobium , S.  japonicum ) japonicum ) Другие двуустки (Ophisthorchis spp.) Fasciola, Paragonimus westermani) | Taenia solium Taenia. saginatum Hymenolepis nana | Entamoeba histolytica * Giardia Кишечник (также известный как G. lamblia или G. duodenalis ) | Dientamoeba fragilis (диарея) Entamoeba polecki (диарея) | Blastocystis hominis (диарея) | Entamoeba dispar * Entamoeba moshkowskii * Entamoeba coli Entamoeba hartmanii Endolimax nana lodamoeba butschlii Chilomastix mesnili |
* Кисты E.histolytica , E. dispar и E. moshkowskii выглядят идентично под микроскопом. При обнаружении кист рекомендуется провести анализ стула на антиген, чтобы отличить потенциально патогенный E. histolytica от более распространенных, непатогенных видов. | ||||||
| Источник: CDC, ноябрь 2013 г. Руководство по изучению кишечных паразитов для домашнего медицинского осмотра вновь прибывших беженцев. | ||||||
Более подробную информацию о распространенных паразитарных инфекциях, а также о предлагаемых методах лечения для вновь прибывших детей и подростков можно найти на этом ресурсе:
Кого следует обследовать?
Хотя дети подвергаются более высокому риску заражения кишечными паразитами, чем взрослые, 2 рутинный скрининг на эти инфекции у детей или взрослых не , а не входил в обязательный медицинский осмотр новых иммигрантов и беженцев в Канаду.Кроме того, текущие рекомендации, как правило, сосредоточены на проверке беженцев, а не иммигрантов в целом. 3-5 В 2011 году 21% беженцев, прошедших скрининг в Миннесоте, имели по крайней мере одного кишечного паразита, с самым высоким показателем распространенности среди людей из Юго-Восточной Азии — 25%. Органы здравоохранения рекомендовали обследовать всех беженцев на паразитарные инфекции, даже если они протекают бессимптомно.
Органы здравоохранения рекомендовали обследовать всех беженцев на паразитарные инфекции, даже если они протекают бессимптомно.
Их рекомендации включали: 3
- Анализ крови на Schistosoma у беженцев и иммигрантов, недавно прибывших из высокоэндемичных регионов, особенно в Африке.Если результаты положительные, рекомендуется лечение, даже если у ребенка нет симптомов.
- Анализ крови на Strongyloides у беженцев и иммигрантов, недавно прибывших из высоко эндемичных регионов, особенно в Юго-Восточной Азии и Африке. Если результаты положительные, рекомендуется лечение, даже если у ребенка нет симптомов. Если у пациента есть эозинофилия (количество эозинофилов в крови> 500 / мл), это следует исследовать. См. Таблицу 3 и приведенный ниже раздел.
- Обследование кала на яйцеклетки и паразитов может дать ложноотрицательные результаты.В Канаде начинают появляться быстрые диагностические тесты, в том числе тесты кала на основе ПЦР для выявления паразитов, таких как E.
 histolytica , Cryptosporidium и Giardia . 6
histolytica , Cryptosporidium и Giardia . 6
Эозинофилия
Эозинофилия (количество эозинофилов в крови> 500 / мл), обнаруженная при общем анализе крови у бессимптомных или симптоматических новоприбывших, может указывать на заражение гельминтами, передающимися через почву Strongyloides или Schistosoma .Однако в таблице 3 показаны другие паразитарные и непаразитарные причины, которые врач должен учитывать.
| Паразиты, обычно вызывающие эозинофилию в кале, | Другие паразиты, обычно не обнаруживаемые в кале, которые связаны с эозинофилией | Паразиты, обычно обнаруживаемые в кале, НЕ связаны с эозинофилией | Непаразитарные причины эозинофилии |
А.lumbricoides | Angiostrongylus , | Entamoeba (e.g., E. histolytica , E. dispar ) | Астма |
* Для этих паразитов часто требуется специальное тестирование и / или несколько образцов для постановки диагноза. | |||
Источник: адаптировано из CDC, ноябрь 2013 г. Руководство по изучению кишечных паразитов для домашнего медицинского осмотра вновь прибывших беженцев. | |||
Рекомендации по лечению
Многие простейшие паразиты непатогенны и не требуют лечения (Таблица 2). Однако их присутствие указывает на то, что вновь прибывший пациент провел некоторое время в районах, где плохая санитария и фекально-оральное заражение были обычным явлением.
Лица, у которых при тестировании были обнаружены патогенные паразиты (например,g., амебиаз, стронгилоидоз, шистосомоз), независимо от того, являются ли они симптоматическими или нет, следует лечить, чтобы минимизировать долгосрочные осложнения. 5
Консультация специалиста по детским инфекционным заболеваниям или тропической медицине рекомендуется для:
- Лечение организмов, которые могут персистировать и вызывать хронические заболевания (например, стронгилоидоз, шистосомоз и трематоды пищевого происхождения [сосальщики]).

- Инфекции, требующие лечения по Программе особого доступа Министерства здравоохранения Канады.
- Пациенты с диагнозом серьезных инфекций, таких как нейроцистицеркоз (свиной цепень, который может поражать головной или спинной мозг). Это срочные случаи, и необходима консультация специалиста, чтобы сориентироваться в рисках и преимуществах лечения.
Программа особого доступа Министерства здравоохранения Канады
Практикующие могут приобретать лекарства, которые недоступны для продажи в Канаде, через SAP, Программу особого доступа Министерства здравоохранения Канады. Программа обеспечивает доступ к терапии для пациентов с серьезными заболеваниями в экстренных случаях.Более подробную информацию о программе, а также формы заявки можно найти на веб-сайте Министерства здравоохранения Канады.
Для получения дополнительной информации о лечении детей и подростков с паразитарными инфекциями прочтите:
- Нематоды (круглые черви)
- Трематоды (сосальщики)
- Цестоды или ленточные черви
- Патогенные простейшие и кокцидии
Профилактика
Вакцины для предотвращения паразитарных инфекций желудочно-кишечного тракта отсутствуют.
С 2001 года Всемирная организация здравоохранения рекомендует периодическую профилактическую химиотерапию альбендазолом или мебендазолом для лечения гельминтов, передающихся через почву. Также рекомендуется последующее лечение ивермектином (для Strongyloides ) и празикванталом (для шистосомоза) у детей школьного возраста или для целых групп риска в эндемичных районах. 6
Соединенные Штаты и Австралия предоставляют антипаразитарное лечение перед отъездом для беженцев из районов повышенного риска.Одно исследование почти 27 000 беженцев из Африки и Юго-Восточной Азии ясно показало, что лечение однократной дозой альбендазола значительно снизило распространенность любых гельминтов, передаваемых через почву, с 20,8% до 4,7%. Это лечение также снизило количество нематодных инфекций (аскаридоз и анкилостомоз) на 77%, хотя оно имеет незначительный эффект или не оказывает никакого эффекта против протозойных инфекций ( Giardia, ), S. или ленточные черви. 1,5,7
1,5,7
CDC разработал алгоритм, чтобы помочь клиницистам управлять желудочно-кишечными паразитами у новоприбывших, которые не получали лечения до иммиграции. 1
Паразитарные инфекции желудочно-кишечного тракта у детей иммигрантов и беженцев содержит более подробную информацию, касающуюся скрининга и лечения в Канаде.
Избранные ресурсы
- Австралазийское общество инфекционных болезней. Диагностика, лечение и профилактика инфекций у недавно прибывших беженцев. Сидней, Новый Южный Уэльс: Dreamweaver, 2009.
- Banerji A, Li P, Navaranjan D. Состояние здоровья и питания новых беженцев, иммигрантов и незастрахованных детей в Торонто, Канада.CERIS, Центр метрополии Онтарио, Резюме исследования, октябрь 2012 г.
- Брэдли Дж. С., Нельсон Дж. Д., Кимберлин Д. В. и др. 2014 Педиатрическая антимикробная терапия Нельсона, 20-е изд. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии, 2014. .
- Центры по контролю и профилактике заболеваний (США)
- Cherry JD, Demmler-Harrison GJ, Kaplan SL и др.
 , Ред. Учебник детских инфекционных болезней Фейгина и Черри, 7 изд. Филадельфия, Пенсильвания: Эльзевир, 2014.
, Ред. Учебник детских инфекционных болезней Фейгина и Черри, 7 изд. Филадельфия, Пенсильвания: Эльзевир, 2014. - Daly R, Chiodini PL.Лабораторные исследования и диагностика тропических болезней у путешественников. Infect Dis Clin North Am 2012; 26 (3): 803-18.
- Furst T, Keizer J, Utzinger J. Глобальное бремя трематодоза пищевого происхождения у человека: систематический обзор и метаанализ, Lancet Infect Dis 2012; 12 (3): 210-21.
- Gryseels B. Шистосомоз. Infect Dis Clin North Am 2012; 26 (2): 383-97.
- Harhay MO, Horton J, Olliaro PL. Эпидемиология и борьба с желудочно-кишечными паразитами у детей. Эксперт Rev Anti Infect Ther 2010; 8 (2): 219-34.
- King CH, Dangerfield-Cha M. Непризнанные последствия хронического шистосомоза. Хроническая болезнь 2008; 4 (1): 65-9.
- Manganelli L, Berrilli F, Di Cave D и др. Инфекции кишечных паразитов у детей иммигрантов в Риме, связанные с ними факторы риска и возможное влияние на статус питания.
 Векторы паразитов 2012,5: 265.
Векторы паразитов 2012,5: 265. - Мюнниг П., Паллин Д., Селл Р.Л. и др. Экономическая эффективность стратегий лечения кишечных паразитов у иммигрантов. N Engl J Med 1999; 340 (10): 773-9.
- Пикеринг Л.К., Бейкер С.Дж., Кимберлин Д.В. и др., Ред. Красная книга: Отчет Комитета по инфекционным болезням 2012 г., 29 изд. Элк-Гроув-Виллидж, Иллинойс: Американская академия педиатрии: 194-5, 239-40, 333-5, 411-3, 453-4, 532-3, 537, 643-5, 689-90, 731-2, 848 -68.
- Pottie K, Greenaway C, Feightner J, et al. Доказательные клинические рекомендации для иммигрантов и беженцев. Глава 10: Кишечные паразиты: Strongyloides и Schistosoma. CMAJ 2011; 283 (12): E865-8: www.cmaj.ca/content/183/12/E824.full.pdf + html.
- Агентство общественного здравоохранения Канады, CATMAT. Справка о стойком поносе у возвращающегося путешественника. CCDR, 15 февраля 2006 г .; 32 (ACS-1).
- Sripa B. Глобальное бремя трематодоза пищевого происхождения. Lancet Infecti Dis 2012; 12 (3): 171-2.

- Staat MA, Rice M, Donauer S, et al. Скрининг кишечных паразитов у детей, усыновленных за границей: важность множественных образцов стула. Педиатрия 2011; 128 (3): e613-22.
- Всемирная организация здравоохранения
- Райт SG.Простейшие инфекции желудочно-кишечного тракта. Infect Dis Clin North Am 2012; 26 (2): 323-40.
- Zouré HG, Wanji S, Noma M и др. Географическое распространение лоа-лоа в Африке: результаты широкомасштабного внедрения Процедуры быстрой оценки лоаоза (RAPLOA). PLoS Negl Trop Dis 2011; 5 (6): e1210.
Список литературы
- Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний (Национальный центр новых и зоонозных инфекционных заболеваний), 6 ноября 2013 г.Руководство по кишечным паразитам для внутреннего медицинского осмотра вновь прибывших беженцев: Предполагаемое лечение и скрининг на стронгилоидоз, шистосомоз и инфекции, вызываемые гельминтами, передаваемыми через почву, для беженцев, Отдел глобальной миграции и карантина: www.
 cdc.gov/immigrantrefugeehealth/pdf/intestinal- паразиты-Domestic.pdf
cdc.gov/immigrantrefugeehealth/pdf/intestinal- паразиты-Domestic.pdf - Pottie K, Greenaway C, Feightner J, et al. Доказательные клинические рекомендации для иммигрантов и беженцев. Приложение 8: Хан К., Хайдебрехт С., Сирс Дж. И др .; Канадское сотрудничество по вопросам здоровья иммигрантов и беженцев (CCIRH).Кишечные паразиты — Strongyloides и Schistosoma: обзор данных о вновь прибывших иммигрантах и беженцах: www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.0
/-/DC1. - Министерство здравоохранения Миннесоты. Руководство поставщика медицинских услуг для беженцев из Миннесоты, 2013 г .: Паразитарные инфекции: www.health.state.mn.us/divs/idepc/refugee/guide/7parasites.html
- Боггильд А.К., Йоханна С., Кистоун Дж.С., Каин К.С. Перспективный анализ паразитарных инфекций у канадских путешественников и иммигрантов. J Travel Med 2006; 13 (3): 138-44.
- Swanson SJ, Phares CR, Mamo B и др. Терапия альбендазолом и кишечные паразиты у беженцев, направляющихся в США.
 N Engl J Med 2012; 366 (16): 1498-507.
N Engl J Med 2012; 366 (16): 1498-507.- Кнопп С., Стейнманн, Кейзер Дж., Утцингер Дж. Нематодные инфекции: гельминты и трихинеллы, передающиеся через почву. Инф Дис Клин Норт Ам 2012; 26 (2): 341-58.
- Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний (Национальный центр новых и зоонозных инфекционных заболеваний, Отдел глобальной миграции и карантина), 17 сентября 2013 г.Рекомендации по предполагаемому лечению стронгилоидоза, шистосомоза и гельминтозов, передаваемых через почву, для беженцев, переселяющихся в США: www.cdc.gov/immigrantrefugeehealth/pdf/intestinal-parasites-overseas.pdf
Редактор (ы)
Хизер Оньетт, MD
Последнее обновление: Май 2015 г.
Следуйте за CPS:
Информация о кишечных паразитах | Гора Синай
Квасцы А, Рубино-младший, Ияз МК.
 Глобальная война против кишечных паразитов — следует ли использовать целостный подход? [Рассмотрение]. Int J Заразить Дис . 2010; 14 (9): e732-8.
Глобальная война против кишечных паразитов — следует ли использовать целостный подход? [Рассмотрение]. Int J Заразить Дис . 2010; 14 (9): e732-8.Бетти Л., Требби Г., Маевский В. и др. Использование гомеопатических препаратов в фитопатологических моделях и в полевых испытаниях: критический обзор. Гомеопатия . 2009 Октябрь; 98 (4): 244-66. Рассмотрение.
Dinleyici EC, Eren M, Dogan N, Reyhanioglu S, Yargic ZA, Vandenplas Y. Клиническая эффективность Saccharomyces boulardii или метронидазола у детей с симптомами инфекции Blastocystis hominis. Parasitol Res . 2011; 108 (3): 541-5.
Эль-Он Дж. Современное состояние и перспективы иммунотерапии лейшманиоза. Иср Мед Ассо Дж. . 2009 Октябрь; 11 (10): 623-8. Рассмотрение.
Фартинг MJ. Варианты лечения для искоренения кишечных простейших. Нат Клин Практик Гастроэнтерол Гепатол . 2006; 3 (8): 436-45.
Guarner F. Пребиотики, пробиотики и гельминты: «естественное» решение? Dig Dis.
 2009; 27 (3): 412-7. Рассмотрение.
2009; 27 (3): 412-7. Рассмотрение.Lima AA, Soares AM, Lima NL, et al.Влияние добавок витамина А на функцию кишечного барьера, рост, общие паразитарные и специфические инфекции Giardia spp у бразильских детей: проспективное рандомизированное двойное слепое плацебо-контролируемое исследование. J Педиатр Гастроэнтерол Нутр . 2010; 50 (3): 309-15.
Mishra PK, Palma M, Bleich D, Loke P, Gause WC. Системное влияние кишечных гельминтозов. Иммунол слизистой оболочки . 2014; 7 (4): 753-62.
Missaye A, Dagnew M, Alemu A, Alemu A. Распространенность кишечных паразитов и связанные с ними факторы риска среди пациентов с ВИЧ / СПИДом, проходящих до и после АРТ и посещающих клинику АРТ в больнице Десси, Северо-Восточная Эфиопия. AIDS Res Ther . 2013; 10 (1): 7.
Окении Ж.А., Огунлеси Т.А., Ойэлами О.А., Адейеми Л.А. Эффективность сушеных семян папайи Carica против кишечных паразитозов человека: пилотное исследование. J Med Food .
 2007; 10 (1): 194-6.
2007; 10 (1): 194-6.Оттенхоф М., Байджо А., Мбуги Е.В. и др. Защита от диареи, связанной с Giardia Кишечник, теряется при добавлении нескольких питательных веществ: исследование на танзанийских детях. PLoS Негл Троп Дис . 2011; 5 (6): e1158.
Ричи Б.К., Брюстер Д.Р., Тран С.Д., Дэвидсон Г.П., Макнил Ю., Батлер Р.Эффективность Lactobacillus GG у детей аборигенов с острой диарейной болезнью: рандомизированное клиническое исследование. J Педиатр Гастроэнтерол Нутр . 2010; 50 (6): 619-24.
Рока М., Гони П., Рубио Э., Клавель А. Кишечные паразиты у ВИЧ-серопозитивных пациентов в континентальном регионе Экваториальной Гвинеи: их связь с социально-демографическими факторами, факторами здоровья и иммунной системы. Транс Р Соц Троп Мед Хиг . 2013; 107 (8): 502-10.
Rollemberg CV, Silva MM, Rollemberg KC, et al.Прогнозирование частотного распределения и влияния социально-демографических и поведенческих факторов риска заражения Schistosoma mansoni и анализ коинфекции кишечными паразитами.
 Геоспат Здоровье . 2015; 10 (1): 303.
Геоспат Здоровье . 2015; 10 (1): 303.Инфекция кишечными паразитами, задержкой роста и анемией у детей школьного возраста из Южной Анголы
Абстрактные
Введение
Кишечные паразиты ответственны за заболеваемость детей во всем мире, особенно в странах с низким уровнем доходов.В настоящем исследовании мы определяем распространенность кишечных паразитов и исследуем их связь с анемией и задержкой роста у детей школьного возраста.
Методы
Поперечное исследование проводилось с сентября по октябрь 2010 года, в нем приняли участие 328 детей, посещающих начальную школу в Лубанго, втором по величине городе после столицы Луанды. Образцы стула были собраны для обнаружения паразитов с помощью микроскопии и молекулярной идентификации Entamoeba histolytica и Entamoeba dispar .Задержку роста оценивали с помощью z-баллов роста в зависимости от возраста, а концентрацию гемоглобина определяли с помощью портативной системы анализа гемоглобина.

Результаты
Глобальная распространенность патогенных кишечных паразитов составила 44,2%, из которых наиболее распространенными являются Ascaris lumbricoides (22,0%), Giardia lamblia (20,1%) и Hymenolepis nana (8,8%). Молекулярная диагностика показала, что 13,1% детей носили E . dispar и 0.3% были заражены E . histolytica . Распространенность задержки роста (от легкой до тяжелой) составляла 41,5%. Задержка роста чаще встречалась у детей старшего возраста (p = 0,006, OR = 1,886), тогда как анемия чаще встречалась у детей младшего возраста (p = 0,005, OR = 2,210). Распространенность анемии составила 21,6%, и мы обнаружили значительную связь с инфекцией H . nana (p = 0,031, OR = 2,449).
Выводы
Это одно из немногих опубликованных исследований, в которых сообщается об инфекции кишечными паразитами, состоянии питания и анемии у детей из Анголы.Кроме того, настоящая работа подчеркивает важность регулярного скрининга кишечных паразитов у детей.

Образец цитирования: Oliveira D, Ferreira FS, Atouguia J, Fortes F, Guerra A, Centeno-Lima S (2015) Инфекция кишечными паразитами, задержка роста и анемия у детей школьного возраста из Южной Анголы. PLoS ONE 10 (9): e0137327. https://doi.org/10.1371/journal.pone.0137327
Редактор: Кристофер Р. Вебер, Чикагский университет, США
Поступила: 18 июня 2015 г .; Одобрена: 15 июля 2015 г .; Опубликован: 15 сентября 2015 г.
Авторские права: © 2015 Oliveira et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Доступность данных: Все соответствующие данные находятся в пределах магистерскую диссертацию соответствующего автора, которую можно найти в репозитории Universidade Nova de Lisboa (http://hdl.
 handle.net/10362/15335).
handle.net/10362/15335).Финансирование: Все финансовые расходы были поддержаны Sonangol посредством стипендии, назначенной соответствующему автору.Sonangol не присваивает номера своим грантам (www.sonangol.co.ao). Sonangol не принимал участия в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Министерство здравоохранения Анголы (www.minsa.gov.ao) предоставило лекарства для лечения детей, инфицированных кишечными паразитами.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует. Sonangol является их спонсором через стипендию, назначенную автору-корреспонденту.Это не меняет приверженности авторов политике PLOS ONE в отношении обмена данными и материалами. Sonangol не принимал участия в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. У Sonangol не было коммерческого интереса к исследованию.

Введение
Кишечные паразиты несут ответственность за заболеваемость и смертность во всем мире, особенно в странах с низким уровнем доходов и среди людей с другими заболеваниями [1], и чаще встречаются в жарких и влажных средах, с плохими санитарными условиями, загрязненной водой, плохими жилищными условиями и переполнен [2].Такие среды распространены в пригородах многих африканских городов.
В странах Африки к югу от Сахары дети, особенно дети школьного возраста, непропорционально сильно страдают от гельминтозов, передаваемых через почву [3]. В исследовании, проведенном в Мозамбике, в котором приняли участие 83331 ребенок и молодежь от 7 до 22 лет из 1275 начальных школ, было обнаружено Ascaris lumbricoides (65,8%), Trichuris trichiura (54,0%), анкилостомы (38,7%). %), Entamoeba spp.(31,2%), Giardia lamblia (19,0%), Taenia spp. (5,8%) и Hymenolepis nana (5,2%) [4].
Известно, что недостаточное питание может повысить восприимчивость к инфекции [5], в то время как несколько исследований продемонстрировали связь между заражением кишечными паразитами и недостаточным питанием [6–8].
 Следовательно, инфицирование кишечными паразитами и пищевой статус влияют друг на друга в порочном круге, и трудно установить эффект каждого из них.
Следовательно, инфицирование кишечными паразитами и пищевой статус влияют друг на друга в порочном круге, и трудно установить эффект каждого из них.Помимо пищевого статуса, железодефицитная анемия также была связана с инфицированием кишечными паразитами, а именно Schistosoma mansoni , анкилостомами, T . trichiura и A . lumbricoides [9]. Анемия имеет комплекс этиологических факторов, включая дефицит питательных микроэлементов (железа, фолиевой кислоты, рибофлавина, витаминов A и B12), гемоглобинопатии и паразитарные инфекции [10].
Настоящее исследование было направлено на определение распространенности кишечных паразитов у детей от 5 до 12 лет, посещающих начальную школу, в общине Лукреция, Лубанго, Ангола, в сентябре и октябре 2010 г. задержка роста и анемия.
Методы
Дизайн исследования
Поперечное исследование было проведено в период с сентября по октябрь 2010 г. в 3 государственных начальных школах общины Лукреция, город Лубанго, провинция Уила, Ангола.
 Исследование проводилось в сотрудничестве с местными органами здравоохранения и образования, включая Управление образования провинции и Управление здравоохранения провинции.
Исследование проводилось в сотрудничестве с местными органами здравоохранения и образования, включая Управление образования провинции и Управление здравоохранения провинции.Исследуемая популяция и выборка
Исследуемую популяцию составляли дети в возрасте от 5 до 12 лет, посещающие 3 государственные начальные школы в общине Лукреция, Лубанго, Ангола: Escola Primária N ° 194 с 1590 детьми, Escola Primária Abrigo Anjo da Guarda с 382 детьми и Escola 1 °. де Дезембро с 651 ребенком, с общим населением 2623 ребенка (N).Размер выборки был рассчитан по следующей формуле: n ≥ ⌈ [ Z 2 p (1 — p)] / [Δ 2 ] ⌉, где n — требуемый размер выборки, Z (квантиль 0,975 нормального распределение для доверительного интервала 95%) = 1,96, p — распространенность кишечных паразитов в популяции, которая, будучи неизвестной, принималась равной 0,5 и Δ (ошибка) = 0,05. Значение было исправлено следующим образом: n ′ = n × [(N — n) / (N — 1)]. Предполагаемый минимальный размер выборки составил 329 детей.
 Были собраны данные от 329 детей.Однако в связи с тем, что одному из них менее 5 лет, было зачислено 328 детей.
Были собраны данные от 329 детей.Однако в связи с тем, что одному из них менее 5 лет, было зачислено 328 детей.Паразитологическая диагностика
Учитель дал каждому ребенку родителям / опекунам стерильный контейнер и объяснил процедуру взятия одного образца стула. Часть каждого свежего образца стула хранилась в пробирке Эппендорфа с жидкостью для хранения и транспортировки Protofix ( Alexon-Trend , Inc ), а другая часть сохранялась в фильтровальной бумаге ( Generation® Blood Collection Card ). , Qiagen ) для последующего молекулярного анализа.
Обнаружение и идентификация паразитов в кале проводилось путем микроскопического исследования образцов на йод [11] в Институте гигиены и тропической медицины в Лиссабоне, Португалия. Каждый образец исследовали в трех экземплярах два обученных микроскописта. Техника концентрации не применялась.
Молекулярный анализ
ДНКбыла выделена из всех образцов, в которых с помощью микроскопии были обнаружены цисты Entamoeba histolytica / dispar [12–13].
 Молекулярная идентификация E . histolytica и E . ДНК dispar анализировали, как описано в [14], с 40 циклами амплификации. Кроме того, внутренний контроль амплификации также выполнялся во всех образцах, как описано ранее [15], с 40 циклами амплификации во второй реакции амплификации.
Молекулярная идентификация E . histolytica и E . ДНК dispar анализировали, как описано в [14], с 40 циклами амплификации. Кроме того, внутренний контроль амплификации также выполнялся во всех образцах, как описано ранее [15], с 40 циклами амплификации во второй реакции амплификации.Антропометрия
Рост измеряли настенным ростомером Seca 208 (точность 0,1 см) с положением головы ребенка по Франкфуртской плоскости.Z-баллы роста по возрасту рассчитывались с использованием программного обеспечения ВОЗ AnthroPlus. Рост для возраста является индикатором задержки роста, классифицируемого как легкое (z-баллы <-1 и ≥-2), умеренное (z-баллы <-2 и ≥-3) и тяжелое (z-баллы <-3) [ 16].
Диагностика анемии
Одно измерение концентрации гемоглобина у каждого ребенка проводилось с использованием портативной системы анализа гемоглобина HB 301+ ( HemoCue® AB , Angelhome , Sweden ). Классификация детей с анемией и без анемии, а затем с легкой, средней и тяжелой анемией, проводилась в соответствии с контрольными значениями, скорректированными с учетом высоты [17] (таблица 1), поскольку Лубанго находится на высоте 1786 метров над уровнем моря [18].

Лечение детей
Лечение инфицированных детей назначил врач-инфекционист и тропическая медицина. Национальная программа по борьбе с забытыми заболеваниями предоставила лекарства, которые были выданы родителям / опекунам после краткого объяснения местных врачей педиатрической больницы Лубанго.
Статистическая методология
База данных была построена с использованием SPSS (версия 19). Связь между двумя качественными переменными была исследована с использованием критерия хи-квадрат или точного критерия Фишера, когда это необходимо.
Модели многомерной регрессии применялись для зависимых переменных, задержки роста и анемии, включая независимые переменные, для которых статистически значимая связь была обнаружена с помощью бинарной регрессии ( p <0,05).
Этические соображения
Это исследование было одобрено Министерством здравоохранения Анголы и Этическим комитетом IHMT в Португалии, а также провинциальными органами здравоохранения и образования.
 Были включены только дети, родители / опекуны которых подписали информированное согласие.Когда родители / опекуны не умели читать или писать, один из членов команды читал вслух, а затем требовал отпечаток пальца и подпись свидетеля.
Были включены только дети, родители / опекуны которых подписали информированное согласие.Когда родители / опекуны не умели читать или писать, один из членов команды читал вслух, а затем требовал отпечаток пальца и подпись свидетеля.Результаты
328 детей были в возрасте от 5,43 до 12,98 лет (средний возраст 9,61 и стандартное отклонение 2,02). 52,8% (173/328) были младше 10 лет, а женщины составляли 56,4% (185/328) включенных участников.
Анализ образцов стула показал, что 44,2% (145/328) детей были инфицированы по крайней мере одним видом патогенных кишечных паразитов.Гельминты встречались чаще, чем простейшие, заражая 24,1% (79/328) против 13,4% (44/328) исследуемых детей. Коинфекция простейшими и гельминтами произошла у 6,7% (22/328) включенных участников. Параллельно единичные инфекции встречались чаще (35,7%, 117/328), чем коинфекции (8,5%, 28/328). В глобальном масштабе наиболее распространенным паразитом был A . lumbricoides при единичных или смешанных инфекциях, обнаруженных у 22,0% (72/328) детей, за которыми следует G .
 lamblia с 20,1% (66/328) и H . nana с 8,8% (29/328) (Таблица 2). ДНК E . histolytica был обнаружен в одном образце (0,3%), в то время как 43 ребенка носили E . dispar ДНК (13,1%). Статистически значимой разницы в распространенности кишечных паразитов ни по полу, ни по возрасту не наблюдалось (таблица 3).
lamblia с 20,1% (66/328) и H . nana с 8,8% (29/328) (Таблица 2). ДНК E . histolytica был обнаружен в одном образце (0,3%), в то время как 43 ребенка носили E . dispar ДНК (13,1%). Статистически значимой разницы в распространенности кишечных паразитов ни по полу, ни по возрасту не наблюдалось (таблица 3).Распространенность задержки роста составляла 41,5% (136/328) и была в основном легкой. Анемия выявлена у 21.6% (71/328) детей и чаще всего был умеренным. Случаев тяжелой анемии не выявлено (таблица 4).
Демографические характеристики и инфекции, вызываемые патогенными кишечными паразитами, использовались в качестве независимых переменных в бинарной регрессии для определения задержки роста и анемии. Задержка роста была связана с возрастом, типом инфекции, инфекцией H . Нана , А . lumbricoides (в коинфекции) и G . lamblia (в коинфекции).
 Возраст и зараженность по H . nana (общая и коинфекция) были достоверно связаны с анемией (таблица 5).
Возраст и зараженность по H . nana (общая и коинфекция) были достоверно связаны с анемией (таблица 5).Модели многомерной регрессии для объяснения задержки роста и анемии были определены с использованием переменных, которые оказались значимо связанными ( p <0,05) в бинарном анализе.
Согласно многомерной регрессионной модели задержки роста, статистически значимым был только возраст ( p = 0,006). Задержка роста чаще встречалась у детей в возрасте от 10 до 12 лет по сравнению с детьми младшего возраста (OR: 1.886; IC95% (OR): 1,199–2,967) с поправкой на инфекции (таблица 6).
В многомерной регрессионной модели анемии с поправкой на возрастную группу и инфекцию на H . nana , обе переменные были статистически значимыми ( p = 0,005 e p = 0,031 соответственно) (Таблица 7).
Обсуждение
Анализ образцов стула показал, что 44,2% (145/328) детей в исследовании были инфицированы по крайней мере одним типом патогенных кишечных паразитов.
 Эта распространенность ниже, чем 80,0%, обнаруженных в провинции Бие, Ангола, в исследовании, в котором участвовал 791 ребенок в возрасте от 6 до 10 лет [19]. Разница между двумя показателями распространенности может быть связана с тем фактом, что непатогенные простейшие были включены в исследование из Биэ [19].
Эта распространенность ниже, чем 80,0%, обнаруженных в провинции Бие, Ангола, в исследовании, в котором участвовал 791 ребенок в возрасте от 6 до 10 лет [19]. Разница между двумя показателями распространенности может быть связана с тем фактом, что непатогенные простейшие были включены в исследование из Биэ [19].В нашем исследовании A . lumbricoides был наиболее распространенным гельминтом, передаваемым через почву (22,0%), в то время как распространенность других гельминтов была очень низкой, менее 2% (1,5% для анкилостомов и 0.3% для T . тричиура ). Это могло быть связано с сопротивлением яиц A . lumbricoides к типу почвы в Лубанго, городе, расположенном на высоте 1786 метров [18], как яйца A . lumbricoides выдерживает более 2 лет при температуре 5–10 ° C [20]. Например, в провинции Бенго на северо-западе Анголы исследование, проведенное только на гельминты, передающиеся через почву, у 1142 детей школьного возраста (6–15 лет) из трех общин (Кашито, Мабубас и Окуа) в муниципалитете Данде, показало распространенность 31.
 6% [21].
6% [21].Распространенность E . histolytica во всем мире остается неизвестным, потому что очень мало исследований используют молекулярные методы, особенно в Африке. Пропорция E . histolytica / E . dispar , обнаруженный в настоящем исследовании (1/43), подчеркивает важность выхода за рамки микроскопии для идентификации видов Entamoeba . В исследовании, проведенном в городе Горган, расположенном на севере Ирана, было собрано 105 образцов дизентерии у детей, госпитализированных в больницу Талегани, и 25 были положительными на комплекс Entamoeba при прямом микроскопическом исследовании, но ПЦР с использованием положительного контроля показала E . histolytica и E . dispar только в 2 и 3 образцах соответственно [22]. Только E . histolytica считается патогенным [23], эти данные подтверждают необходимость подтверждения результатов микроскопии, чтобы избежать ненужного лечения.
 Это может быть выполнено с помощью молекулярной диагностики в регионах с адекватными лабораторными ресурсами или путем обнаружения специфического антигена (ELISA / RDT) в регионах с недостаточными лабораторными ресурсами.
Это может быть выполнено с помощью молекулярной диагностики в регионах с адекватными лабораторными ресурсами или путем обнаружения специфического антигена (ELISA / RDT) в регионах с недостаточными лабораторными ресурсами.Задержка в росте представляет собой хроническое состояние недостаточности питания [24], которое часто начинается в матке из-за недостаточного питания матери [25].Большинство исследований, связанных с данными отчетов о недостаточном питании, были сосредоточены на детях в возрасте до 5 лет. Однако недостаток питания у школьников также важен, поскольку он ставит под угрозу физическое и когнитивное развитие и отрицательно влияет на их способность к обучению [26]. Здесь мы обнаружили, что 41,5% (136/328) обследованных школьников имели задержку роста. Другое исследование, проведенное в северной Анголе, показало, что 32,2% населения в возрасте от 6 месяцев до 20 лет имели умеренную или серьезную задержку роста [21].
В настоящем исследовании задержка роста была связана с возрастной группой, которая чаще встречается у детей в возрасте от 10 до 12 лет по сравнению с детьми младше 10 лет, что может быть связано с тем, что дети старшего возраста пережили самые тяжелые времена нехватки продовольствия в Ангола связана с периодом войны, закончившейся в 2002 году.

Измерение гемоглобина показало, что 21,6% (71/328) детей в исследовании страдали анемией. Это значение немного ниже 29,7% по данным скрининга, проведенного в Анголе в период с 1998 по 1999 год среди 825 детей в возрасте до 5 лет [27].Это различие может быть связано с разницей в возрастных группах между скрининговыми обследованиями, поскольку известно, что анемия чаще встречается у детей дошкольного возраста [28].
Результаты опроса 2168 детей в возрасте ≤ 15 лет в муниципалитете Данде на севере Анголы предполагают связь между H . nana инфекция и боли в животе в анамнезе и H . nana и T . trichiura коинфекция с острым истощением у детей в возрасте до 5 лет [29].Наши результаты показали, что H . nana был связан с анемией у исследуемых детей, в то время как другое исследование показало, что среднее значение гемоглобина (%), количества эритроцитов и лейкоцитов и гематокрита (%) показало общее снижение, но без существенной разницы в H .
 nana пациентов и контроль, обозначающих предрасположенность к анемии [30]. В исследовании, в котором участвовали дошкольники из лагерей для перемещенных лиц, штат Хартум, Судан, диарея была значимо связана с H . nana инфекция [31]. Однако гименолепидоз отсутствует в руководствах ВОЗ по программам борьбы с гельминтами [29].
nana пациентов и контроль, обозначающих предрасположенность к анемии [30]. В исследовании, в котором участвовали дошкольники из лагерей для перемещенных лиц, штат Хартум, Судан, диарея была значимо связана с H . nana инфекция [31]. Однако гименолепидоз отсутствует в руководствах ВОЗ по программам борьбы с гельминтами [29].Ограничение этого исследования может быть связано с тем фактом, что анализировался только один образец стула на ребенка и не применялись техники концентрации или Като-Каца, что может недооценивать распространенность кишечных паразитов. Однако, чтобы свести к минимуму эту ситуацию, каждый образец исследовали в трех экземплярах двумя обученными микроскопистами.
Почти половина (44.2%) обследованных детей были инфицированы хотя бы одним типом патогенных кишечных паразитов. Статистически значимой связи между задержкой роста и инфекцией кишечных паразитов не наблюдалось. Значительная связь между заражением H . nana и обнаружена анемия.
 Эти результаты особенно важны в контексте здоровья в Анголе из-за нехватки исследований по этой теме, предоставляющих информацию для планирования и реализации программы борьбы, которая связывает борьбу с кишечными паразитами, недостаточным питанием и анемией.
Эти результаты особенно важны в контексте здоровья в Анголе из-за нехватки исследований по этой теме, предоставляющих информацию для планирования и реализации программы борьбы, которая связывает борьбу с кишечными паразитами, недостаточным питанием и анемией.Благодарности
Авторы благодарны детям и их юридическим репетиторам, принявшим участие в исследовании. Мы также хотим поблагодарить персонал педиатрической больницы Лубанго, особенно Мариану Мигель и Россану Чипалавела, за последующее наблюдение за детьми, когда это необходимо. Мы также хотели бы поблагодарить Элеонору Пайшао из Института Рикардо Хорхе, Лиссабон, за ее помощь в статистической поддержке.
Вклад авторов
Эксперимент задумал и спроектировал: DO FF AG SCL.Проведены эксперименты: ДО ФСФ СКЛ. Проанализированы данные: DO SCL. Предоставленные реагенты / материалы / инструменты анализа: DO FF. Написал статью: DO FSF JA FF AG SCL. Назначили лечение инфицированным детям: JA.
Ссылки
- 1.
 Ньяранго Р.М., Алоо П.А., Кабиру Е.В., Ньянчонги Б.О. Риск заражения патогенными кишечными паразитами в муниципалитете Кисии, Кения. BMC Public Health. 14 июля 2008 г.; 8 (237).
Ньяранго Р.М., Алоо П.А., Кабиру Е.В., Ньянчонги Б.О. Риск заражения патогенными кишечными паразитами в муниципалитете Кисии, Кения. BMC Public Health. 14 июля 2008 г.; 8 (237). - 2. Harhay MO, Horton J, Olliaro PL.Эпидемиология и борьба с желудочно-кишечными паразитами у детей. Эксперт Rev Anti Infect Ther. 2010 февраль; 8 (2): 219–34. pmid: 20109051
- 3. Хотез П.Дж., Камат А. Забытые тропические болезни в Африке к югу от Сахары: обзор их распространенности, распространения и бремени болезней. PLoS Negl Trop Dis. 2009 август; 3 (8).
- 4. Аугусто Дж., Нала Р., Касмо В., Сабонете А., Мапако Л., Монтейро Дж. Географическое распространение и распространенность шистосомоза и гельминтов, передающихся через почву, среди школьников в Мозамбике.Am J Trop Med Hyg. 2009. 81 (5): 799–803. pmid: 19861614
- 5.
Катона П., Катона-Апте Дж. Взаимодействие между питанием и инфекцией. Clin Infect Dis. 2008 15 мая; 46 (10): 1582–8.
 pmid: 18419494
pmid: 18419494 - 6. Ботеро-Гарсес JH, Гарсия-Монтойя GM, Грисалес-Патиньо D, Агирре-Асеведо, округ Колумбия, Альварес-Урибе MC. Giardia Кишечник и состояние питания у детей, участвующих в программе дополнительного питания, Антиокия, Колумбия, с мая по октябрь 2006 г.Rev Inst Med trop S Paulo. 2009 Май-июнь; 51 (3): 155–162. pmid: 19551290
- 7. Casapía M, Joseph SA, Núñez C, Rahme E, Gyorkos TW. Факторы паразитарного риска задержки роста у учащихся 5-х классов в сообществе крайней бедности в Перу. Int J Parasitol. 2006; 36: 741–47. pmid: 16650426
- 8. Jardim-Botelho A, Brooker S, Geiger SM, Fleming F, Souza Lopes AC, Diemert DJ и др. Возрастные особенности недоедания и заражения гельминтами в сельской местности Бразилии: ассоциации с аскаридозом и анкилостомами.Trop Med Int Health. 2008 Апрель; 13 (4): 458–67. pmid: 18312476
- 9.
Брито Л.Л., Баррето М.Л., Сильва RCR, Ассис АМО, Рейс М.Г., Паррага И.
 М. и др. Коинфекции средней и низкой интенсивности, вызываемые кишечными гельминтами и Schistosoma mansoni , потребление железа с пищей и анемия у детей Бразилии. Am J Trop Med Hyg. 2006. 75 (5): 939–44. pmid: 17123992
М. и др. Коинфекции средней и низкой интенсивности, вызываемые кишечными гельминтами и Schistosoma mansoni , потребление железа с пищей и анемия у детей Бразилии. Am J Trop Med Hyg. 2006. 75 (5): 939–44. pmid: 17123992 - 10. Midzi N, Mtapuri-Zinyowera S, Mapingure MP, Sangweme D, Chirehwa MT, Brouwer KC, et al. Последствия полипаразитизма при анемии среди детей младшего школьного возраста в Зимбабве.Acta Trop. Июль-август 2010 г., 115 (1–2): 103–11. pmid: 20175980
- 11. ВОЗ. Справочные материалы для диагностики кишечных паразитов. Женева: ВОЗ, 1994.
- 12. Феррейра Ф.С., Сентено-Лима С., Гомеш Дж., Роза Ф., Росадо В., Паррейра Р. и др. Молекулярная характеристика Giardia duodenalis у детей из природного парка лагуны Куфада, Гвинея-Бисау. Parasitol Res. 2012 23 августа; 111 (5): 2173–7. pmid: 22 9
- 13. Феррейра Ф. С., Мачадо Са да Бандейра Р. А., Константино Калифорния, да Фонсека А. М., Гомеш Дж. Г., Родригес Р. М. и др.Молекулярная и клиническая характеристика инфекции Giardia duodenalis у детей дошкольного возраста из Лиссабона, Португалия. J Parasitol Res. 2013.
- 14. Hamzah Z, Petmitr S, Mungthin M, Leelayoova S, Chavalitshewinkoon-Petmitr P. Дифференциальное обнаружение Entamoeba histolytica , Entamoeba dispar и Entamoeba moshkovskii с помощью одноразового ПЦР-анализа. J Clin Microbiol. 2006 сентябрь; 44 (9): 3196–200. pmid: 16954247
- 15.Парижа С.К., Хайрнар К. Обнаружение экскреторной ДНК Entamoeba histolytica в моче и обнаружение E . histolytica ДНК и лектиновый антиген в гное абсцесса печени для диагностики амебного абсцесса печени. BMC Microbiol. 2007 18 мая; 7 (41).
- 16. Стивенс Г.А., Финукейн М.М., Пасиорек С.Дж., Флаксман С.Р., Уайт Р.А., Доннер А.Дж. и др. Тенденции легкой, средней и тяжелой задержки роста и недостаточного веса, а также прогресс в достижении ЦРТ 1 в 141 развивающейся стране: систематический анализ репрезентативных данных по населению.Ланцет. 2012, 1 сентября; 380 (9844): 824–34. pmid: 22770478
- 17. ВОЗ. Концентрация гемоглобина для диагностики анемии и оценки степени тяжести. Женева: ВОЗ, 2011. 6 стр.
- 18. Давуд Р. Сауде душ Виахантес: como manter-se saudável no estrangeiro. Мем Мартинс: Европа-Америка; 2005.
- 19. Tomlinson M, Adams V, Chopra M, Jooste P, Strydom E, Dhansay A. Исследование йодной недостаточности и кишечных паразитарных инфекций у школьников: провинция Бие, Ангола.Public Health Nutr. 26 марта 2010 г .; 13 (9): 1314–8. pmid: 20338085
- 20. Дент А.Е., Казура Ю.В. Аскаридоз ( Ascaris lumbricoides ). В: Kliegman RM, Stanton BF, St. Geme JW III, Schor NF, Behrman RE, редакторы. Учебник педиатрии Нельсона. 19 изд. Филадельфия: Эльзевьер Сондерс; 2011.
- 21. Соуза-Фигейредо Дж. К., Гамбоа Д., Педро Дж. М., Фансони К., Ланга А. Дж., Магальяйнс Р. Дж. И др. Эпидемиология малярии, шистосомоза, геогельминтов, анемии и недоедания в контексте системы демографического надзора в Северной Анголе.PLoS One. 2012 6 апреля; 7 (4).
- 22. Шарбатхори М., Наземальхоссейни-Мохарад Э, Черагали Ф., Магсудлоорад Ф.С., Тахеркхани Х., Вакили М. Дискриминация Entamoeba Spp. у детей с дизентерией. Gastroenterol Hepatol Bed Bench. 2014 Лето; 7 (3): 164–7. pmid: 25120897
- 23. Али И.К.М., Кларк К.Г., Петри В.А. Младший. Молекулярная эпидемиология амебиаза. Заразить Genet Evol. 2008 Сен; 8 (5): 698–707. pmid: 18571478
- 24. Casapía M, Joseph SA, Núñez C, Rahme E, Gyorkos TW.Паразитарные и материнские факторы риска недоедания у детей дошкольного возраста в Белене, Перу, с использованием новых Стандартов роста детей ВОЗ. Br J Nutr. 2007. 98: 1259–66. pmid: 17651519
- 25. ДЬЮИ К., БЕГУМ К. Долгосрочные последствия задержки роста в раннем возрасте. Matern Child Nutr. 2011 Октябрь; 7 (Дополнение 3): 5–18. pmid: 21929633
- 26. Best C, Neufingerl N, van Geel L, van den Briel T, Osendarp S. Состояние питания детей школьного возраста: почему мы должны заботиться ?. Еда Nutr Bull.2010 Сен; 31 (3): 400–17. pmid: 20973461
- 27. ВОЗ. Распространенность анемии в мире 1993–2005 гг .: Глобальная база данных ВОЗ по анемии. Женева: ВОЗ, 2008. 40 с.
- 28. Флеминг А.Ф., Сильва П.С. Гематологические болезни в тропиках. В: Cook GC, Zumla AI, редакторы. Тропические болезни Мэнсона. 22-е изд. Эльзевьер Сондерс; 2009.
- 29. Magalhães RJS, Fançony C, Gamboa D, Langa AJ, Sousa-Figueiredo JC, Clements ACA и др. Расширение контроля над гельминтами за пределы ППГ и шистосомоза: случай гименолепидоза человека.PLoS Negl Trop Dis. 2013 24 октября; 7 (10).
- 30. Мохаммад МА, Хегази МА. Кишечная проницаемость Hymenolepis nana по результатам неинвазивного теста двойной проницаемости лактулоза / маннитол и его влияние на параметры питания пациентов. J Egypt Soc Parasitol. 2007 декабрь; 37 (3): 877–91. pmid: 18383790
- 31. Хамид ММА, Эльджек ИА, Осман МКМ, Элаагип АХ, Мунир МС. Распространенность Hymenolepis nana среди детей дошкольного возраста из перемещенных общин в штате Хартум, Судан: перекрестное исследование.2015 март-апрель; 13 (2): 172–7.
Кишечные паразиты — обзор
Кишечные инфекции
Кишечные паразиты распространены как у детей-беженцев, так и у детей, усыновленных за границей; Уровень инфицирования зависит от возраста и страны происхождения. 12–14,17–24,48–52 Хотя большинство детей не проходили тестирование до приезда в США, перед отъездом в США рекомендуется предварительное лечение беженцев из определенных регионов мира. 53 Всем беженцам из Ближнего Востока, Южной и Юго-Восточной Азии рекомендуется принимать альбендазол от аскариды и ивермектин для лечения Strongyloides stercoralis . Африканские беженцы также должны пройти предполагаемое лечение от Strongyloides, , а беженцам из эндемичных по шистосомозу районов следует назначить лечение празиквантелом. В африканских странах, где микрофиляриозная инфекция Loa loa является эндемической, ивермектин не следует назначать для Strongyloides , поскольку лечение ивермектином в присутствии Loa loa было связано с энцефалопатией; вместо этого назначается 7-дневный курс альбендазола.Дополнительные сведения о национальных рекомендациях, времени, дозировке и продолжительности лечения можно найти в рекомендациях Центров по контролю и профилактике заболеваний (CDC) по уходу за беженцами и иммигрантами, доступным на веб-сайте CDC (http: //www.cdc .gov / immigrantrefugeehealth /guidelines / domestic /estive-parasites-domestic.html). 53
В обеих группах иммигрантов можно увидеть множество различных паразитов, как патогенных, так и непатогенных (таблица 4.2). Беженцы по сравнению с детьми, усыновленными за границей, чаще болеют нематодами и трематодами.У приемных детей распространенность кишечных паразитов колеблется от 9% до 51% в зависимости от возраста ребенка и страны происхождения; Дети старшего возраста и дети из других стран, кроме Кореи, имеют более высокие показатели. 17–24,52 Одно исследование с участием детей, усыновленных за рубежом, показало, что общая распространенность кишечных паразитов составляла 29%; 19% имели Giardia Кишечник, и <1% имели гельминты. 52 Более высокая распространенность была обнаружена у детей старшего возраста, но не было повышенного риска при наличии недоедания или желудочно-кишечных симптомов. 52,53 Напротив, среди беженцев у 17% детей было лямблии, , тогда как у 19% были гельминты. 51
Как беженцы (которых нельзя предположить, что они прошли курс лечения), так и усыновленные должны быть проверены на наличие кишечных паразитов по прибытии в США. 5–8 Диагноз ставится на основании исследования консервированного стула на наличие яйцеклеток и паразитов; испытание нескольких образцов увеличивает чувствительность: 52,54,55 с выходом 79% для 1 образца, 92% для 2 образцов и дополнительных 8% для 3-го образца. 52 Один образец кала также должен быть оценен на предмет G. Кишечник и Cryptosporidium parvum с помощью теста на антиген. 8 Повторные пробы стула необходимы для оценки эффективности лечения идентифицированного паразита и определения наличия новых (или недавно обнаруженных) патогенов. Если симптомы у ребенка сохраняются, необходимы дополнительные исследования стула и тестирование на других паразитов, таких как Cyclospora и S.Stercoralis следует учитывать. У приемных детей скрининг на паразитоз по количеству эозинофилов не показан, потому что большинство инфекций вызываются простейшими (G. кишечник) и немигрирующими нематодами (острицами), которые не вызывают эозинофилию периферической крови. 8 Однако для любой группы детей с отрицательными результатами обследования яиц стула и паразитов и эозинофилией (абсолютное количество эозинофилов превышает 450 клеток / мм 3 ) следует провести дополнительное серологическое тестирование. 4,5,8 В этом случае необходимо провести серологическое тестирование на S. stercoralis , независимо от страны происхождения. Более того, дети с эозинофилией из стран Африки к югу от Сахары, Юго-Восточной Азии или регионов Латинской Америки, эндемичных по шистосомозу, должны пройти серологическое тестирование на вид Schistosoma . Аналогичным образом, тестирование на филяриатоз следует проводить у детей с эозинофилией, которые происходят из районов, эндемичных по филяриатозу. Поскольку различные паразиты могут вызывать филяриоз (см. Главу 278), при положительных результатах анализов рекомендуется проконсультироваться со специалистом по инфекционным заболеваниям, имеющим опыт лечения этого заболевания, для обеспечения правильного лечения.
Бактериальные кишечные патогены встречаются реже, чем кишечные паразиты у иммигрантов и усыновленных; однако в большинстве исследований систематическая оценка этих групп на предмет бактериальных заболеваний не проводилась. Дети с кровавой диареей или диареей, связанной с высокой температурой, должны пройти исследование стула на бактериальные энтеропатогены (например, Salmonella, Shigella, Yersinia, Campylobacter ) как часть первоначальной оценки. 8
Кишечные паразитарные инфекции среди детей в возрасте до пяти лет с диарейными заболеваниями в двух государственных медицинских учреждениях в Хавасе, Южная Эфиопия | Инфекционные болезни бедности
- 1.
Всемирная организация здравоохранения. Информационный бюллетень о диарейных заболеваниях. По состоянию на 7 мая 2014 г. Доступно по адресу http://www.who.int/mediacentre/factsheets/fs330/en/.
- 2.
ЮНИСЕФ / ВОЗ. Диарея: почему дети все еще умирают и что можно сделать. Нью-Йорк: ЮНИСЕФ / ВОЗ; 2009.
- 3.
Mandomando IM, Macete EV, Ruiz J, Sanz S, Abacassamo F, Vallès X, et al. Этиология диареи у детей младше 5 лет, госпитализированных в сельскую больницу Южного Мозамбика. Am J Trop Med Hyg.2007. 76: 522–7.
PubMed Google ученый
- 4.
Sergio JV, de Leon Ponce AC. Анализ смертности от диарейных заболеваний среди детей в возрасте до пяти лет в городах Бразилии с населением более 150 000 человек. Cad Saude Publica. 2009; 25: 1093–102.
Артикул PubMed Google ученый
- 5.
Всемирная гастроэнтерологическая организация (WGO). Глобальные рекомендации Всемирной гастроэнтерологической организации: острая диарея у взрослых и детей: глобальная перспектива.Милуоки: WGO; 2012.
- 6.
Абера А., Нибрет Э. Распространенность желудочно-кишечных гельминтозов и связанных с ними факторов риска среди школьников в городе Тилили на северо-западе Эфиопии. Азиатский Pac J Trop Med. 2014; 7: 525–30.
Артикул PubMed Google ученый
- 7.
Матевос Б., Алему А., Вольдейоханнес Д., Алему А., Аддис З., Тирунех М. и др. Текущее состояние гельминтов, передаваемых через почву, и инфекции Schistosoma mansoni среди детей в двух начальных школах в Северном Гондэре, Северо-Западная Эфиопия: перекрестное исследование.BMC Res Notes. 2014; 7: 88.
PubMed Central Статья PubMed Google ученый
- 8.
Гетане А., Медхин Г., Шимелис Т. Cryptosporidium и Strongyloides stercoralis инфекции среди людей с ВИЧ-инфекцией и без нее и эффективность методов диагностики Strongyloides в больнице Йиргалем на юге Эфиопии. BMC Res Notes. 2010; 3: 90.
PubMed Central Статья PubMed Google ученый
- 9.
Алему А., Атнафу А., Аддис З., Шиферау Й., Теклу Т., Матевос Б. и др. Гельминты, передаваемые через почву, и инфекций Schistosoma mansoni среди школьников в городе Зарима на северо-западе Эфиопии. BMC Infect Dis. 2011; 11: 189.
PubMed Central Статья PubMed Google ученый
- 10.
Jejaw A, Zemene E, Alemu Y, Mengistie Z. Высокая распространенность Schistosoma mansoni и других кишечных паразитов среди детей младшего школьного возраста на юго-западе Эфиопии: кросс-секционное исследование.BMC Public Health. 2015; 15: 600.
PubMed Central Статья PubMed Google ученый
- 11.
Дана Д., Меконнен З., Эмана Д., Аяна М., Гетачью М., Воркне Н. и др. Распространенность и интенсивность заражения гельминтами, передаваемыми через почву, среди детей дошкольного возраста в 12 детских садах в городе Джимма на юго-западе Эфиопии. Trans R Soc Trop Med Hyg. 2015; 109: 225–7.
Артикул PubMed Google ученый
- 12.
Федеративная Демократическая Республика Эфиопия. Национальная стратегия гигиены и санитарии Министерство здравоохранения. Декабрь 2005 г.
- 13.
Обзор демографии и здоровья Эфиопии (EDHS) 2011. Центральное статистическое агентство, Аддис-Абеба, Эфиопия, ICF International Calverton, Мэриленд, США, 2012 г.
- 14.
Mulatu G, Beyene G, Zeynudin A. Распространенность видов Shigella , salmonella и campylobacter и особенности их восприимчивости среди детей в возрасте до пяти лет с диареей в городе Хавасса, Южная Эфиопия.Эфиоп J Health Sci. 2014; 24: 101–8.
PubMed Central Статья PubMed Google ученый
- 15.
Abu-Elyazeed RR, Wierzba TF, Frenck RW, Putnam SD, Rao MR, Savarino SJ, et al. Эпидемиология диареи, вызванной Shigella , у сельских детей Египта. Am J Trop Med Hyg. 2004. 71: 367–72.
PubMed Google ученый
- 16.
фон Зейдлейн Л., Ким Д.Р., Али М., Ли Х., Ван Х, Тим В.Д. и др.Многоцентровое исследование диареи Shigella в шести азиатских странах: бремя болезни, клинические проявления и микробиология. PLoS Med. 2006; 3: e353.
Артикул Google ученый
- 17.
Jiao BX, Wang HZ, Liu Y, Li J, Guo J, Li M и др. Клинические особенности инфекции Cryptosporidium у больных ВИЧ / СПИДом с хронической диареей. Чжунхуа И Сюэ За Чжи. 2011; 91: 2611–4.
PubMed Google ученый
- 18.
Чизбро М. Руководство по медицинской лаборатории для тропических стран, вып. 1. 2-е изд. Великобритания: Кембриджская пресса; 2006. с. 292–08.
Google ученый
- 19.
Manrique-Abril FG, Tigne y Diane B, Bello SE, Ospina JM. Возбудители диареи у детей младше пяти лет в Тунхе, Колумбия. Преподобный Салуд Публика (Богота). 2006; 8: 88–97.
Артикул Google ученый
- 20.
Su C, Cao Y, Zhang M, Kaplan J, Su L, Fu Y, et al. Гельминтозная инфекция нарушает опосредованное аутофагией уничтожение бактериальных энтеропатогенов макрофагами. J Immunol. 2012; 189: 1459–66.
PubMed Central CAS Статья PubMed Google ученый
- 21.
Mitikie G, Kassu A, Genetu A, Nigussie D. Campylobacter enteritis среди детей в округе Дембия на северо-западе Эфиопии. East Afr Med J. 2000; 77: 654–7.
Google ученый
- 22.
Бейене Г., Хайле-Амлак А. Чувствительность к противомикробным препаратам видов Campylobacter среди детей в специализированной больнице Университета Джимма, юго-запад Эфиопии. Эфиоп J Health Dev. 2004; 18: 185–9.
Google ученый
- 23.
Yongsi HBN. Патогенные микроорганизмы, связанные с детской диареей в странах с низким и средним уровнем доходов: тематическое исследование Яунде — Камерун.Int J Environ Res Public Health. 2008; 5: 213–29.
PubMed Central Статья PubMed Google ученый
- 24.
Kaur R, Rawat D, Kakkar M, Uppal B, Sharma VK. Кишечные паразиты у детей с диареей в Дели, Индия. Юго-Восточная Азия J Trop Med Public Health. 2002; 33: 725–9.
PubMed Google ученый
- 25.
Тинуаде О, Джон О, Сахид О, Ойеку О, Фиделис Н., Олабиси Д.Паразитарная этиология детской диареи. Индийский J Pediatr. 2006; 73: 1081–4.
Артикул PubMed Google ученый
- 26.
Варгас М., Гаскон Дж., Казальс К., Шелленберг Д., Урасса Х., Кахигва Е. и др. Этиология диареи у детей младше пяти лет в Ифакаре, Танзания. Am J Trop Med Hyg. 2004; 70: 536–9.
PubMed Google ученый
- 27.
Adamu H, Endeshaw T, Teka T, Kifle A, Petrose B.Распространенность кишечных паразитов у детей с диарейными и недиарейными пациентами в больницах Аддис-Абебы. Эфиоп J Health Dev. 2005; 20: 39–46.
Google ученый
- 28.
Mondal D, Petri WA, Sack RB, Kirkpatrick BD, Haque R. Диарейное заболевание, связанное с Entamoeba histolytica , отрицательно связано с ростом детей дошкольного возраста: данные проспективного исследования. Trans R Soc Trop Med Hyg. 2006; 100: 1032–8.
Артикул PubMed Google ученый
- 29.
Кебеде А., Вервей Дж., Дориго-Зетсма В., Сандерс Е., Месселе Т., ван Лисхаут Л. и др. Сверхдиагностика амебиаза при отсутствии Entamoeba histolytica среди пациентов с диареей в Вонджи и Акаки, Эфиопия. Trans R Soc Trop Med Hyg. 2003. 97: 305–7.
Артикул PubMed Google ученый
- 30.
Гебертсадик А., Кебеде А., Меземер М., Тасев Г. Обнаружение и дифференциация двух морфологически идентичных видов Entamoeba. Эфиоп J Health Dev. 2004; 18: 121–4.
Google ученый
- 31.
Ньюман Р.Д., Мур С.Р., Лима А.А., Натаро Дж. П., Геррант Р.Л., Сирс К.Л. Продольное исследование инфекции Giardia lamblia у детей северо-востока Бразилии. Trop Med Int Health. 2001; 6: 624–34.
CAS Статья PubMed Google ученый
- 32.
Halliez MC. Внекишечные и отдаленные последствия инфекций Giardia duodenalis . Мир Дж. Гастроэнтерол. 2013; 19: 8974.
PubMed Central Статья PubMed Google ученый
- 33.
Робин Дж., Фрейзер Д., Орр Н., Села Т., Слепон Р., Амбар Р. и др. Cryptosporidium Инфекция у младенцев-бедуинов, оцененная с помощью проспективной оценки антикриптоспоридиальных антител и исследования стула. Am J Epidemiol.2001; 153: 194–201.
CAS Статья PubMed Google ученый
- 34.
Фрейзер Д., Биленко Н., Декельбаум Р., Даган Р., Эль-Он Дж., Нагган Л. Giardia lamblia Носительство у израильских бедуинских младенцев: факторы риска и последствия. CID. 2000; 30: 419–24.
CAS Статья Google ученый
- 35.
Adugna S, Kebede Y, Moges F, Tiruneh M. Эффективность мебендазола и альбендазола при инфекциях Ascaris lumbricoides и анкилостомоза в районе с длительным воздействием антигельминтов, Северо-Западная Эфиопия.Эфиоп Мед Дж. 2007; 45: 301–6.
PubMed Google ученый
- 36.
Пуллан Р.Л., Смит Д.Л., Ясрасария Р., Брукер С.Дж. Глобальные показатели инфекций и бремени болезней, передаваемых через почву, гельминтозов в 2010 году. Паразиты и переносчики. 2014; 7: 37.
Артикул Google ученый
- 37.
Куигли М.А., Келли Ю.Дж., Сакер А. Грудное вскармливание и госпитализация при диарейных и респираторных инфекциях в когортном исследовании тысячелетия в Соединенном Королевстве.Педиатрия. 2007; 119: e837–42.
Артикул PubMed Google ученый
- 38.
Lamberti LM, Fischer Walker CL, Noiman A, Victora C, Black RE. Грудное вскармливание и риск заболеваемости и смертности от диареи. BMC Public Health. 2011; 11 Приложение 3: S15.
PubMed Central Статья PubMed Google ученый
- 39.
Окяй П., Эртуг С., Гюльтекин Б., Онен О., Бесер Э.Распространенность кишечных паразитов и связанные с ними факторы у школьников, выборка из западного города — Турция. BMC Public Health. 2004; 4: 64.
PubMed Central Статья PubMed Google ученый
- 40.
Tadesse G. Распространенность кишечных гельминтозов и связанные с ними факторы риска среди школьников в городе Бабиле, восточная Эфиопия. Эфиоп J Health Dev. 2005; 19: 140–7.
Артикул Google ученый
- 41.
Мак JW. Важные зоонозные кишечные простейшие паразиты в Азии. Троп Биомед. 2004; 21: 39–50.
CAS PubMed Google ученый
- 42.
Zhao GH, Du SZ, Wang HB, Hu XF, Deng MJ, Yu SK и др. Первое сообщение о зоонозах Cryptosporidium spp., Giardia Кишечник и Enterocytozoon bieneusi в золотых такинах (Budorcas taxicolor bedfordi). Заразить Genet Evol. 2015; 34: 394–401.
Артикул PubMed Google ученый
- 43.
Boeke CE, Mora-Plazas M, Forero Y, Villamor E. Кишечные простейшие инфекции в связи с нутритивным статусом и желудочно-кишечными заболеваниями у школьников Колумбии. J Trop Pediatr. 2010. 56: 299–306.
Артикул PubMed Google ученый
- 44.
Ирена А., Мвамбази М., Муленга В. Диарея — главная причина смерти детей с тяжелой острой недостаточностью питания, госпитализированных в стационар в Лусаке, Замбия. Нутр Дж. 2011; 10: 110.
PubMed Central Статья PubMed Google ученый
Оценка кишечных паразитов среди детей, принимающих противопаразитарные препараты, в начальной школе Нгома, Руанда.
Научная статья — Журнал паразитарных болезней: диагностика и терапия (2018) Том 3, выпуск 1
Оценка кишечных паразитов среди детей, принимающих противопаразитарные препараты, в начальной школе Нгома, Руанда.
Зефани Нзейимана 1 , Тадди Ншимийимана 2 , Жан Мари Вианни Нюмбайре 3 , Филмин Ювихорие 4 , Осуват Лоуренс Обадо 1 9021 9147 Нисват Лоуренс Обадо 1 9021 9147
1 Департамент медицинских лабораторных наук, Университет Маунт-Кения, Руанда, кампус Кигали
2 Департамент биомедицинских лабораторных наук, Университет Руанды, Руанда
3 Лабораторное отделение, больница Масака, Руанда
4 Лабораторное отделение, Поликлинк Канимба, Руанда
5 Департамент биомедицинских лабораторных наук, Политехнический институт Кибогора, Руанда
6 Департамент биомедицинских лабораторных наук, Университет Маунт-Кения, Кения
- * Автор для переписки:
- Жан Батист Нийибизи
Департамент медицинских лабораторных наук
Университет Маунт-Кения Руанда, кампус Кигали
Эл. Почта: [адрес электронной почты защищен]
Принято 20 февраля 2018 г.
Образец цитирования: Nzeyimana Z, Nshimiyimana T, Nyumbayire JMV, et al.Оценка кишечных паразитов среди детей, принимающих противопаразитарные препараты, в начальной школе Нгома, Руанда. J Parasit Dis Diagn Ther. 2018; 3 (1): 1-5. DOI: 10.4066 / 2591-7846.1000020
Абстрактные
Справочная информация: Кишечные паразитарные инфекции являются одними из самых распространенных инфекций во всем мире. Все шире признается, что эти паразиты могут нарушать рост и развитие детей любого возраста. С 2009 года Минздрав Руанды поставил перед собой задачу снизить к 2012 году распространенность гельминтов, передаваемых через почву, среди детей школьного возраста с 65% до 50%.Цели: Наше исследование было направлено на оценку кишечных паразитов среди детей младшего школьного возраста Ngoma, принимающих противопаразитарные препараты (альбендазол и мебендазол). Конкретные цели этого исследования состояли в том, чтобы установить наиболее часто встречающихся кишечных паразитов у детей начальной школы Нгома и определить количество кишечных паразитов среди инфицированных детей.
Методы: 120 образцов стула, взятых для удобства, у детей младшего школьного возраста из Нгомы были исследованы на наличие кишечных паразитов.Слайды готовили непосредственно для влажного монтирования в физиологическом растворе и йоде, а затем исследовали под микроскопом. Наконец, для концентрирования образцов стула для идентификации паразитов и подсчета яиц, соответственно, были использованы методы осаждения формалином-эфиром и метод модифицированной сахарной флотации Висконсин.
Результаты: Из 120 детей 39 (32,5%) были инфицированы одним или несколькими кишечными паразитами. Распространенность Giardia lamblia , Entamoeba coli , Entamoeba histolytica , Ascaris lumbricoides , анкилостомоза и Taenia видов инфекций, определенная методом концентрации эфира формола, составила 13.3%, 7,5%, 5,8%, 3,3%, 1,7% и 0,8% соответственно. С другой стороны, среднее количество яиц на грамм стула для видов Ascaris lumbricoides , анкилостомы и Taenia видов, определенное модифицированным методом флотации сахара в Висконсине, составило 11, 9 и 6 яиц на грамм (epg), соответственно. . Заключение: кишечные паразитарные инфекции были в разной степени распространены среди детей начальной школы нгома. G. lamblia , E. coli и E. histolyica вместе вносят вклад в большинство встречающихся кишечных паразитов и составляют 86% всех вылеченных кишечных паразитарных инфекций.
Ключевые слова
Паразиты, инвазии, кисты, трофозоиты, диарея, амебиаз, желудочно-кишечные инфекции.
Введение
Кишечные паразиты — это организмы, которые обитают в желудочно-кишечном тракте животных, включая человека, и могут вызывать заболеваемость и смертность [1]. Двумя основными типами кишечных паразитов являются гельминты и простейшие. Гельминты — это глисты с множеством клеток. Во взрослом виде гельминты не могут размножаться в организме человека. Простейшие имеют только одну клетку и могут размножаться в организме человека, что может привести к развитию серьезных инфекций [2].Паразиты в кишечнике подразделяются на два класса, такие как простейшие и гельминты. Простейшие одноклеточные и включают амебы, жгутиконосцы, инфузории, кокцидии и микроспородии, тогда как гельминты — многоклеточные организмы, в том числе немательминты и платигельминты [3]. Кишечные паразиты обычно передаются при контакте с инфицированными фекалиями, например, через зараженную почву, пищу или воду [4]. Определенные виды остаются в кишечнике; другие выходят за пределы кишечника и вторгаются в другие органы.Большинство ленточных и аскаридных червей развиваются в организме человека и откладывают там яйца. Затем яйца выходят из организма с фекалиями и могут заражать других [5].
По оценкам Всемирной организации здравоохранения (ВОЗ), 3,5 миллиарда человек во всем мире заражены тем или иным кишечным паразитом, и в результате около 450 миллионов из них заболевают. Чаще всего этими паразитами заражаются дети [1]. Кишечные паразитарные инфекции являются одними из самых распространенных инфекций во всем мире.Подсчитано, что кишечными паразитами поражены 3,5 миллиарда человек, и 450 миллионов человек заболевают в результате этих инфекций, причем большинство из них — дети [1]. Забытые тропические болезни (NTD) являются наиболее распространенными инфекциями бедных людей во всем мире. Сообщалось, что в 2001 г. на юге Руанды 55% детей школьного возраста были инфицированы анкилостомозом, Ascaris lumbricoides, или Trichuris trichiura [6]. Все больше признается, что эти паразиты могут нарушать рост и развитие детей всех возрастов [6].Эти инфекции считаются серьезной проблемой общественного здравоохранения, поскольку вызывают железодефицитную анемию, задержку роста у детей и другие проблемы с физическим и психическим здоровьем [5]. Кишечные паразиты в начальных школах являются серьезной проблемой общественного здравоохранения в Руанде. Считается, что в 2007 году в Руанде более 75% детей были инфицированы кишечными глистами [7]. Наибольшая распространенность забытых болезней наблюдается в тропических и субтропических регионах [5]. В промышленно развитых странах группы риска включают мужчин-гомосексуалистов, путешественников и недавних иммигрантов, а также институциональные группы населения [5].Ленточные черви, острицы и круглые черви являются одними из самых распространенных гельминтов в США [5].
С 2006 г. Минздрав Руанды организовал раз в два года Неделю здоровья матери и ребенка, а в 2007 г. Минздрав начал назначать школьникам в возрасте от 5 до 16 лет альбендазол / мебендазол или празиквантел (в зоне риска бильгарциоза) [4]. С 2009 года Минздрав Руанды поставил своей целью снизить распространенность гельминтов, передаваемых через почву, среди детей школьного возраста с 65% до 50% к 2012 году. Это исследование было направлено на оценку кишечных паразитарных инфекций среди детей начальной школы Нгомы, принимающих противопаразитарные препараты (в данном случае — альбендазол).Несмотря на усилия Министерства здравоохранения Руанды по сокращению числа паразитарных инфекций среди детей младшего школьного возраста, кишечные паразитарные инфекции по-прежнему являются серьезной проблемой для здоровья этих детей, о чем свидетельствуют более 75% руандийских детей, которые, по оценкам, были инфицированы кишечными червями в 2007 [7]. Более того, согласно Стратегическому плану сектора здравоохранения от июля 2009 г. по июнь 2012 г., Минздрав Руанды поставил цель снизить распространенность гельминтов, передаваемых через почву, среди детей школьного возраста с 65% в 2009 г. до 50% к 2012 г. [8].Очевидно, что в этот период стратегического плана результаты оказались не такими, как предполагалось ранее. Это исследование было направлено на оценку кишечных паразитарных инфекций среди детей начальной школы Нгома, принимающих противопаразитарные препараты (альбендазол / Мебендазол) в начальной школе Нгома, расположенной в южной провинции, округ Хуйе, с целью выявления наиболее распространенных кишечных паразитов среди детей начальной школы Нгома, принимающих противопаразитарные препараты и также для определения паразитарной нагрузки (количество паразитов на грамм стула) среди инфицированных детей начальной школы Нгомы.
Методы
Исследование проводилось в начальной школе Нгома, которая расположена в южной провинции, округ Хуэ, в секторе Нгома, в 1,5 км от города Хуэ. Поперечное исследование использовалось для сбора информации о кишечных паразитарных инфекциях в начальной школе Нгомы. В этом исследовании были рассмотрены дети в возрасте от 8 до 14 лет начальной школы Нгома (от 3 -х до 5 -х -летних учеников начальной школы), принимающие противопаразитарные препараты, принимаемые раз в два года.Подходящие дети были легко отобраны, и образцы от 120 детей были протестированы на кишечных паразитов. Во время сбора и обработки образцов каждому ребенку выдавали контейнер с широким горлышком, деревянную палочку-аппликатор и гигиеническую бумагу для сбора необходимого количества образца кала после того, как им объяснили, как и сколько образца нужно собрать. Образцы были промаркированы детским кодовым номером, соответствующим его / ее паспорту данных, а затем доставлены непосредственно в лабораторию средней школы Гатагара для анализа.
При макроскопическом исследовании образцов учитывались особенности, чтобы обеспечить точность результатов каждого образца. К ним относятся: консистенция стула, такая как сформированный, мягкий, жидкий или водянистый; наличие крови и / или слизи, наличие круглых червей, нитчатых червей или проглоттидов ленточных червей. После макроскопических исследований микроскопическое исследование было проведено с использованием двух методов, которые представляют собой влажную подготовку в соответствии с протоколами Центров по контролю и профилактике заболеваний (CDC) (CDC, 2016).Второй метод представлял собой метод концентрирования, в котором исследователи использовали технику осаждения формол-эфир для концентрирования отрицательных образцов методом влажного монтирования, как описано CDC, 2016. Для подсчета яиц использовался модифицированный метод флотации сахара из Висконсина, описанный доктором Ноланом в 2004 году [ 9]. Эти результаты заносились в разработанный лабораторный лист. Данные были проанализированы и представлены в виде процентов, таблиц, диаграмм и цифр, созданных с помощью Microsoft Excel. Результаты анализа среднего среднего и стандартного отклонения были проанализированы с использованием SPSS версии 20.
Этические соображения
Это исследование было проведено после получения информированного согласия от директора школы и учителей от 3 учащихся начальной школы -го года до 5 -го -го года начальной школы Нгома, после этического одобрения Института здравоохранения Кигали на проведение этого исследования. Исследователи пояснили цель исследования, и участие детей было добровольным. Личность детей не разглашалась и поэтому не разглашалась.
Результаты
В таблице 1 и Рисунок 1 соответственно представляют возрастное и половое распределение детей, включенных и протестированных в ходе исследования. Менее половины (, рис. 2, ) обследованных детей имели мягкий стул, от которого удалось избавиться от большинства паразитов (, рис. 3, ). Из 120 обследованных детей 39 (32,5%) имели кишечные паразиты ( Фиг.4 — 6 ). Из 39 детей, перенесших паразитарные инфекции, было идентифицировано 6 видов паразитов (, таблица 2, ), из которых Giardia lamblia, являются наиболее распространенными (13.3%) и Taenia spp. Наименее встречающиеся виды (0,8%). Из 6 идентифицированных видов кишечные простейшие составляют 86%, тогда как остальные представляют собой кишечных гельминтов (, рис. 7, ). Таблица 3 показывает количество паразитов / яйцо на грамм (epg) трех видов паразитов, от которых можно было извлечь яйца.
Детский возраст (лет) Частота Процент (%) Совокупный процент (%) 8-11 73 60.8 60,8 12-14 47 39,2 100 Итого 120 100 Таблица 1. Возрастное распределение обследованных детей
Рисунок 1. Распределение детей по полу.
Рисунок 2. Распределение образцов стула по консистенции Исследуемый стул образован на 56,67% и на 43,33% мягкий.
Рисунок 3. Распределение идентифицированных паразитов по консистенции стула у исследованных детей.
Рисунок 4. Распределение инфицированных детей.
Рисунок 5. Распределение идентифицированных паразитов по полу обследованных детей.
Рисунок 6. Распределение выявленных паразитов по детскому возрасту обследованных детей.
Результаты лабораторных исследований Частота Процент (%) Совокупный процент Паразиты не идентифицированы 81 67.5 67,5 Лямблии лямблии 16 13,3 80,8 Entamoeba coli 9 7,5 88,3 Entamoeba histolitica 7 5,8 94,2 Ascaris lumbricoides 4 3,3 97,5 Taenia видов 1 0.8 98,3 Анкилостомы 2 1,7 100 Итого 120 100 Таблица 2. Лабораторные результаты выявленных кишечных паразитов у протестированных детей младшего школьного возраста.
Рис. 7. Распространенность идентифицированных видов паразитов.
Ascaris lumbricoides представляет самый высокий epg (среднее значение 11).
Наша изучаемая популяция в возрасте от 8 до 14 лет. Исследуемые возрастные группы были разделены на две группы: 8-11 лет и 12-14 лет, что составляет соответственно 60,8% (73) и 39,2% (39,2).
В 120 случаях в 81 паразиты отсутствовали, а в 39 — какие-либо идентифицированные виды паразитов: Giardia lamblia , Entamoeba coli , Entamoeba histolytica , Ascaris lumbricoides , Taenia видов или анкилостомы. 3.5 Распространение. выявленных паразитов по консистенции стула исследуемых детей.
Наиболее идентифицированными паразитарными стадиями были кистозные и яичные стадии для простейших и гельминтов, соответственно, поскольку сформированные и мягкие фекалии, скорее всего, содержат эти паразитарные формы (CDC DPDx 2010). Мягкий стул представил больше паразитов, чем сформировался.
Из 64 подсчитанных самок у 20 был какой-либо из кишечных паразитов, у 44 — не идентифицированный паразит, тогда как у 56 самцов у 19 был какой-либо из паразитов, а у 37 — не идентифицированный паразит. Самки представили больше на Entamoeba coli, чем на самцов.
Giardia lamblia является наиболее распространенным кишечным паразитом, обнаруженным во всех изученных возрастах. Большинство детей в возрасте 12 лет не имеют выявленных паразитов.
• E. coli распространена у детей 8 и 9 лет.
• E. histolitica чаще всего встречается у детей 10-11 лет.
Сравнение пропорций видов паразитов
Giardia lamblia представляет наибольшую долю (43%), за ней следуют Entamoeba coli (24%) и Entamoeba histolytica (19%). Giardia lamblia , Entamoeba coli и Entamoeba histolytica — кишечные простейшие, которые в основном встречаются в начальной школе Нгома, все они представляют 86% идентифицированных кишечных паразитов, тогда как Ascaris lumbricoides , Hookworms и Taenia видов кишечных гельминты составляют всего 14%.
Результаты подсчета яиц
Среднее количество яиц на грамм стула показано в Таблице 3 ниже.
Выявленные гельминты Среднее значение N Std. Отклонение Ascaris lumbricoides 11,25 4 2,217 Анкилостомы 9,5 2 2,121 Taenia видов 6 1 . Итого 10 7 2.646 Таблица 3. Результаты подсчета яиц.
Приведенная выше таблица показывает, что у 7 детей были обнаружены яйца глистов в стуле, среди них у 4 было Ascaris lumbricoides яйца со средним значением 11 яиц на грамм стула (EPG), 2 с 9 EPG анкилостомы и 1 с 6. Taenia вида EPG.
Обсуждение
Это исследование было проведено для определения наиболее часто встречающихся кишечных паразитов у детей начальной школы Нгома и для определения паразитарной нагрузки среди детей, инфицированных гельминтами.Результаты этого исследования показали, что G. lamblia является наиболее распространенной (13,3%) кишечной паразитарной инфекцией среди детей начальной школы Нгомы. Наряду с E. coli (7,5%) и E. histolyica (5,8%), G. lamblia преимущественно поражает детей в возрасте 8-11 лет, причем гораздо реже заражение наблюдается среди старших (12-14 лет). дети. Эти результаты сопоставимы с результатами индийского исследования Wani et al. Индийское исследование проводилось среди школьников города Сринагер.Wani et al. Сообщили, что Ascaris lumbricoides являются наиболее распространенным (28,4%) кишечным паразитом, а Giardia lamblia занимает третье место с 4,9%. Для сравнения, исследование в городе Кассала (Судан) сообщило о распространенности Giardia lamblia , составляющей 12,3%, и Entamoeba histolytica, ,4%. В исследовании в Руанде, в котором участвовало 2400 детей в возрасте от 2 до 20 лет, из которых 93% были в возрасте от 5 до 10 лет, общая кишечная распространенность составила 55,9%. Эти данные заметно отличались от наших в том, что анкилостомид насчитывал 44 человека.5% паразитов. Как по-разному объяснялось, в основе всех этих вопиющих и неприемлемо высоких показателей лежит гигиена. В то время как это исследование сообщает в основном о высокой паразитарной нагрузке (epg) Ascaris lumbricoides (11 epg), Hookworms (9 epg) и Taenia видов (6 epg), несколько других исследований сообщают о высокой паразитарной нагрузке. Авторы предполагают, что основное различие возникает из-за размера выборки (120), который был оценен как низкий по сравнению с размером выборки, проведенным Кассалой с 900 детьми, и исследованием Руанды, проведенным Кабатерейне с размером выборки 2400 детей.В то время как женщины, по-видимому, имели более высокий уровень инфицирования, чем студенты-мальчики, авторы настоящей статьи не могли объяснить это явление какой-либо конкретной или конкретной причиной. Среди этих возрастных групп также было зарегистрировано увеличение количества паразитов Ascaris lumbricoides и видов Hookworm. Киста и яйца в основном были получены у детей, у которых стул сформировался должным образом (CDC DPDx 2010).
В настоящем исследовании сообщается, что кишечные простейшие представляют собой самую высокую распространенность (26.6%) у выявленных кишечных паразитов. Это может быть связано с типом применяемого антигельминтного препарата (альбендазола), который нацелен только на кишечных гельминтов, количество которых значительно снизилось до 5,8% у исследуемых детей, поскольку Минздрав направлен на снижение количества кишечных гельминтов с 65% до 50% [8–16]. Это, вероятно, может быть связано с повышением осведомленности о профилактике кишечных паразитов, небольшим размером исследуемой выборки и расположением начальной школы Нгомы в городе. В настоящем исследовании авторы также сообщают, что среднее значение epg, бремя случаев положительно связано с уровнем инфицирования, из 11 (менее 200) случаев легкие инфекции, согласно отчету ВОЗ за 2002 год.ВОЗ сообщила, что менее 200 эпг представляют собой легкие инфекции анкилостомы, тогда как более 200 эпг следует рассматривать как потенциальную опасность. Это может быть связано с программой дегельминтизации Министерства здравоохранения Руанды и с детьми, у которых нет симптомов.
Заключение
Кишечные паразитарные инфекции по-прежнему являются серьезной проблемой для здоровья детей, которых мы изучали.
G. lamblia , E. coli и E. histolyica вместе вносят вклад в большинство встречающихся кишечных паразитов и составляют 86% всех выздоровевших кишечных паразитарных инфекций.Однако наши результаты, кажется, предполагают, что интервенционные стратегии Минздрава играют положительную роль, поскольку, по-видимому, наблюдается снижение распространенности кишечных гельминтов. Из-за того, что, по-видимому, наблюдается снижение распространенности кишечных паразитов, Минздраву следует продолжить дегельминтизацию. Однако противопротозойные препараты должны быть интегрированы, поскольку преобладают простейшие. Лаборатории должны быть оборудованы для лучшей концентрации стула; методы флотации и осаждения, а также обученный персонал.Особое внимание следует уделять соблюдению правил гигиены, особенно детям младшего возраста. Мы также рекомендуем дальнейшие исследования с использованием более крупных выборок и более совершенных диагностических подходов.
Ограничения исследования
В настоящем исследовании из-за отсутствия реагентов сульфата цинка, метод флотации сульфата цинка не применялся.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи в отношении данной работы.
Благодарность
Авторы любезно признательны за вклад Университета Руанды, бывшей администрации KHI, Осувата Лоуренса Обадо, Совета по образованию Руанды и Министерства образования в целом.
Список литературы
- Линн SG. Классификация человеческих паразитов, переносчиков и подобных организмов. Клинические инфекционные болезни. 1993; 16: 614-15.
- Кертис В., Кэрнкросс С., Йонли Р. и др. Обзор: Домашняя гигиена и диарея — определение проблемы.Тропическая медицина и международное здравоохранение 2000; 5: 22-32.
- Мэдиган М.Т., Мартинко Дж. М., Паркер Дж. Брок Биология микроорганизмов. Pearson Education Inc. 2006; 947-948.
- Элмер В.К. Цветовой атлас и учебник диагностического микробиолога. Липпенкорт 1997; 1071-1162.
- Dawit A. Медицинская паразитология: Конспект лекций и дипломные программы для студентов-медиков, 2004 г.
- Eleonor TB, Vicente YB, Winifreda U. Инфекционный статус кишечных паразитов у детей, проживающих в интернатных учреждениях в Метро Маниле, Филиппины.Корейский J Parasitol. 2004; 41: 113-5.
- Beaver PC, Jung RC, Cupp EW. Клиническая паразитология. Леа и Фебигер. 1984.
- Министерство здравоохранения: Министерство здравоохранения Руанды: Стратегический план сектора здравоохранения июль 2009 г. — июнь 2012 г.
- Методы осаждения формалина-этилацетата и флотации сульфата цинка для обнаружения кишечных паразитов. J Clinical Microbio. 1981; 13: 882-4 .
- https://www.cdc.gov/dpdx/diagnosticprocedures/stool/microexam.html
- Хаддад CM.Визуализация паразитарных заболеваний. J Media Reviews. 299: 2691-2.
- Ким Б.Дж., Ок М.С., Чанг Д.И. и др. Статус инфицирования кишечными паразитами жителей города Рохас, Филиппины. Корейский J Parasitol. 2003; 41: 113-5.
- Амаль К.М., Энтони Р.М. Забытые тропические болезни: эпидемиология и глобальное бремя.



 П. Г. Сергиева. М., 1968. Т. 11. С. 601–615.
П. Г. Сергиева. М., 1968. Т. 11. С. 601–615. С. 70–93.
С. 70–93. 1981 Oct-Dec. Vol. 19 (4). Р. 367–372.
1981 Oct-Dec. Vol. 19 (4). Р. 367–372.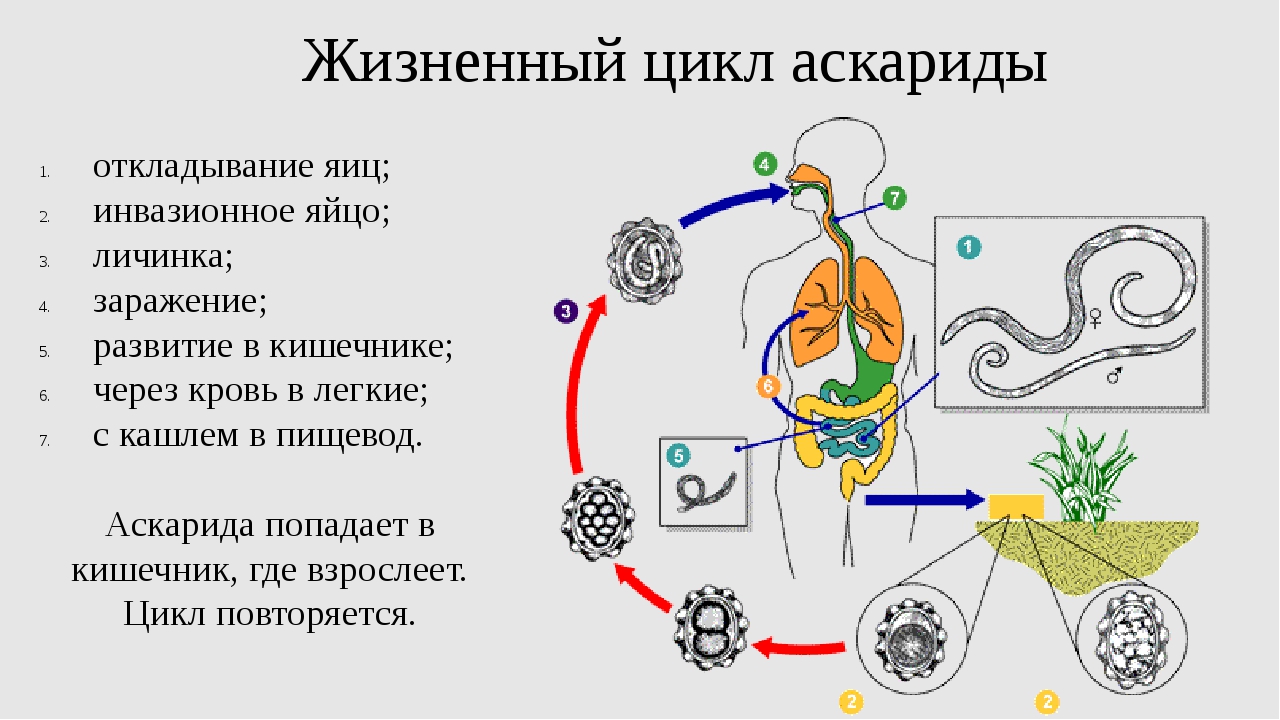 1007/s12026-012-8287-5.
1007/s12026-012-8287-5. 2003 Jul. Vol. 24 (7). Р. 376–379.
2003 Jul. Vol. 24 (7). Р. 376–379.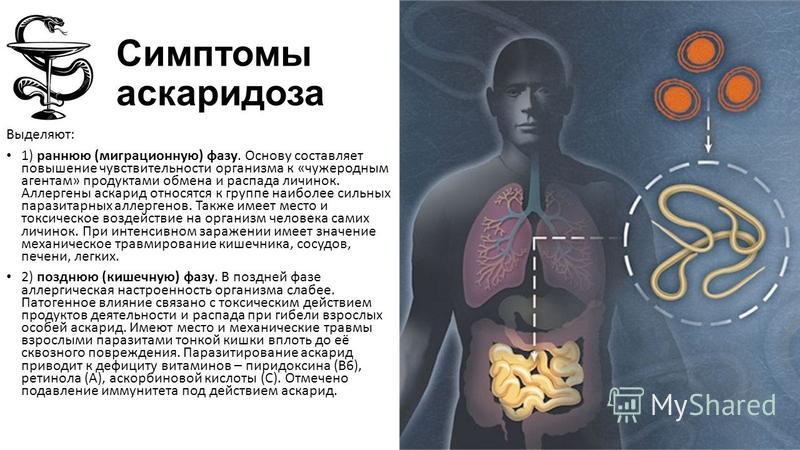


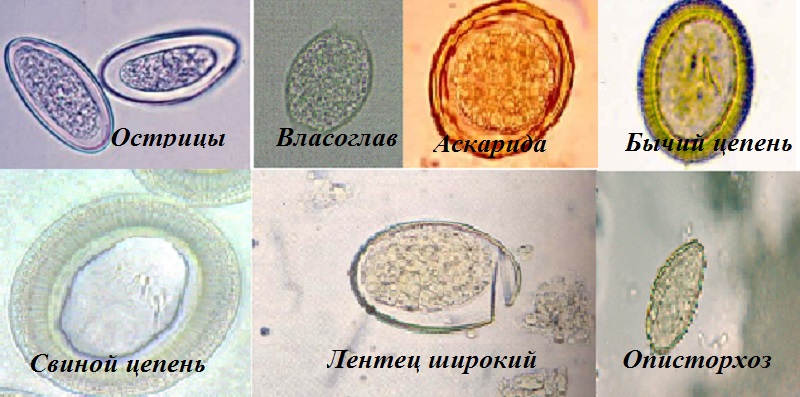 Преобладающие кишечные паразиты, обнаруженные в группах беженцев, в зависимости от места происхождения
Преобладающие кишечные паразиты, обнаруженные в группах беженцев, в зависимости от места происхождения Руководство по кишечным паразитам для домашнего медицинского осмотра вновь прибывших беженцев.
Руководство по кишечным паразитам для домашнего медицинского осмотра вновь прибывших беженцев.
 histolytica , Cryptosporidium и Giardia . 6
histolytica , Cryptosporidium и Giardia . 6  mansoni *,
mansoni *, 
 , Ред. Учебник детских инфекционных болезней Фейгина и Черри, 7 изд. Филадельфия, Пенсильвания: Эльзевир, 2014.
, Ред. Учебник детских инфекционных болезней Фейгина и Черри, 7 изд. Филадельфия, Пенсильвания: Эльзевир, 2014. Векторы паразитов 2012,5: 265.
Векторы паразитов 2012,5: 265.
 cdc.gov/immigrantrefugeehealth/pdf/intestinal- паразиты-Domestic.pdf
cdc.gov/immigrantrefugeehealth/pdf/intestinal- паразиты-Domestic.pdf N Engl J Med 2012; 366 (16): 1498-507.
N Engl J Med 2012; 366 (16): 1498-507. Глобальная война против кишечных паразитов — следует ли использовать целостный подход? [Рассмотрение]. Int J Заразить Дис . 2010; 14 (9): e732-8.
Глобальная война против кишечных паразитов — следует ли использовать целостный подход? [Рассмотрение]. Int J Заразить Дис . 2010; 14 (9): e732-8. 2009; 27 (3): 412-7. Рассмотрение.
2009; 27 (3): 412-7. Рассмотрение. 2007; 10 (1): 194-6.
2007; 10 (1): 194-6. Геоспат Здоровье . 2015; 10 (1): 303.
Геоспат Здоровье . 2015; 10 (1): 303.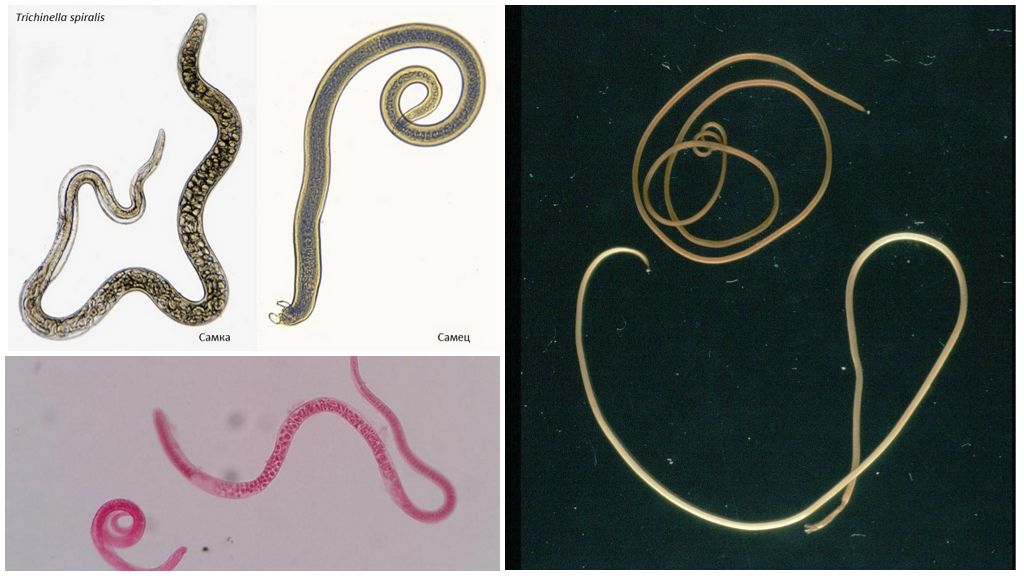

 handle.net/10362/15335).
handle.net/10362/15335).
 Следовательно, инфицирование кишечными паразитами и пищевой статус влияют друг на друга в порочном круге, и трудно установить эффект каждого из них.
Следовательно, инфицирование кишечными паразитами и пищевой статус влияют друг на друга в порочном круге, и трудно установить эффект каждого из них. Исследование проводилось в сотрудничестве с местными органами здравоохранения и образования, включая Управление образования провинции и Управление здравоохранения провинции.
Исследование проводилось в сотрудничестве с местными органами здравоохранения и образования, включая Управление образования провинции и Управление здравоохранения провинции. Были собраны данные от 329 детей.Однако в связи с тем, что одному из них менее 5 лет, было зачислено 328 детей.
Были собраны данные от 329 детей.Однако в связи с тем, что одному из них менее 5 лет, было зачислено 328 детей. Молекулярная идентификация E . histolytica и E . ДНК dispar анализировали, как описано в [14], с 40 циклами амплификации. Кроме того, внутренний контроль амплификации также выполнялся во всех образцах, как описано ранее [15], с 40 циклами амплификации во второй реакции амплификации.
Молекулярная идентификация E . histolytica и E . ДНК dispar анализировали, как описано в [14], с 40 циклами амплификации. Кроме того, внутренний контроль амплификации также выполнялся во всех образцах, как описано ранее [15], с 40 циклами амплификации во второй реакции амплификации.
 Были включены только дети, родители / опекуны которых подписали информированное согласие.Когда родители / опекуны не умели читать или писать, один из членов команды читал вслух, а затем требовал отпечаток пальца и подпись свидетеля.
Были включены только дети, родители / опекуны которых подписали информированное согласие.Когда родители / опекуны не умели читать или писать, один из членов команды читал вслух, а затем требовал отпечаток пальца и подпись свидетеля. lamblia с 20,1% (66/328) и H . nana с 8,8% (29/328) (Таблица 2). ДНК E . histolytica был обнаружен в одном образце (0,3%), в то время как 43 ребенка носили E . dispar ДНК (13,1%). Статистически значимой разницы в распространенности кишечных паразитов ни по полу, ни по возрасту не наблюдалось (таблица 3).
lamblia с 20,1% (66/328) и H . nana с 8,8% (29/328) (Таблица 2). ДНК E . histolytica был обнаружен в одном образце (0,3%), в то время как 43 ребенка носили E . dispar ДНК (13,1%). Статистически значимой разницы в распространенности кишечных паразитов ни по полу, ни по возрасту не наблюдалось (таблица 3). Возраст и зараженность по H . nana (общая и коинфекция) были достоверно связаны с анемией (таблица 5).
Возраст и зараженность по H . nana (общая и коинфекция) были достоверно связаны с анемией (таблица 5). Эта распространенность ниже, чем 80,0%, обнаруженных в провинции Бие, Ангола, в исследовании, в котором участвовал 791 ребенок в возрасте от 6 до 10 лет [19]. Разница между двумя показателями распространенности может быть связана с тем фактом, что непатогенные простейшие были включены в исследование из Биэ [19].
Эта распространенность ниже, чем 80,0%, обнаруженных в провинции Бие, Ангола, в исследовании, в котором участвовал 791 ребенок в возрасте от 6 до 10 лет [19]. Разница между двумя показателями распространенности может быть связана с тем фактом, что непатогенные простейшие были включены в исследование из Биэ [19]. 6% [21].
6% [21]. Это может быть выполнено с помощью молекулярной диагностики в регионах с адекватными лабораторными ресурсами или путем обнаружения специфического антигена (ELISA / RDT) в регионах с недостаточными лабораторными ресурсами.
Это может быть выполнено с помощью молекулярной диагностики в регионах с адекватными лабораторными ресурсами или путем обнаружения специфического антигена (ELISA / RDT) в регионах с недостаточными лабораторными ресурсами.
 nana пациентов и контроль, обозначающих предрасположенность к анемии [30]. В исследовании, в котором участвовали дошкольники из лагерей для перемещенных лиц, штат Хартум, Судан, диарея была значимо связана с H . nana инфекция [31]. Однако гименолепидоз отсутствует в руководствах ВОЗ по программам борьбы с гельминтами [29].
nana пациентов и контроль, обозначающих предрасположенность к анемии [30]. В исследовании, в котором участвовали дошкольники из лагерей для перемещенных лиц, штат Хартум, Судан, диарея была значимо связана с H . nana инфекция [31]. Однако гименолепидоз отсутствует в руководствах ВОЗ по программам борьбы с гельминтами [29]. Эти результаты особенно важны в контексте здоровья в Анголе из-за нехватки исследований по этой теме, предоставляющих информацию для планирования и реализации программы борьбы, которая связывает борьбу с кишечными паразитами, недостаточным питанием и анемией.
Эти результаты особенно важны в контексте здоровья в Анголе из-за нехватки исследований по этой теме, предоставляющих информацию для планирования и реализации программы борьбы, которая связывает борьбу с кишечными паразитами, недостаточным питанием и анемией. Ньяранго Р.М., Алоо П.А., Кабиру Е.В., Ньянчонги Б.О. Риск заражения патогенными кишечными паразитами в муниципалитете Кисии, Кения. BMC Public Health. 14 июля 2008 г.; 8 (237).
Ньяранго Р.М., Алоо П.А., Кабиру Е.В., Ньянчонги Б.О. Риск заражения патогенными кишечными паразитами в муниципалитете Кисии, Кения. BMC Public Health. 14 июля 2008 г.; 8 (237). pmid: 18419494
pmid: 18419494 М. и др. Коинфекции средней и низкой интенсивности, вызываемые кишечными гельминтами и Schistosoma mansoni , потребление железа с пищей и анемия у детей Бразилии. Am J Trop Med Hyg. 2006. 75 (5): 939–44. pmid: 17123992
М. и др. Коинфекции средней и низкой интенсивности, вызываемые кишечными гельминтами и Schistosoma mansoni , потребление железа с пищей и анемия у детей Бразилии. Am J Trop Med Hyg. 2006. 75 (5): 939–44. pmid: 17123992