Врожденная цитомегаловирусная инфекция: диагностика, лечение и профилактика | Карпова
1. Swanson E.C., Schleiss M.R. Congenital Cytomegalovirus Infection: New Prospects for Prevention and Therapy. Pediatr Clin North Am 2013; 60: (2): 335–349.
2. Halwachs-Baumann G. (Ed.). Congenital Cytomegalovirus Infection. Epidemiology, Diagnosis, Therapy. SpringerWien-NewYork, 2011; 149.
3. Никонов А.П., Асцатурова О.Р. Цитомегаловирусная инфекция. Педиатрия. Приложение к журналу Consilium Medicum 2009; (1): 7–10. [Nikonov A.P., Ascaturova O.R. Cytomegalovirus Infection. Pediatriya. Supplement to the journal Consilium Medicum 2009; (1): 7–10. (in Russ)]
4. Volpe J.J. Neurology of the newborn.
5. Gomella T.L. Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs. McGraw-Hill, 2013; 698.
6. Reddehase M. J. (Ed.). Cytomegaloviruses From Molecular Pathogenesis to Intervention. Norfolk, UK: Caister Academic Press, 2013; 539.
7. Cannon M.J., Griffiths P.D., Aston V., Rawlinson W.D. Universal newborn screening for congenital CMV infection: what is the evidence of potential benefit? Rev Med Virol 2014; (24): 291–307.
8. Williams E.J., Kadambari S., Berrington J.E. et al. Feasibility and acceptability of targeted screening for congenital CMVrelated hearing loss. Arch Dis Child Fetal Neonatal Ed 2014; 99: F230–F236.
9. Lanzieri T.M., Dollard S.C., Bialek S.R., Grosse S.D. Systematic review of the birth prevalence of congenital cytomegalovirus infection in developing countries. Int J Infect Dis 2014; (22): 44–48.
10. Mussi-Pinhata M.M., Yamamoto A.Y., Britt R.M. et al. Birth prevalence and natural history of congenital cytomegalovirus infection in a highly seroimmune population. Clin Infect Dis 2009; (15): 522–528.
11. Townsend C.L., Forsgren M., Ahlfors K., Ivarsson S.A., Tookey P.A., Peckham C.S. Long- term Outcomes of Congenital Cytomegalovirus Infection in Sweden and the United Kingdom. Clinical Infectious Diseases 2013; 56: (9): 1232–1239. DOI: 10.1093/cid/cit018.
12. Manicklal S. , Emery V.C., Lazzarotto T., Boppana S.B., Gupta R.K. The «Silent» Global Burden of Congenital Cytomegalovirus. Clin Microbiol Rev 2013; 26: (1): 86–102. DOI: 10.1128/CMR.00062–12.
, Emery V.C., Lazzarotto T., Boppana S.B., Gupta R.K. The «Silent» Global Burden of Congenital Cytomegalovirus. Clin Microbiol Rev 2013; 26: (1): 86–102. DOI: 10.1128/CMR.00062–12.
13. Yamamoto A.Y., Mussi-Pinhata M.M., Boppana S.B., Novak Z., Wagatsuma V.M., Oliveira P.F. et al. Human cytomegalovirus reinfection is associated with intrauterine transmission in a highly cytomegalovirus-immune maternal population. Am J Obstet Gynecol 2010; 202: (3): 297.e1-8. DOI: 10.1016/j.ajog.2009.11.018.
14. Boppana S.B., Ross S.A., Fowler K.B. Congenital Cytomegalovirus Infection: Clinical Outcome. Clin Infect Dis 2013; 57: S4: S178–181. DOI: 10.1093/cid/cit629.
15. Buonsenso D., Serranti D., Gargiullo L., Ceccarelli M., Ranno O., Valentini P. Congenital cytomegalovirus infection: current strategies and future perspectives. Eur Rev Med Pharmacol Sci 2012; (16): 919–935.
Eur Rev Med Pharmacol Sci 2012; (16): 919–935.
16. Fox G., Hoque N., Watts T. (Ed.) Oxford handbook of neonatology. New York: Oxford university press, 2010; 523.
17. Ghekiere S., Allegaert K., Cossey V., Van Ranst M., Cassiman C., Casteels I. Ophthalmological Findings in Congenital Cytomegalovirus Infection: When to Screen, When to Treat? J Pediatr Ophthalmol Strabismus 2012; (49): 274–282. DOI: 10.3928/01913913-20120710-03.
18. Hayakawa J., Kawakami Y., Takeda S., Ozawa H, Fukazawa R., Takase M., Fukunaga Yu. A neonate with reduced cytomegalovirus DNA copy number and marked improvement of hearing in the treatment of congenital cytomegalovirus infection. J Nippon Med Sch 2012; (79): 471–477.
19. Nigro G., Adler S.P. Hyperimmunoglobulin for Prevention of Congenital Cytomegalovirus Disease. Clin Infect Dis 2013; 57: S4: 193–195.
Nigro G., Adler S.P. Hyperimmunoglobulin for Prevention of Congenital Cytomegalovirus Disease. Clin Infect Dis 2013; 57: S4: 193–195.
20. Nigro G. Maternal–fetal cytomegalovirus infection: From diagnosis to therapy. J Matern Fetal Neonatal Med 2009; 22: (2): 169–174. DOI: 10.1080/14767050802609767.
21. Picone O., Teissier N., Cordier A.G. Vauloup-Fellous C., Adle-Biassette H., Martinovic J. et al. Detailed in utero ultrasound description of 30 cases of congenital cytomegalovirus infection. Prenat Diagn 2014; (34): 1–7. DOI: 10.1002/pd.4340.22. Irizarry K., Honigbaum S., Demmler-Harrison G., Rippel S., Wilsey M.Jr. Successful Treatment with Oral Valganciclovir of Primary CMV Enterocolitis in a Congenitally Infected Infant. Fetal Pediatr Pathol 2011; (30): 437–441. DOI: 10.3109/15513815.2011.587501.
DOI: 10.3109/15513815.2011.587501.
23. Bar-Meir M., Farrow K.N., Melin-Aldana H., Chadwick E.G. Cytomegalovirus Enterocolitis Mimicking Necrotizing Enterocolitis: Case Report and Review of the Literature. J Ped Infect Dis 2013; 2: (1): 71–75.
24. Khan R., Ranganathan M., Mondal T. Congenital Cytomegalovirus ( Cmv) Infection and Ascending Aorta Dilation. J Cardiol Curr Res 2015; 4: (1): 00130. DOI: 10.15406/jccr.2015.04.00130.
25. Alarcon A., Martinez-Biarge M., Cabanas F., Hernanz A., Quero J., Garcia-Alix A. Clinical, Biochemical, and Neuroimaging Findings Predict Long-Term Neurodevelopmental Outcome in Symptomatic Congenital Cytomegalovirus Infection. J Pediatr 2013; 163: 828-834. DOI: 10.1016/j.jpeds.2013.03.014.
26. Nishida K., Morioka I., Nakamachi Y., Kobayashi Y., Imanishi T., Kawano S. et al. Neurological outcomes in symptomatic congenital cytomegalovirus-infected infants after introduction of newborn urine screening and antiviral treatment. Brain Dev 2015, http://dx.DOI:.org/10.1016/j.braindev.2015.08.003.
Nishida K., Morioka I., Nakamachi Y., Kobayashi Y., Imanishi T., Kawano S. et al. Neurological outcomes in symptomatic congenital cytomegalovirus-infected infants after introduction of newborn urine screening and antiviral treatment. Brain Dev 2015, http://dx.DOI:.org/10.1016/j.braindev.2015.08.003.
27. Capretti M.G., Lanari M., Tani G., Ancora G., Sciutti R., Marsico C. et al. Role of cerebral ultrasound and magnetic resonance imaging in newborns with congenital cytomegalovirus infection. Brain Dev 2014; (36): 203–211. DOI: 10.1016/j.braindev.2013.04.001.
28. Полин Р.А., Спитцер А.Р. Секреты неонатологии и перинатологии. Пер.с англ. Москва: БИНОМ, 2011; 622.
29. [Polin R.A., Spitcer A.R. Secrets of Neonatology and Perinatology. Translation from English. Moscow: BINOM, 2011; 622. (in Russ)]
Moscow: BINOM, 2011; 622. (in Russ)]
31. Bernard S., Wiener-Vacher S., Abbeele T.V.D., Teissier N. Disorders in Children With Congenital Cytomegalovirus Infection. Pediatrics 2015; 136: (4): e887–895.
32. Turner K.M., Lee H.C., Boppana S.B., Carlo W.A., Randolph D.A. Incidence and Impact of CMV Infection in Very Low Birth Weight Infants. Pediatrics 2014; 133: e609–e615. DOI: 10.1542/peds.2013–2217.
33. Duval M., Park A.H. Congenital cytomegalovirus: what the otolaryngologist should know.
34. Павлова М.В., Федорова Н.Е., Гаджиева З.С., Адиева А.А., Евстигнеева Ж.В., Щербо С.Н. и др. Алгоритм лабораторной диагностики врожденной цитомегаловирусной инфекции у недоношенных детей и влияние терапии вифероном на течение внутриутробных инфекций. Педиатрия 2009; 87: (2): 55 – 62. [Pavlova M.V., Fedorova N.E., Gadzhieva Z.S., Adieva A.A., Evstigneeva Zh.V., Shherbo S.N. et al. Algorithm of laboratory diagnosis of congenital cytomegalovirus infection in preterm infants and the effect of therapy with viferon intrauterine infections. Pediatrija 2009; 87: (2): 55–62. (in Russ)]
35. Ross S.A., Ahmed A., Palmer A.L., Michaels M.G., Sánchez P.J., Bernstein D.I. et al. Detection of Congenital Cytomegalovirus Infection by Real-Time Polymerase Chain Reaction Analysis of Saliva or Urine Specimens.
36. Boppana S.B., Ross S.A., Shimamura M., Palmer A.L., Ahmed A., Michaels M.G. et al. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. N Engl J Med 2011; (364): 2111–2118. DOI: 10.1056/NEJMoa1006561.
37. Lanary M., Lazzarotto T., Venturi V., Papa I., Gabrielli L., Guerra B. et al. Neonatal cytomegalovirus blood load and risk of sequelae in symptomatic and symptomatic congenitally infected newborns. Pediatrics 2006; 117: e76–83.
38. Boppana S.B., Fowler K.B., Pass R.F., Rivera L.B., Bradford R.D., Lakeman F.D., Britt W.J. Congenital cytomegalovirus infection: The association between virus burden in infancy and hearing loss. J Pediatr 2005; (146): 817–823.
39. Walter S., Atkinson C., Sharland M., Rice P., Raglan E., Emery V.C., Griffiths P.D. Congenital cytomegalovirus: association between dried blood spot viral load and hearing loss. Arch Dis Child Fetal Neonatal Ed 2008; 93: F280–F285.
40. Запорожан В.Н., Старец Е.А., Дубковская М.В. Особенности нервно-психического развития и слуха у детей с внутриутробной трансмиссией цитомегаловируса. Перинатология и педиатрия 2013; (2): (54): 44–46. [Zaporozhan V.N., Starec E.A., Dubkovskaya M.V. Features of mental development, and hearing in children with intrauterine transmission of cytomegalovirus. Perinatologija i pediatrija 2013; (2): (54): 44–46. (in Russ)]
41. Forner G., Abate D., Mengoli C., Palù G., Gussetti N. High Cytomegalovirus (CMV) DNAemia Predicts CMV Sequelae in Asymptomatic Congenitally Infected Newborns Born to Women With Primary Infection During Pregnancy. J Infect Dis 2015; (212): 67–71. DOI: 10.1093/infdis/jiu627.
J Infect Dis 2015; (212): 67–71. DOI: 10.1093/infdis/jiu627.
42. Ross S.A., Novak Z., Fowler K.B., Arora N., Britt W.J., Boppana S.B. Cytomegalovirus blood viral load and hearing loss in young children with congenital infection. Pediatr Infect Dis J2009; (28): 588–592. DOI: 10.1097/INF.0b013e3181979a27.
43. Park A.H., Mann D., Error M., Miller M., Firpo M.A., Wang Y. et al. Comparative analysis of detection methods for congenital cytomegalovirus infection in a guinea pig model. JAMA Otolaryngol Head Neck Surg 2013; (139): 82–86. DOI: 10.1001/jamaoto.2013.1090.
44. Hashaw J.B., Dudgeon J.A., Marshall W.C. Viral diseases of the fetus and newborn. Philadelphia: Saunders, 1985; 335.
45. Dreher A.M., Arora N., Fowler K.B., Novak Z., Britt W.J., Boppana S.B., Ross S.A. Spectrum of Disease and Outcome in Children with Symptomatic Congenital Cytomegalovirus Infection. J Pediatr 2014; 164: (4): 855-859. DOI: 10.1016/j.jpeds.2013.12.007.
Dreher A.M., Arora N., Fowler K.B., Novak Z., Britt W.J., Boppana S.B., Ross S.A. Spectrum of Disease and Outcome in Children with Symptomatic Congenital Cytomegalovirus Infection. J Pediatr 2014; 164: (4): 855-859. DOI: 10.1016/j.jpeds.2013.12.007.
46. Goderis J., De Leenheer E., Smets K., Van Hoecke H., Keymeulen A., Dhooge I. Hearing loss and congenital CMV infection: a systematic review. Pediatrics 2014; 134: (5): 972-982. DOI: 10.1542/peds.2014–1173.
47. Kimberlin D.W., Jester P.M., Sanchez P.J., Ahmed A., Arav-Boger R., Michaels M.G. et al. Valganciclovir for Symptomatic Congenital Cytomegalovirus Disease. N Engl J Med 2015; (372): 933–943. DOI: 10.1056/NEJMoa1404599.
48. Kimberlin D.W., Lin C.Y., Sanchez P.J., Demmler G.J., Dankner W., Shelton M.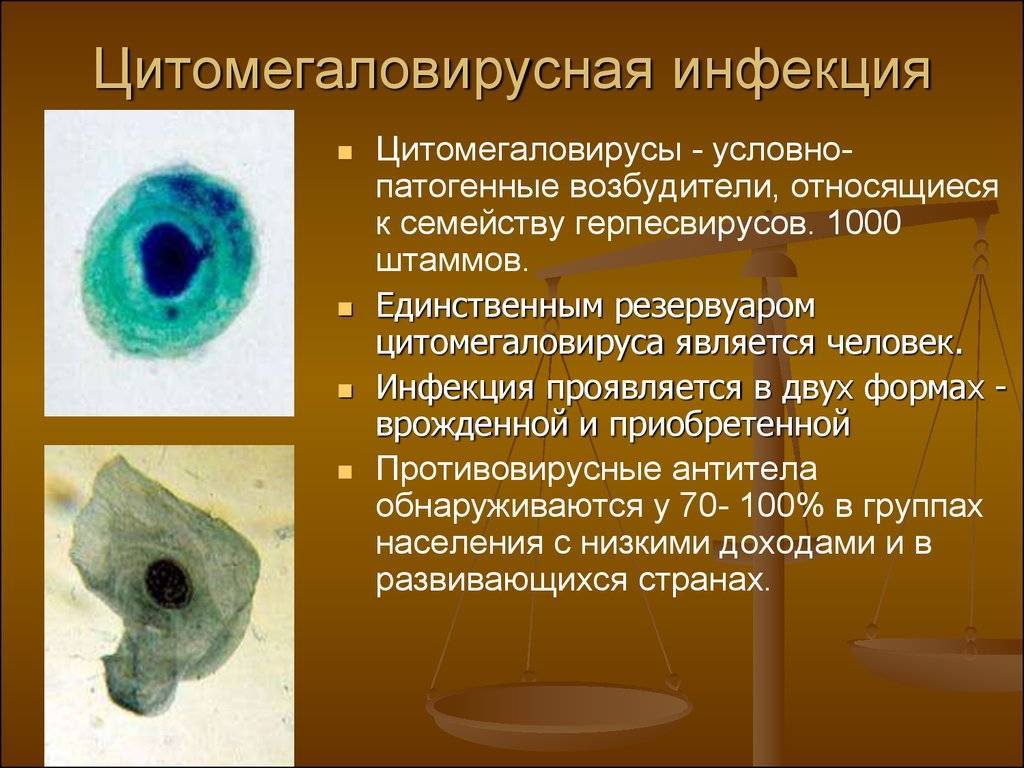 et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: A randomized, controlled trial. J Pediatr 2003; (143): 16–25.
et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: A randomized, controlled trial. J Pediatr 2003; (143): 16–25.
49. Oschman A., Murthy V., Kollipara R., Kenneth Lord R., Oluola O. Intravitreal Ganciclovir for Neonatal Cytomegalovirus-Associated Retinitis: A Case Report. J Perinatol 2013; (33): 329–331. DOI: 10.1038/jp.2012.139.
50. Tawse K.L., Baumal C.R. Intravitreal foscarnet for recurring CMV retinitis in a congenitally infected premature infant. J AAPOS 2014; 18: (1): 78–80.
51. Lacker A., Acham A., Alborno T., Moser M., Engele H., Raggam R.B. et al. Effect on hearing of ganciclovir therapy for asymptomatic congenital cytomegalovirus infection: four to 10 year follow up. J Laryngol Otol 2008; (30): 1–6. DOI: 10.1017/S0022215108003162.
J Laryngol Otol 2008; (30): 1–6. DOI: 10.1017/S0022215108003162.
52. Nassetta L, Kimberlin D, Whitley R. Treatment of congenital cytomegalovirus infection: implications for future therapeutic strategies. J Antimicrob Chemother 2009; 63: (5): 862–867.
53. Luck S.E., Emery V.C., Atkinson C., Sharland M., Griffiths P.D. Compartmentalized dynamics of cytomegalovirus replication in treated congenital infection. J Clin Virol 2016; (82): 152– 158. DOI: 10.1016/j.jcv.2016.07.018. Epub 2016 Jul 27.
54. Erice A. Resistance of Human Cytomegalovirus to Antiviral Drugs Clin Microbiol Rev 1999; 12: (2): 286–297.
55. Choi K.Y., Sharon B., Balfour Jr., Belani K., Pozos T.C., Schleiss M.R. Emergence of antiviral resistance during oral valganciclovir treatment of an infant with congenital cytomegalovirus (CMV) infection. J Clin Virol 2013; 57: (4): 356–360. DOI: 10.1016/j.jcv.2013.04.004.
Emergence of antiviral resistance during oral valganciclovir treatment of an infant with congenital cytomegalovirus (CMV) infection. J Clin Virol 2013; 57: (4): 356–360. DOI: 10.1016/j.jcv.2013.04.004.
56. Hughes B.L., Gyamfi-Bannerman C. Society for Maternal-Fetal Medicine (SMFM). Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol 2016; 214: (6): B5–B11.
57. Weng Y.H., Chu S.M., Lien R.I., Chou Y.H., Lin T.Y. Clinical experience with ganciclovir and anti-cytomegalovirus immunoglobulin treatment for a severe case of congenital cytomegalovirus infection. Chang Gung Med J 2003; 26: (2): 128–132.
58. Aslam M., Anderson J.L., Guglietti D., Cardwell D. CMV-induced neonatal thrombocytopenia: a case report and review of the literature. Am J Perinatol 2007; 24: (7): 429–434.
Am J Perinatol 2007; 24: (7): 429–434.
59. Cekinović D., Golemac M., Pugel E.P., Tomac J., Cicin-Sain L., Slavuljica I. et al. Passive immunization reduces murine cytomegalovirus-induced brain pathology in newborn mice. J Virol 2008; 82: (24): 12172–12180. DOI: 10.1128/JVI.01214–08.
60. Дубковская М.В. Анализ факторов, связанных с тяжестью течения врожденной цитомегаловирусной инфекции. Перинатология и педиатрия 2011; (1): (45): 116–120. [Dubkovskaya M.V. Analysis of factors associated with the severity of congenital cytomegalovirus infection. Perinatologija i pediatrija 2011; (1): (45): 116–120. (in Russ)]
61. Cannon M.J., Stowell J.D., Clark R., Dollard P.R., Johnson D., Mask K. et al. Repeated measures study of weekly and daily cytomegalovirus shedding patterns in saliva and urine of healthy cytomegalovirus-seropositive children. BMC Infect Dis. 2014; 14: 569. DOI: 10.1186/s12879-014-0569-1.
BMC Infect Dis. 2014; 14: 569. DOI: 10.1186/s12879-014-0569-1.
62. Ross E.S., Dollard S.C., Victor M., Sumartojo E., Cannon M.J. The epidemiology and prevention of congenital cytomegalovirus infection and disease: Activities of the Centers For Disease Control and Prevention Workgroup. J Women’s Health 2006; 15: (3): 224–229.
63. Van Zuylen W.J., Hamilton S.T., Naing Z., Hall B., Shand A., Rawlinson W.D. Congenital cytomegalovirus infection: Clinical presentation, epidemiology, diagnosis and prevention. Obstet Med 2014; (7): (4): 140–146. DOI: 10.1177/1753495X14552719.
64. http://www.cdc.gov/cmv/clinical/features.html. Page last updated: June 17, 2016.
65. Cannon M.J., Westbrook K. , Levis D., Schleiss M.R., Thackeray R., Pass R.F. Awareness of and behaviors related to childto- mother transmission of cytomegalovirus. Prev Med 2012; 54: (5): 351–357. DOI: 10.1016/j.ypmed.2012.03.009.
, Levis D., Schleiss M.R., Thackeray R., Pass R.F. Awareness of and behaviors related to childto- mother transmission of cytomegalovirus. Prev Med 2012; 54: (5): 351–357. DOI: 10.1016/j.ypmed.2012.03.009.
66. Jeon J., Victor M., Adler S., Arwady A., Demmler G., Fowler K. et al. Knowledge and awareness of congenital cytomegalovirus among women. Infect Dis Obstet Gynecol 2006; (2006): 1–7.
анализ крови, профилактика, диагностика, лечение
Наиболее распространенным методом обнаружения ЦМВИ (цитомегаловирусной инфекции) является анализ крови на цитомегаловирус. Существуют различные методики обнаружения возбудителя, которые позволяют надежно определить наличие возбудителя. Большинство тестов основано на обнаружении специфических антител, вырабатываемых организмом в ответ на возбудитель. Возможна и ПЦР диагностика, которая дает информацию о наличии ДНК возбудителя в крови, позволяет оценить активность протекания инфекционного процесса и степень распространения возбудителя в организме.
Наиболее распространенным методом обнаружения ЦМВИ (цитомегаловирусной инфекции) является анализ крови на цитомегаловирус. Существуют различные методики обнаружения возбудителя, которые позволяют надежно определить наличие возбудителя. Большинство тестов основано на обнаружении специфических антител, вырабатываемых организмом в ответ на возбудитель. Возможна и ПЦР диагностика, которая дает информацию о наличии ДНК возбудителя в крови, позволяет оценить активность протекания инфекционного процесса и степень распространения возбудителя в организме.
Цитомегаловирусная инфекция человека это вирусное антропонозное заболевание поражающее практически весь организм. Характеризуется большой вариабельностью форм и симптоматики – от бессимптомного носительства до тяжелейших поражений дыхательной, выделительной и других систем организма.
Возбудители инфекции, ее источники
Цитомегаловирус (Cytomegalovirus hominis) относится к роду ДНК-вирусов, отличается большими размерами вириона (до 300 нм), входит в семейство герпесвирусов. Зарегистрировано несколько штаммов возбудителя:
Зарегистрировано несколько штаммов возбудителя:
Источником заражения является больной либо носитель. Возбудитель определяется в биологических жидкостях и выделениях. Пути проникновения вируса:
- Davis.
- Kerr.
- AD-169.
- Towne 125.
Большинство штаммов малоизученны, достоверно известно, что все они могут репродуцироваться, не уничтожая клетку-носитель. Вирус способен длительно сохранятся при комнатной температуре, но чувствителен к нагреву и действию дезинфицирующих средств.
- Воздушно-капельный.
- Контактный.
- Пищевой.
- Парентеральный и трансплацентарный.
По статистическим данным показатель инфицированности составляет до 95%, в зависимости от региона и страны.
Классификация
Общепринятой на мировом уровне системы классификации цитомегаловирусной инфекции (ЦМВИ) нет. На практике применяется классификация, разработанная в 1980 году. Согласно этой системе ЦМВИ делится на:
- Врожденную, может быть острой, хронической.

- Приобретенную, бывает острой, латентной, генерализованной.
По длительности течения выделяют ЦМВИ:
- Острую.
- Затяжную
- Хроническую
- Рецидивирующую.
В зависимости от тяжести течения бывает легкая, среднетяжелая, тяжелая формы протекания.
Механизм зарождения и развития болезни
Вирус попадает в организм через слизистый эпителий различных органов. Свободное нахождение вирусных частиц в кровеносном русле быстро заканчивается внедрением возбудителя в фагоциты мононуклеарного типа. В них происходит начальная репликация цитомегаловируса.
Зараженные клетки увеличиваются, в них можно обнаружить крупные внутриядерные включения, которые являются скоплениями вирусных тел. Увеличение количества пораженных клеток проявляется развитием множественных узелковых инфильтратов либо кальцификатов в тканях. Особенно активно размножение возбудителя в слюнных железах, в которых его проще всего обнаружить.
Возбудитель способен длительно сохранятся в клетках, единственным проявлением инфекции будет подавление клеточного иммунитета. У большинства болезнь протекает скрыто и переходит в бессимптомное носительство.
Обострение ЦМВИ возникает у больных с подавленным иммунитетом. Наиболее частые причины ослабления защитных сил организма:
- Прием иммуносупрессоров.
- ВИЧ-инфекция.
- Беременность.
В результате вирус активируется, начинается активное размножение возбудителя во всех органах и тканях, развивается клиника одной из форм заболевания. Тяжелые поражения ЦМВИ в большинстве случаев ассоциированы с ВИЧ-инфекцией.
Клиническая картина
Продолжительность инкубационного периода остается невыясненной так как начальные формы ЦМВИ протекают латентно. Характерные клинические симптомы развиваются в результате воздействия факторов, ослабляющих иммунитет.
Врожденная ЦМВИ-инфекция у детей в ранних периодах жизни также протекает как бессимптомное носительство. Затем проявляется в виде различных тяжелых осложнений, наиболее частые:
Затем проявляется в виде различных тяжелых осложнений, наиболее частые:
- Глухота.
- Хориоретинит.
- Цитомегаловирусный синдром.
В особо тяжелых случаях врожденная ЦМВ-инфекция приводит к возникновению вторичных патологий и летальному исходу в первые недели жизни. Избежать этих последствий можно сделав анализ крови на цитомегаловирус перед зачатием ребенка.
Острая врождённая ЦМВИ
Является следствием первичного заражения матери в процессе беременности. Развивается примерно у 5% детей заразившихся ЦМВ-инфекцией внутриутробно. В остальных случаях протекает скрыто, не приводит к серьезным последствиям. Летальность острой врожденной ЦМВ-инфекции высока, составляет до 30% от заболевших. Выжившие дети зачастую страдают от тяжелых последствий, в их перечень входят:
- Задержка в физическом и психическом развитии.
- Хроническая желтуха.
- Гидроцефалия.
- Поликистоз поджелудочной.
Если заражение ребенка произошло на ранних сроках эмбриогенеза, плод с высокой вероятностью погибнет. У выживших наблюдаются серьезные дефекты и аномалии развития:
У выживших наблюдаются серьезные дефекты и аномалии развития:
- Микроцефалия.
- Гипоплазия легких.
- Дефекты строения почек сердца и аорты.
- Атрезия пищевода.
- Хроническая врождённая ЦМВИ
Летальность при развитии этой формы инфекции невысока, она характеризуется развитием тяжелых патологий органов и систем ребенка. В их число входят: гидро- и микроцефалия, помутнение хрусталика, глухота, микрогирия (недоразвитость извилин головного мозга).
Приобретённая ЦМВ-инфекция
У большинства зараженных протекает без выраженной клиники, в виде субклинической формы либо латентного вирусоносительства. Переход в клинически выраженное заболевание наблюдается при различных нарушениях в работе иммунитета возникающих под воздействием разнообразных факторов риска.
При этом развивается острая приобретенная ЦМВИ, симптомы которой схожи с вирусным гепатитом либо инфекционным мононуклеозом. Может протекать скрытно, выявляется случайно при скрининговом анализе крови на цитомегаловирус.
Еще одна часто встречающаяся форма приобретенной ЦМВ-инфекции – мононуклеозоподобный синдром. Клинические проявления этой формы практически идентичны другому заболеванию, вызванному герпесвирусом Эпштейна-Барра – инфекционному мононуклеозу.
Период инкубации может длиться до 60 дней. Активная фаза заболевания начинается с гриппоподобных симптомов: длительной лихорадки, озноба, выраженных болей в мышцах, суставах, сильной утомляемости. Больные часто жалуются на першение в горле, наблюдается увеличение региональных лимфоузлов, кожные высыпания.
Изредка возможно проявление симптомов гепатита, таких как желтуха. В анализе крови наблюдается увеличение ферментов печени (АлАТ, АсАТ). Возможно развитие пневмонии, вероятность поражения легких составляет 5-6%.
Длительность заболевания может составлять до 1-2 месяцев, после чего у большинства больных происходит полное выздоровление. Некоторые симптомы сохраняются дольше, например, увеличенные лимфоузлы могут сохраняться на срок до полугода.
Приобретенная Цитомегаловирусная инфекция у новорожденных
Развивается в результате инфицирования новорожденного при прохождении родовых путей либо на начальных этапах жизни – при вскармливании грудью, контактах с носителями вируса. У большинства детей бессимптомно преобразуется в форму носительства.
Клинические симптомы проявляются в случае тяжелой недоношенности либо маловесности ребенка. Инфекция протекает в виде длительной пневмонии, часто присоединяется бактериальное поражение дыхательной системы. Не исключено развитие гепатита, увеличение лимфоузлов, задержки в умственном, физическом развитии. При беременности необходимо сдавать массу анализов, которые помогают выявить наличие не только ЦМВ-инфекции, но и токсоплазмоза.
Генерализованная форма ЦМВ-инфекции
Развивается у зараженных с крайне ослабленным иммунитетом. Отличается серьезным повреждением печени, нервной системы, ЖКТ, легких. Степень тяжести патологии зависит от состояния иммунной системы, особенно тяжелые проявления наблюдаются у принимающих иммуносупрессоры и больных СПИДом.
Основные клинические проявления при генерализованной ЦМВ-инфекции:
- Подострое начало. Для него характерны: выраженный упадок сил, лихорадка, повышенное потоотделение в ночное время суток, больные жалуются на боль в суставах, мышцах.
- Язвы желудка, кишечника и пищевода, проявляются в виде болей в животе, диспепсических явлениях. Могут привести к внутренним кровотечениям и прободениям в стенках ЖКТ.
- Гепатит. Наблюдается желтуха, болезненность и увеличение печени.
- Пневмония. Появляется боль в груди, кашель, увеличивается ЧДД.
- Энцефалит. Основные проявления: нистагм (ритмичные подергивания глаз), сонливость, поражение одной либо нескольких пар черепных нервов, дезориентация. У ВИЧ-положительных может развиться СПИД-дементный синдром.
- Ретинит. Приводит к полной либо частичной слепоте.
- Полиорганная недостаточность. Самая часто встречающаяся причина смерти при генерализованном инфекционном процессе. Проявляется в виде дисфункции всех органов и систем пораженного вирусом организма.
Диагностика инфекции
В обычном анализе крови у страдающих ЦМВ-инфекцией наблюдается:
- Выраженный лимфоцитоз.
- Атипичные мононуклеары (до 10% и более).
- Общее количество лейкоцитов редко выходит за пределы нормы. У новорожденных возможно обнаружение тромбоцитопении и снижения количества эритроцитов. При биохимическом анализе крови наблюдается увеличение активности печеночных ферментов.
В пробах спинномозговой жидкости у пациентов с поражением ЦНС выявляют увеличение белковых компонентов, нейтрофильный плеоцитоз и значительное снижения уровня глюкозы.
Лечение
Основана на проведении серологических исследований крови на цитомегаловирус – обнаруживаются специфические для этой инфекции антитела. В их число входят:
- Иммуноглобулин М. Это маркеры острого инфекционного процесса при первичном заражении либо развитии обострения. Выходят за пределы нормы только через 1-2 месяца после проникновения вируса в организм. Увеличенные показатели могут сохраняться до полугода. Высокий титр IgM у беременных означает, что есть риск заражения эмбриона.
- Иммуноглобулин G. Малорелевантная разновидность иммуноглобулинов. Повышается достаточно поздно, в период затухания инфекционного процесса. Служит для обнаружения цитомегаловируса в организме.
- ПЦР. Позволяет точно выявить генетический материал вируса в крови, других биологических жидкостях, тканях. Ее разновидность – количественная ПЦР дает возможность отслеживать активность развития инфекционного процесса так как дает данные о величине воспроизводства вирионов.
- Прямая микроскопия. Основывается на прямом наблюдении зараженных клеток обладающих специфической морфологией. Для анализа подходят материалы, полученные при биопсии, осадки мочи, слюны, кровь. Они отличаются огромными размерами, большим внутриядерным включением, которое окружает светлый ободок, это так называемый «совиный глаз». Микроскопия – самый простой и доступный метод обнаружения ЦМВ-инфекции.
Профилактика
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфического лечения, даже при выявлении специфических антител. Лечения таких форм цитомегаловируса направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для лечения клинически активных форм ЦМВ-инфекции применяют 3 препарата, обладающих достаточной эффективностью:
- Ганцикловир. Вводится путем внутривенных вливаний дважды в сутки. Курс лечения длится 2-3 недели. Особенно эффективен в комбинации с Citotect – специфическим иммуноглобулином, который также вводится внутривенно.
- Фоскарнет. Применяется если лечение ганцикловиром было недостаточно эффективным. Вводится внутривенно трижды в день, путем медленного введения (длительность инфузии не менее 2 часов).
- Цидофовир. Еще один препарат выбора при ЦМВИ, который применяется при резистентности к ганцикловиру. Вводится внутривенно, 1 раз в неделю.
Эти препараты противопоказаны для применения беременным. В этом случае назначается патогенетическая терапия. В нее входят разнообразные препараты интерферона (виферон, роферон) а также индукторы выработки собственных интерферонов – циклоферон, неовир.
Введение интерферонов и других иммуномодулирующих препаратов происходит под контролем иммунологического статуса. При неэффективности иммуномодуляторов возможно назначение курса, человеческого иммуноглобулина который вводится путем внутримышечных инъекций в количестве от 3 до 5 с промежутком в 2-3 дня.
Различные формы ЦМВ-инфекции могут маскировать под схожие по симптомам заболевания. Поэтому требуется дифференциальная диагностика с:
- Сепсисом.
- Инфекционным мононуклеозом.
- Бактериальным менингитом.
Специфическая диагностика
Основное направление в профилактике ЦМВИ – соблюдение правил личной гигиены, индивидуальная защита при контакте с больными цитомегаловирусом. Особенно важно соблюдать профилактические рекомендации людям, входящим в группу риска:
- Пациенты, перенесшие трансплантацию.
- Беременные.
- ВИЧ-инфицированные.
- Больные страдающие иммунодефицитами.
Средства для специфической профилактики находятся в разработке. Единственный препарат, который позволяет проводить профилактику у пациентов после трансплантации – летермовир. Широкого применения он пока не нашел, рекомендован к использованию только в США.
Обследование на цитомегаловирусную инфекцию в Медарт
Лаборатория клиники Медарт оборудована современным высокоточным оборудованием, которое позволяет выполнить любые виды диагностики цитомегаловирусной инфекции и другие виды серологической диагностики инфекционных заболеваний (диагностика на ВИЧ, сифилис, гепатит, лямблиоз, Helicobacter pylory, токсоплазмоз).
Анализ крови на цитомегаловирус входит в комплекс анализов на ИППП (инфекции, передающиеся половым путем). Также есть возможность провести диагностику ЦМВИ по индивидуальным показателям, например, при планировании беременности.
При необходимости результаты теста можно получить в день сдачи материала. Это особенно важно при тяжелых формах ЦМВ-инфекции, когда решающую роль играет скорость постановки диагноза и назначения эффективного лечения. Преимущества клиники:
- Возможность выполнить полный спектр диагностических процедур.
- Оптимальная ценовая политика.
- Квалифицированные специалисты.
Пациенты клиники Медарт получают полный спектр медицинских услуг – от предварительного приема и лабораторной диагностики цитомегаловируса до назначения эффективной терапии и получения рекомендаций по профилактике и реабилитации после перенесенного заболевания.
Cytomegalovirus, IgG
Антитела класса IgG к цитомегаловирусу – специфические иммуноглобулины, вырабатывающиеся в организме человека в период выраженных клинических проявлений цитомегаловирусной инфекции и являющиеся серологическим маркером этого заболевания, а также перенесенной в прошлом цитомегаловирусной инфекции.
Синонимы русские
Антитела класса IgG к цитомегаловирусу (ЦМВ).
Синонимы английские
Anti-CMV-IgG, CMV Antibody, IgG.
Метод исследования
Электрохемилюминесцентный иммуноанализ (ECLIA).
Единицы измерения
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Цитомегаловирус (ЦМВ) относится к семейству вирусов герпеса. Так же, как и другие представители этой группы, он может сохраняться у человека всю жизнь. У здоровых людей с нормальным иммунитетом первичная инфекция протекает без осложнений (и часто бессимптомно). Однако цитомегаловирус опасен при беременности (для ребенка) и при иммунодефиците.
Цитомегаловирусом можно заразиться через различные биологические жидкости: слюну, мочу, сперму, кровь. Кроме того, он передается от матери к ребенку (во время беременности, родов или при кормлении).
Как правило, цитомегаловирусная инфекция протекает бессимптомно. Иногда заболевание напоминает инфекционный мононуклеоз: повышается температура, болит горло, увеличиваются лимфатические узлы. В дальнейшем вирус сохраняется внутри клеток в неактивном состоянии, но если организм окажется ослаблен, то он снова начнет размножаться.
Для женщины важно знать, была ли она заражена ЦМВ в прошлом, потому что именно это определяет, есть ли риск осложнений при беременности. Если раньше она уже была инфицирована, то риск минимален. Во время беременности может обостриться старая инфекция, однако такая форма обычно не вызывает тяжелых последствий.
Если у женщины еще не было ЦМВ, значит, она входит в группу риска и ей следует уделять особое внимание профилактике ЦМВ. Для ребенка опасна именно инфекция, которой мать заразилась первый раз во время беременности.
При первичной инфекции у беременной женщины вирус часто попадает и в организм ребенка. Это еще не означает, что он заболеет. Как правило, заражение ЦМВ протекает бессимптомно. Однако примерно в 10 % случаев оно приводит к врождённым патологиям: микроцефалии, церебральной кальцификации, сыпи и увеличению селезенки и печени. Это часто сопровождается снижением интеллекта и глухотой, возможен даже летальный исход.
Таким образом, для будущей матери важно знать, была ли она в прошлом заражена ЦМВ. Если да, то риск осложнений из-за возможного ЦМВ становится незначительным. Если же нет – нужно проявлять особую осторожность во время беременности:
- избегать незащищенного секса,
- не контактировать со слюной другого человека (не целоваться, не использовать общую посуду, зубные щетки и пр.),
- соблюдать правила гигиены при играх с детьми (мыть руки, если на них попадает слюна или моча),
- сдавать анализ на ЦМВ при признаках общего недомогания.
Кроме того, цитомегаловирус представляет опасность при ослаблении иммунной системы (например, из-за иммунодепрессантов или ВИЧ). При СПИДе ЦМВ протекает в тяжелой форме и является частой причиной смерти больных.
Основные симптомы цитомегаловирусной инфекции:
- воспаление сетчатки (которое может приводить к слепоте),
- колит (воспаление толстой кишки),
- эзофагит (воспаление пищевода),
- неврологические расстройства (энцефалит и др.).
Выработка антител – это один из способов борьбы с вирусной инфекцией. Существует несколько классов антител (IgG, IgM, IgA и др.).
Антитела класса G (IgG) присутствуют в крови в наибольшем количестве (по сравнению с другими типами иммуноглобулинов). При первичной инфекции их уровень возрастает в первые недели после заражения и затем может оставаться высоким годами.
Кроме количества, часто определяется еще и авидность IgG – прочность, с которой антитело связывается с антигеном. Чем выше авидность, тем прочнее и быстрее антитела связывают вирусные белки. Когда человек впервые заражается ЦМВ, его антитела IgG обладают низкой авидностью, потом (через три месяца) она становится высокой. По авидности IgG судят о том, как давно произошло первоначальное заражение ЦМВ.
Для чего используется исследование?
- Чтобы установить, был ли человек в прошлом инфицирован ЦМВ.
- Для диагностики цитомегаловирусной инфекции.
- Чтобы установить возбудителя заболевания, которое похоже на цитомегаловирусную инфекцию.
Когда назначается исследование?
- Во время беременности (или при ее планировании) – для оценки риска осложнений (проверочное исследование), при симптомах цитомегаловирусной инфекции, при нарушениях у плода по результатам УЗИ.
- При симптомах цитомегаловирусной инфекции у людей с ослабленным иммунитетом.
- При симптомах мононуклеоза (если тесты не выявили вирус Эпштейна – Барр).
Что означают результаты?
Референсные значения
Концентрация: 0 — 0,5 Ед/мл.
Результат: отрицательный.
Отрицательный результат при беременности
- Женщина раньше не была инфицирована ЦМВ – есть риск приобрести первичную ЦМВ-инфекцию. Однако если с момента заражения прошло не больше 2-3 недель, то IgG могли еще не появиться. Чтобы исключить этот вариант, нужно сдать анализ повторно через 2 недели.
Положительный результат до беременности
- Женщина уже была инфицирована ЦМВ в прошлом – риск осложнений минимален.
Положительный результат во время беременности
- Нельзя сделать однозначный вывод. Возможно, ЦМВ попал в организм до беременности. Но не исключено, что женщина заразилась недавно, в начале беременности (за несколько недель до теста). Такой вариант представляет опасность для ребенка. Для точного диагноза нужны результаты других анализов (см. таблицу).
При попытке установить возбудителя неизвестного заболевания единичный тест на IgG дает мало информации. Нужно учитывать результаты всех анализов.
Результаты тестов в разных ситуациях
|
|
Первичная инфекция |
Обострение давней инфекции |
ЦМВ в латентном состоянии (человек был инфицирован в прошлом) |
Человек не заражен ЦМВ |
|
Результаты тестов |
IgG: первые 1-2 недели отсутствуют, потом их количество увеличивается. IgM: есть (высокий уровень). Авидность IgG: низкая. |
IgG: есть (количество увеличивается). IgM: есть (невысокий уровень). Авидность IgG: высокая. |
IgG: присутствуют на постоянном уровне. IgM: обычно нет. Авидность IgG: высокая.
|
IgG: нет. IgM: нет. |
Важные замечания
- Иногда нужно узнать, заражен ли цитомегаловирусом сам новорождённый ребенок. Однако анализ на IgG в данном случае неинформативен. IgG могут проникать через плацентарный барьер, поэтому, если антитела есть у матери, то они же будут присутствовать и у ребенка.
- Что такое реинфекция? В природе существует несколько разновидностей ЦМВ, так что возможна ситуация, когда человек, уже инфицированный одним типом вируса, заражается еще раз другим.
Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, инфекционист, гинеколог.
Литература
- Adler S. P. Screening for cytomegalovirus during Pregnancy. Infect Dis Obstet Gynecol. 2011:1-9.
- Goldman’s Cecil Medicine. 24th ed. Goldman L, Schafer A.I., eds. Saunders Elsevier; 2011.
- Lazzarotto T. et al. Why is cytomegalovirus the most frequent cause of congenital infection? Expert Rev Anti Infect Ther. 2011; 9(10): 841-843.
ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ КИШЕЧНИКА | Халиф
1. Аглямова, Т.А. Популяционные аспекты эпидемиологии герпесвирусных инфекций в крупном промышленном городе / Т.А.Аглямова, И.М.Хаертынова, Р.Т.Нугманов и соавт. // Практическая медицина. — 2017. — №4 (105) — с. 56-62.
2. Барышников Е.Н. Цитомегаловирусная инфекция у больных язвенным колитом. / Е.Н.Барышников, В.Н.Дроздов, И.С.Шулятьев и соавт. // Экспериментальная и клиническая гастроэнтерология. — 2010. — №10. — с. 25-28.
3. Волынец, Г.В. Воспалительные заболевания кишечника и хронические активные герпесвирусные инфекции у детей / Г.В.Волынец, Д.Л.Беляев, Ф.П.Филатов и соавт. // Детские инфекции. — 2015. -т. 14, №2 — с. 16-22.
4. Галегов, Г.А. Химиотерапия вирусных инфекций. / Г.А.Галегов, В.Л.Андронова // Мед. вирусология. -2008. — с. 87-92.
5. Ершов, Ф.И. Прогнозирование эффективности интерферонотерапии при различных формах патологии. / Ф.И.Ершов, Н.В.Касьянова // Иммунология. — 2001. — №4. — с. 3-7.
6. Жукова, Л.И. Острая цитомегаловирсуная инфекция у взрослых не ВИЧ-инфицированных пациентов / Л.И.Жукова, В.В.Лебедев, В.Н.Городин и соавт. // Инфекционные болезни. — 2013. — т. 11. -№1 — с. 37-43.
7. Извекова, И. Я. Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения / И.Я.Извекова, М.А.Михайленко, Е.И.Краснова // Лечащий врач. — 2018. — №4. — с. 90.
8. Князев, О.В. Длительная терапия язвенного колита инфликсимабом в реальной клинической практике / О.В.Князев, А.И.Парфенов, А.В.Каграманова и соавт. // Терапевтический архив. — 2016. — т. 88. -№8 — с. 6-52.
9. Кочкина, С.С. Особенности цитомегаловирусной инфекции: обзор литературы / С.С.Кочкина, Е.П.Ситникова // Доктор.ру. — 2016. — №6 (123). -с. 62-67.
10. Маркова, Д.О., Цитомегаловирусная инфекция у больных с воспалительными заболеваниями кишечника / Д.О.Маркова, Р.А.Насыров, М.О.Реванова // Педиатр. — 2013. — т. 4. — №1. — с. 95-99.
11. Петров, В.И. Противовирусные средства / В.И.Петров, Э.Б.Белан // Москва, 2012. — 223 с.
12. Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. / под редакцией _ Д.К.Львова — Москва, 2013. — 1197 с.
13. Трахтман, П.Е. Современные подходы к лечению цитомегаловирусной инфекции (клиническая лекция) / П.Е.Трахтман, Балашов Д.И., Кошаков Е.Д // Проблемы репродукции. — 2005. — т. 11. — №4. -с. 47-50.
14. Церах, Т.М. Цитомегалия, ассоциированная с иммуносупрессией / Т. М. Церах, А. В. Полянская // Военная медицина. — 2016. — №2 (39) — с. 145-146.
15. Цитомегаловирусная инфекция у взрослых (исключая больных ВИЧ-инфекцией): клинические рекомендации по ред. Шестаковой, И.В. — Москва: 2014. — 74 с.
16. Andreoni, K.A. Human cytomegalovirus hyperimmune globulin not only neutralizes HCMV infectivity, but also inhibits HCMV-induced intracellular NF-kappa B, Sp1, and PI3-K signaling pathways. / K.A.Andreoni, X.Wang, S.M.Huang et al. // J. Med. Virol. — 2002. — №67 (1). — p. 33-40.
17. Biron, K.K. Antiviral drugs for cytomegalovirus diseases. / K.K.Biron // Antiviral. Res. — 2006. -71 (2-3). — p. 154-63.
18. Carbone, J. Potential Immunomodulatory Role of Specific Anticytomegalovirus Intravenous Immunoglobulinin Heart Recipients. / J.Carbone, A.Gallego, J.Fernandez Yanez, et al. // Transplant. Proc. — 2016. — №48 (9). — p. 3027-3029.
19. Chakravarti, A. Relationship of IgG avidity index and IgM levels for the differential diagnosis of primary from recurrent cytomegalovirus infections. / A.Chakravarti, B.Kashyap., A.Wadhwa // Iran J. Allergy Asthma Immunol. — 2007. — №6 (4). — p. 197-201.
20. Ciccocioppo, R. Differential cellularlocalization of Epstein-Barrvirus and human cytomegalovirus sin the colonic mucosa of patients with active or quiescent inflammatory bowel disease / R.Ciccocioppo, F.Racca, P.Formangana et al. // Immunologic Research. -2016. — v. 64. — №1. — p. 191-203.
21. Fajfr, M. Cytomegalovirus and its relationship to chronic inflammatory bowel diseases and tumors / M.Fajfr, V.Stepanova // Klinicka Mikrobiologie a Infekcni Lekarstvi. — 2013. — v. 19. — №3 — p. 106-109.
22. Ford A.C., Opportunistic infections with anti-necrosis factor-а therapy in inflammatory bowel disease: meta-analysis of randomized controlled trials / A.C.Ford, L.Peyrin-Biroulet // The American Journal of Gastroenterology. — 2013. — v. 108. — №8. -p. 1268-1276.
23. Gecse, K.B. Differential diagnosis of inflammatory bowel disease: imitations and complications. / K.B.Gecse, S.Vermeire // Lancet Gastroenterol. Hepatol. — 2018. — №3 (9). — p. 644-653.
24. Hamprecht, K. Human cytomegalovirus and congenital virus infection. / K.Hamprecht G.Jahn // Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. — 2007. — 50 (11). — p. 1379-1392.
25. Inflammatory Bowel Disease Group Chinese Society of Gastroenterology, Chinese Medical Association. Evidence-based consensus on opportunistic infections in inflammatory bowel disease (republication). // Intest. Res. — 2018. — 16 (2). — p. 178-193.
26. Johnson, J. CMV Disease in IBD: Comparison of Diagnostic Tests and Correlation with Disease Outcome. / J.Johnson, K.Affolter, K.Boynton et al. // Inflamm. Bowel Dis. — 2018. — 24 (7). — p. 1539-1546.
27. Kredel, L.I. Accuracy of diagnostic tests and a new algorithm for diagnosing cytomegalovirus colitis in inflammatory bowel diseases: a diagnostic study. / L.I.Kredel, P.Mundt L.vanRiesen et al. // Int. J. Colorectal Dis. — 2018.
28. Li, Y. Case-Control Study of Inflammatory Bowel Disease Patients with and without Clostridium difficile Infection and Poor Outcomes in Patients Coinfected with C.difficile and Cytomegalovirus. / Y.Li, H.Xu, T.Xu et al. // Dig. Dis. Sci. — 2018. — 63 (11). — p. 3074-3083.
29. Mercorelli, B. Human cytomegalovirus DNA replication: antiviral targets and drugs / B.Mercorelli, E.Sinigalia, A.Loregian et al. // Rev. Med. Virol. — 2008. — 18 (3). — p. 177-210.
30. Nowacki, T.M. Novel score predicts risk for cytomegalovirus infection in ulcerative colitis. / T.M.Nowacki, D.Bettenworth, T. Meister et al. // J. Clin. Virol. — 2018. — 105. — p. 103-108.
31. Patel, R. Cytomegalovirus prophylaxis in solid organ transplant recipients. / R.Patel, D.R.Snydman, R.H.Rubin // Transplantation. — 1996. — №61 (9). -p. 1279-89
32. Rahier, J.F., Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease / J.F.Rahier et al. // Journal of Crohn’s and Colitis. — 2013. — №00918 — p. 3-29.
33. Rowan, C. Severe Symptomatic Primary CMV Infection in Inflammatory Bowel Disease Patients with Low Population Seroprevalence. / C.Rowan, C.Judge, M.D.Cannon // Gastroenterol. Res. Pract. — 2018. -p. 28.
34. Steininger, C. Novel therapies for cytomegalovirus disease. / C.Steininger // Recent Patents Anti-Infect Drug Disc. — 2007. — №2 (1) — p. 53-72.
35. Tsuchido, Y. Real-time quantitative PCR analysis of endoscopic biopsies for diagnosing CMV gastrointestinal disease in non-HIV immunocompromised patients: a diagnostic accuracy study. / Y.Tsuchido, M.Nagao et al. // Matsuura Eur. J. Clin. Microbiol. Infect. Dis. — 2018. — p. 25.
Лечение цитомегаловирусной инфекции. Список клиник, рейтинг, отзывы, цены
О заболевании
Цитомегаловирус – это широко распространенный вирус, который распространяется через все жидкости организма. Следовательно, им можно заразиться во время полового акта, поцелуев или даже питья из одного стакана. Несмотря на то, что цитомегаловирус остается в организме человека на всю его оставшуюся жизнь, он редко вызывает какие-либо серьезные осложнения и в большинстве случаев зараженный человек даже не подозревает о его присутствии.
Тем не менее, цитомегаловирусная инфекция может представлять собой опасность для беременных женщин или для людей со слабой иммунной системой. Если заражение цитомегаловирусом произошло во время развития плода, существует вероятность того, что мать передаст инфекцию своему ребенку. Цитомегаловирус может быть очень опасным для людей с ослабленной иммунной системой, включая пациентов с ВИЧ или тех, кто перенес хирургическое вмешательство (особенно трансплантацию органов).
Новорожденные младенцы, которые заразились цитомегаловирусом во время внутриутробного периода (или вскоре после рождения через грудное молоко матери) могут весить меньше, чем обычно, и, скорее всего, у них могут возникнуть проблемы со слухом и зрением. Кожа у таких малышей может быть желтой с красными следами, напоминающими сыпь.
Симптомы
(У детей)
- Преждевременное рождение или небольшой вес при рождении
- Желтуха
- Проблемы с печенью и селезенкой
- Кожная сыпь
- Аномально маленькая головка (микроцефалия)
- Вероятность развития у ребенка пневмонии и/ или судорожных припадков
(У людей с ослабленным иммунитетом)
- Проблемы со зрением и дыханием
- Проблемы с функционированием органов, включая головной мозг
В других случаях взрослые люди на протяжении недлительного времени могут замечать у себя симптомы, напоминающие мононуклеоз (патологическая усталость, высокая температура, боль в горле, мышечная боль), но со временем они снова начинают чувствовать себя хорошо.
Диагностика
- Во время общего обследования врач спрашивает пациента, испытывал ли он какие-либо из перечисленных выше симптомов.
- Многим беременным женщинам рекомендуется пройти лабораторные исследования крови, чтобы проверить, не заразились ли они какими-либо инфекциями, включая цитомегаловирус. Если беременная женщина заражена цитомегаловирусом, но у нее высокий уровень антител в крови, маловероятно, чтобы она может передать недуг своему ребенку.
- Кроме того, на протяжении первых нескольких месяцев жизни младенцев тщательно проверяют.
- Как правило, для выявления у кого-либо цитомегаловируса и определения его состояния (активный или пассивный) достаточно исследования всех жидкостей в организме человека (крови, слюны, мочи, спермы).
- Цитомегаловирус также может выявить ультразвуковое исследование.
Виды лечения
- Консервативное лечение, например принятие противовирусных лекарств, помогает облегчить прогрессирование вируса.
- Полное устранение цитомегаловируса невозможно, но в большинстве случаев при своевременном диагностировании недуга врачи могут предотвратить развитие осложнений.
- Для укрепления иммунной системы нужно вести здоровый образ жизни. Таким образом, снижается и риск развития симптомов.
Автор: Доктор Сергей Пащенко
4. Лечение ЦМВ у ребенка
Лечению подлежат, только активированные формы инфекции, в остальных случаях лечение не проводят, так как вирус является пожизненным спутником 50% детей дошкольного возраста и 80% взрослых. Находится в организме, как правило, бессимптомно.
_____________________________________________________________________________________________
Активность ЦМВ необходимо определить количественным методом ПЦР в крови, слюне и моче. Только после этого можно говорить о показаниях к лечению и выборе терапевтической схемы.
______________________________________________________________________________________________
Вам нужно сдать кровь для определения уровня антителIgG и IgM к ЦМВ.
Наличие IgG и IgM или только IgM- свидетельствует о наличии острой инфекции и требует определенного лечения (иммуностимулирующие, общеукрепляющие препараты)- беременеть в этот период нельзя.
Наличие только IgG антител указывает на носительство вируса, который находится в латентном состоянии. В этом случае во время беременности нужно проводить профилактику активации вируса (здоровый образ жизни, свежий воздух, поливитамины и .д.).
Если антитела IgG не будут выявлены- о в дополнение к профилактическим мероприятиям нужно будет каждые 3 месяца сдавать кровь на к ЦМВ,чтобы не пропустить первичного инфицирования и вовремя пролечиться.
______________________________________________________________________________________________
Лечение цитомегаловируса не позволяет полностью его устранить, однако возможно избавление пациента от его проявлений, а также укрепление иммунитета, не позволяющего ему активизироваться.
Острая форма цитомегаловирусной инфекции у детей лечится с помощью антивирусных препаратов, которые «загоняют» цитомегаловирус в безопасную, пассивную форму.
_______________________________________________________________________________________________
Активную цитомегаловирусную инфекцию лечить нужно, так как она может угрожать жизни или зрению пациента, но выбор лекарства и продолжительности курса зависит от Вашего состояния.
Лечение цитомегаловирусной инфекции у новорожденных и детей первого года жизни целесообразно проводить в условиях стационара.
Лечение обычно включает :
1. Специфический антицитомегаловирусный иммуноглобулин (цитотект) в дозе 25-50 единиц на килограмм массы — не менее 6 доз с интервалом в 2 недели.
2. Кроме того, обычно назначают рекомбинантный интерферон (роферон) в дозе 500.000-1 млн МЕ 1 раз в сутки первые 14 дней, затем в той же дозировке через день, под контролем титра антител до полутора — трех месяцев, затем (при необходимости) до 3-6 мес. Курсы по 4 недели.
3. Целесообразно также назначить ребенку неовир (по 1 дозе ежедневно внутримышечно в течение 3 дней, затем по 1 дозе через день в течение последующих 4 дней).
4. По показаниям проводится дополнительная симптоматическая терапия.
5. Применение ганцикловира показано при состояниях угрожающих жизни или зрению ребенка.
6. Решение о применении того или иного средства для терапии — за врачом, который сможет эффективно отслеживать изменения и вовремя корректировать терапию, в зависимости от того, насколько она помогает Вашему ребенку.
______________________________________________________________________________________________
Ситуация, когда вирус перестает определяться в крови и еще долго (иногда – много месяцев и даже годами) обнаруживается в моче и/или слюне абсолютна типична. Почки и слюнные железы – места излюбленного проживания этого вируса.
Вопрос с лечением решают на основании клинических симптомов у ребенка, состояния физического и психического развития, а также потенциальной угрозы отдаленных последствий. Однако с большой долей вероятности такое лечение может понадобиться – необходимо добиться полного прекращения вирусной репликации не только в крови, но и в моче и слюне. Назначенные препараты не относятся к специфическим препаратам против ЦМВ, поэтому лечение ими повторять не следует.
______________________________________________________________________________________________
Вопрос: Как лечить ЦМВ ?
Ответ простой и банальный : здоровый образ жизни без стрессов и хронических очагов инфекций (аденоиды, дискинезии ЖКТ, дизбактериоз…), т.е. такой, какой поможет укрепить иммунитет.
Поройтесь в инете, где есть масса советов по закаливанию, питанию, физкультуре, фитотерапии, акупунктуре, краниосакральной терапии, гомеопатии, антигомотоксической терапии и т.д.
Только в комплексе и постоянной периодичности использования перечисленных методов добьетесь положительного результата.
Важен режим семьи и ее психо-ментальный дух.
_____________________________________________________________________________________________
Цитомегаловирус и хламидии — это внутриклеточные паразиты, которые используют клетки клетки иммунитета и органов хозяина для своей защиты.
Находясь во внутриклеточном и неактивном состоянии, они не чувствительны к антибиотикам.
Поэтому, до начала лечения надо узнать их активность в тестах anti-CMV-Ig М, Авидность anti-CMV-IgG, anti-Chlamidia trachomatis-Ig М и А.
Если есть «Скачки» температуры — исключите стафилококковую инфекцию, вегето-сосудистую дистонию, невроз, туберкулез и заболевание почек.
Сделайте бакпосев на вторичную микрофлору из носа и зева, а также посейте кал на дизбактериоз.
Важен общий ан крови из пальца (можно и венозную кровь, чтобы лишний раз не колоть ребенка ), печеночные и почечные тесты (биохимия по крови из вены), общий ан мочи.
_________________________________________________________________________________________________
симптомы и лечение, последствия и осложнения цитомегаловируса у детей
Цитомегаловирусная инфекция у детей: при чем здесь герпес?
Говоря о цитомегаловирусной инфекции у детей, мы возвращаемся к теме герпеса и тех опасностей, которые представляет этот вирус для здоровья ребенка. По сути своей цитомегаловирус является одной из разновидностью вируса герпеса, и упоминание о нем встречается в медицинских картах ничуть не реже, чем упоминание о вирусе простого герпеса.
Ученые-медики убеждены: все люди на Земле (за исключением, пожалуй, лишь тех, кто проживает свою жизнь, подобно Робинзону, в абсолютной изоляции от других людей) инфицированы цитомегаловирусом. Разница лишь в том, что большая часть населения заражается им еще в детстве, а остальные — уже в зрелом возрасте, но не позднее 40-45 лет.
Подобно вирусу простого герпеса, цитомегаловирус так же проникает внутрь клеток ребенка при первом же инфицировании и остается там на всю жизнь, по большей части пребывая в «спящем» неактивном состоянии. И если человек с раннего детства ведет здоровый образ жизни, избегает стрессовых ситуаций, следит за своим питанием и здоровьем (по началу, естественно, с подачи своих разумных родителей), поддерживая тем самым свой иммунитет в постоянной «боевой готовности», то цитомегаловирус в его организме может «спать» бесконечно долго…
Как происходит заражение цитомегаловирусной инфекцией
От человека к человеку цитомегаловирус передается контактным путем. И поскольку он содержится в любых выделениях человеческого тела (в слюне, поте, крови, мокроте, кале, моче, сперме и в женском молоке) — шансов заразиться великое множество. Но все они носят приобретенный характер и не считаются опасными для здоровья ребенка.
Как у взрослых, так и у детей (обычно уже в возрасте нескольких месяцев и старше) инфицирование приобретенным цитомегаловирусом происходит практически бессимптомно. И не грозит никаким серьезным уроном для здоровья.
Однако, дети могут заразиться не только в первые годы или в первые месяцы жизни. Но и немного раньше! И вот в этом случае инфекция может обернуться трагедией…
Мы упоминали, что цитомегаловирус у детей может быть приобретенным — и в этом случае он практически не представляет никакой опасности здоровью малыша. Но также цитомегаловирус у детей может быть и врожденным (когда инфицирование ребенка происходит в утробе матери, в момент родов, либо в первые дни после родов). И вот в этом случае цитомегаловирусная инфекция может нанести здоровью ребенка непоправимый вред.
Для каких детей цитомегаловирус наиболее опасен?
Существует три категории детей, для которых цитомегаловирусная инфекция представляет серьезную угрозу. К этим категориям относятся:
- еще нерожденные дети, заражение которых происходит в период внутриутробного развития через плаценту;
- новорожденные дети, у которых иммунная система еще слаба и нестабильна;
- дети любого возраста с сильно ослабленным иммунитетом или с полным его отсутствием (например, на фоне СПИДа).
При врожденном заражении цитомегаловирусом существует реальный риск поражения ребенка — с высокой долей вероятности могут возникнуть пороки развития малыша, серьезные нарушения в его нервной системе, в системе пищеварения, в сердечно-сосудистой и опорно-двигательной системах, а также возможны необратимые поражения органов слуха и зрения.
Причем «подхватить» опасный для младенца цитомегаловирус малыш может не только в период внутриутробного развития, но и при родах (контактируя с выделениями в родовых путях), а также сразу же после рождения — при кормлении грудным молоком матери.
Диагностика цитомегаловирусной инфекции у детей происходит путем лабораторного анализа, который можно провести несколькими способами. В России на сегодняшний день наиболее рапространен так назывемый метод ИФА — иммунноферментный анализ. Причем важно выяснить не только наличие вируса в организме, но и определить его форму — врожденный он, или приобретенный.
Когда цитомегаловирусная инфекция развивается у детей в период новорожденности, то в этом случае ее симптомы обычно схожи с симптомами инфекционного мононуклеоза — страдает лимфоидная ткань, что может выражаться в увеличении лимфоузлов, воспалении миндалин, увеличении в размерах печени и селезенки, затрудненном дыхании. Также среди симптомов врожденной цитомегаловирусной инфекции нередко встречаются:
А если малышу трудно дышать носом, естественным образом к симптомам добавляются также:
- потеря аппетита и снижение веса;
- отсутствие спокойного сна;
- плач и беспокойство.
Медицинская помощь, хирургическая помощь, консультации
Schleiss MR. Стойкие и повторяющиеся вирусные инфекции: вирусы герпеса человека. Curr Probl Pediatr Adolesc Health Care . 2009 Январь 39 (1): 7-23. [Медлайн].
Soderberg-Naucler C. Играет ли цитомегаловирус причинную роль в развитии различных воспалительных заболеваний и рака ?. Дж. Интерн Мед. . 2006 Март 259 (3): 219-46. [Медлайн].
Goodpasture EQ, Talbot FB.Относительно природы «простейших» клеток при некоторых поражениях младенческого возраста. Ам Дж. Дис Детский . 1921. 21: 415.
Веллер TH, Hanshaw JB. Вирусологические и клинические наблюдения цитомегалической инклюзионной болезни. N Engl J Med . 1962, 14 июня. 266: 1233-44. [Медлайн].
Веллер ТН. Цитомегаловирусы: повсеместные агенты с разнообразными клиническими проявлениями. I. N Engl J Med . 1971, 22 июля. 285 (4): 203-14.[Медлайн].
Schleiss MR, McVoy MA. Обзор врожденных и перинатально приобретенных цитомегаловирусных инфекций: последние достижения в противовирусной терапии. Expert Rev Anti Infect Ther . 2004 Июнь 2 (3): 389-403. [Медлайн].
Sung H, Schleiss MR. Обновленная информация о текущем статусе цитомегаловирусных вакцин. Вакцины Эксперт Рев . 2010 ноябрь 9 (11): 1303-14. [Медлайн].
Schleiss MR. Врожденная цитомегаловирусная инфекция: молекулярные механизмы, опосредующие вирусный патогенез. Лекарство от инфекционного расстройства нацелено на . 2011 октября, 11 (5): 449-65. [Медлайн].
Kimberlin DW, Lin CY, Sanchez PJ и др. Влияние терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. J Педиатр . 2003 июл. 143 (1): 16-25. [Медлайн].
Ван Д., Шенк Т. Белковый комплекс вириона цитомегаловируса человека, необходимый для тропизма эпителиальных и эндотелиальных клеток. Proc Natl Acad Sci U S A . 2005 13 декабря. 102 (50): 18153-8. [Медлайн].
Рикман Б.Дж., Джарвис М.А., Драммонд Д.Д., Нельсон Д.А., Джонсон, округ Колумбия. Проникновение цитомегаловируса человека в эпителиальные и эндотелиальные клетки зависит от генов UL128 — UL150 и происходит путем эндоцитоза и слияния с низким pH. Дж Вирол . 2006 Январь 80 (2): 710-22. [Медлайн].
Sylwester AW, Mitchell BL, Edgar JB, Taormina C, Pelte C, Ruchti F. Т-клетки CD4 + и CD8 +, специфичные для человеческого цитомегаловируса, доминируют в компартментах памяти подвергшихся воздействию субъектов. J Exp Med . 2005 Сен 5. 202 (5): 673-85. [Медлайн].
Уолтер Э.А., Гринберг П.Д., Гилберт М.Дж., Финч Р.Дж., Ватанабе К.С., Томас Э.Д. Восстановление клеточного иммунитета против цитомегаловируса у реципиентов аллогенного костного мозга путем переноса клонов Т-клеток от донора. N Engl J Med . 1995 Октябрь 19, 333 (16): 1038-44. [Медлайн].
Миллер-Киттрелл M, Запасной TE. Чувство манипулирования: иммунные манипуляции с цитомегаловирусом. Вирол J . 2009 9 января. 6: 4. [Медлайн]. [Полный текст].
Schleiss MR. Можем ли мы построить его лучше? Использование генетики BAC для создания более эффективных вакцин против цитомегаловируса. Дж. Клин Инвест . 2010 декабрь 120 (12): 4192-7. [Медлайн].
Хо М. Эпидемиология цитомегаловирусных инфекций. Ред. Заразить Dis . 1990 сентябрь-октябрь. 12 Приложение 7: S701-10. [Медлайн].
Кеннесон А., Кэннон М.Дж. Обзор и метаанализ эпидемиологии врожденной цитомегаловирусной (ЦМВ) инфекции. Rev Med Virol . 2007 июль-август. 17 (4): 253-76. [Медлайн].
Дар Л., Пати С.К., Патро А.Р. и др. Врожденная цитомегаловирусная инфекция у высокосеропозитивного полугородского населения в Индии. Pediatr Infect Dis J . 2008 Сентябрь 27 (9): 841-3. [Медлайн].
Боппана С.Б., Росс С.А., Новак З., Шимамура М., Толан Р.В. мл., Палмер А.Л. Анализ сухих пятен крови в режиме реального времени с помощью полимеразной цепной реакции для скрининга новорожденных на врожденную цитомегаловирусную инфекцию. JAMA . 14 апреля 2010 г. 303 (14): 1375-82. [Медлайн].
Dworsky M, Yow M, Stagno S, Pass RF, Alford C. Цитомегаловирусная инфекция грудного молока и передача в младенчестве. Педиатрия . 1983 Сентябрь 72 (3): 295-9. [Медлайн].
Hamele M, Flanagan R, Loomis CA, Stevens T, Fairchok MP. Высокая заболеваемость и смертность от цитомегаловирусной инфекции, связанной с грудным молоком. Pediatr Infect Dis J . 2010 29 января (1): 84-6.[Медлайн].
Bate SL, Dollard SC, Cannon MJ. Распространенность цитомегаловируса по серологии в Соединенных Штатах: национальные обследования здоровья и питания, 1988-2004 гг. Clin Infect Dis . 1 июня 2010 г. 50 (11): 1439-47. [Медлайн].
Пушка MJ, Schmid DS, Hyde TB. Обзор серологической распространенности цитомегаловируса и демографических характеристик, связанных с инфекцией. Rev Med Virol . 2010 июл.20 (4): 202-13. [Медлайн].
Adler SP, Starr SE, Plotkin SA, Hempfling SH, Buis J, Manning ML.Иммунитет, вызванный первичной цитомегаловирусной инфекцией человека, защищает женщин детородного возраста от вторичной инфекции. J Заразить Dis . 1995 Январь 171 (1): 26-32. [Медлайн].
Фаулер КБ, Пасс РФ. Факторы риска врожденной цитомегаловирусной инфекции у потомков молодых женщин: контакт с маленькими детьми и недавнее начало половой жизни. Педиатрия . 2006 августа 118 (2): e286-92. [Медлайн].
[Рекомендации] Каплан Дж. Э., Мазур Х., Холмс К. К..Руководство по профилактике оппортунистических инфекций среди ВИЧ-инфицированных — 2002 г. Рекомендации Службы общественного здравоохранения США и Американского общества инфекционистов. MMWR Recomm Rep . 2002, 14 июня. 51: 1-52. [Медлайн].
Colugnati FA, Staras SA, Dollard SC, Cannon MJ. Заболеваемость цитомегаловирусной инфекцией среди населения в целом и беременных женщин в США. BMC Infect Dis . 2 июля 2007 г. 7:71. [Медлайн]. [Полный текст].
Schleiss MR. Цитомегаловирусные вакцины и способы производства (WO2000
38): растущее признание важности нейтрализации вируса на эпителиально-эндотелиальном интерфейсе. Мнение эксперта Ther Pat . 2010 апр.20 (4): 597-602. [Медлайн].
долларов США, Гросс С.Д., Росс Д.С. Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанных с врожденной цитомегаловирусной инфекцией. Rev Med Virol . 2007 сентябрь-октябрь. 17 (5): 355-63. [Медлайн].
Бейл Дж.Ф., Майнер Л., Петерам С.Дж. Врожденная цитомегаловирусная инфекция. Варианты лечения Curr Neurol . 2002 май. 4 (3): 225-230. [Медлайн].
Cheeran MC, Lokensgard JR, Schleiss MR. Нейропатогенез врожденной цитомегаловирусной инфекции: механизмы заболевания и перспективы вмешательства. Clin Microbiol Ред. . 2009 22 января (1): 99-126, Содержание.[Медлайн].
Уильямсон В.Д., Деммлер Г.Дж., Перси А.К., Кэтлин Ф.И. Прогрессирующая потеря слуха у младенцев с бессимптомной врожденной цитомегаловирусной инфекцией. Педиатрия . 1992 Декабрь 90 (6): 862-6. [Медлайн].
Fowler KB, McCollister FP, Dahle AJ, Boppana S, Britt WJ, Pass RF. Прогрессирующая и колеблющаяся нейросенсорная тугоухость у детей с бессимптомной врожденной цитомегаловирусной инфекцией. J Педиатр . 1997 апр.130 (4): 624-30. [Медлайн].
Foulon I, Naessens A, Foulon W, Casteels A, Gordts F. 10-летнее проспективное исследование нейросенсорной тугоухости у детей с врожденной цитомегаловирусной инфекцией. J Педиатр . 2008 Июль 153 (1): 84-8. [Медлайн].
Torpy JM, Burke AE, Glass RM. Страница пациента JAMA. Цитомегаловирус. JAMA . 14 апреля 2010 г. 303 (14): 1440. [Медлайн].
Пушка М.Дж., Дэвис К.Ф.Мытье рук эпидемии врожденного цитомегаловирусного заболевания. BMC Public Health . 2005. 5:70. [Медлайн].
Fowler KB, Dahle AJ, Boppana SB, Pass RF. Скрининг слуха новорожденных: будут ли пропущены дети с потерей слуха, вызванной врожденной цитомегаловирусной инфекцией? J Педиатр . 1999 Июль 135 (1): 60-4. [Медлайн].
Horwitz CA, Henle W., Henle G, et al. Клиническая и лабораторная оценка мононуклеоза, вызванного цитомегаловирусом, у ранее здоровых людей.Отчет о 82 случаях. Медицина (Балтимор) . 1986 марта 65 (2): 124-34. [Медлайн].
Бартон Л.Л., Мец МБ. Врожденная инфекция, вызванная вирусом лимфоцитарного хориоменингита: десятилетие повторного открытия. Clin Infect Dis . 2001 г., 1 августа. 33 (3): 370-4. [Медлайн].
Гливс К.А., Смит Т.Ф., Шустер Е.А., Пирсон Г.Р. Сравнение стандартных методов культивирования клеток в пробирках и оболочках для выявления цитомегаловируса в клинических образцах. Дж. Клин Микробиол . 1985, 21 февраля (2): 217-21. [Медлайн]. [Полный текст].
Demmler GJ, Buffone GJ, Schimbor CM, May RA. Обнаружение цитомегаловируса в моче новорожденных с помощью амплификации ДНК с помощью полимеразной цепной реакции. J Заразить Dis . 1988 Декабрь 158 (6): 1177-84. [Медлайн].
Ljungman P, Hakki M, Boeckh M. Цитомегаловирус у реципиентов трансплантата гемопоэтических стволовых клеток. Гематол Онкол Клин Норт Ам .2011 25 февраля (1): 151-69. [Медлайн].
Razonable RR. Цитомегаловирусная инфекция после трансплантации печени: современные концепции и проблемы. Мир Дж. Гастроэнтерол . 2008 21 августа. 14 (31): 4849-60. [Медлайн].
Боппана С.Б., Росс С.А., Новак З., Шимамура М., Толан Р.В. мл., Палмер А.Л. Анализ сухих пятен крови в режиме реального времени с помощью полимеразной цепной реакции для скрининга новорожденных на врожденную цитомегаловирусную инфекцию. JAMA . 2010 г. 14 апреля.303 (14): 1375-82. [Медлайн].
Pass RF, Zhang C, Evans A, et al. Вакцинная профилактика материнской цитомегаловирусной инфекции. N Engl J Med . 2009 19 марта. 360 (12): 1191-9. [Медлайн]. [Полный текст].
Гриффитс П.Д., Стэнтон А., Маккаррелл Э., Смит С., Осман М., Харбер М. Цитомегаловирусная гликопротеин-В-вакцина с адъювантом MF59 у реципиентов трансплантата: рандомизированное плацебо-контролируемое испытание 2 фазы. Ланцет . 2011 г. 9 апреля.377 (9773): 1256-63. [Медлайн].
Джозефсон С.Д., Калиендо А.М., Исли К.А., Кнежевич А., Шенви Н., Хинкес М.Т. и др. Переливание крови и передача цитомегаловируса грудному молоку у младенцев с очень низкой массой тела при рождении: проспективное когортное исследование. JAMA Pediatr . 2014 ноябрь 168 (11): 1054-62. [Медлайн].
Kharfan-Dabaja MA, Boeckh M, Wilck MB, Langston AA, Chu AH, Wloch MK. Новая терапевтическая ДНК-вакцина против цитомегаловируса при аллогенной трансплантации гемопоэтических стволовых клеток: рандомизированное, двойное слепое, плацебо-контролируемое испытание фазы 2. Ланцет Infect Dis . 2012 Апрель 12 (4): 290-9. [Медлайн].
Адлер СП. Цитомегаловирус и детский сад. Доказательства повышенного уровня инфицирования среди работников дневного ухода. N Engl J Med . 1989, 9 ноября. 321 (19): 1290-6. [Медлайн].
Boppana SB, Rivera LB, Fowler KB, Mach M, Britt WJ. Внутриутробная передача цитомегаловируса младенцам от женщин с преконцептивным иммунитетом. N Engl J Med . 2001 г. 3 мая.344 (18): 1366-71. [Медлайн].
Gunkel J, de Vries LS, Jongmans M, Koopman-Esseboom C, van Haastert IC, Eijsermans MCJ, et al. Исход недоношенных детей с постнатальной цитомегаловирусной инфекцией. Педиатрия . 2018 г., 141 (2): [Medline].
Schleiss M, Stanberry L. Герпесвирусные инфекции ЦНС новорожденных: сходства и различия между HSV и CMV. Герпес . 1997. 4:74.
Schleiss MR.Перспективы разработки и потенциальное влияние вакцины против врожденной цитомегаловирусной (ЦМВ) инфекции. J Педиатр . 2007 декабрь 151 (6): 564-70. [Медлайн].
Табата Т., МакДонаг С., Кавакацу Х., Перейра Л. Цитотрофобласты, инфицированные патогенным штаммом цитомегаловируса человека, нарушают регуляцию молекул клеточного матрикса и межклеточной адгезии: количественный анализ. Плацента . 2007 май-июнь. 28 (5-6): 527-37. [Медлайн].
Zhang C, Buchanan H, Andrews W, Evans A, Pass RF.Выявление цитомегаловирусной инфекции во время клинических испытаний вакцины у здоровых молодых женщин: сероконверсия и выделение вируса. Дж. Клин Вирол . 2006 марта, 35 (3): 338-42. [Медлайн].
Цитомегаловирусная (ЦМВ) инфекция — Диагностика и лечение
Диагноз
Лабораторные тесты, включая анализы крови и других биологических жидкостей или анализы образцов тканей, могут обнаружить CMV .
Во время беременности и после родов
Если вы беременны, может быть важно пройти тестирование, чтобы определить, были ли вы когда-либо инфицированы CMV .Беременные женщины, у которых уже развились антитела CMV и , имеют очень небольшую вероятность реактивации заражения их нерожденных детей.
Если ваш врач обнаружит новую инфекцию CMV во время беременности, пренатальный тест (амниоцентез) может определить, инфицирован ли плод. В этом тесте ваш врач берет и исследует образец околоплодных вод. Амниоцентез обычно рекомендуется, когда на УЗИ видны аномалии, которые могут быть вызваны CMV .
Если ваш врач подозревает, что у вашего ребенка врожденный CMV , важно проверить ребенка в течение первых трех недель после рождения. Если у вашего ребенка CMV , ваш врач, вероятно, порекомендует дополнительные тесты для проверки здоровья органов ребенка, таких как печень и почки.
Для людей с ослабленным иммунитетом
Тестирование на CMV также может быть важно, если у вас ослабленная иммунная система.Например, если у вас ВИЧ или СПИД, или если вам сделали трансплантацию, ваш врач может захотеть регулярно наблюдать за вами.
Лечение
Как правило, здоровым детям и взрослым в лечении не требуется. Здоровые взрослые, у которых развивается мононуклеоз CMV , обычно выздоравливают без лекарств.
Новорожденные и люди с ослабленным иммунитетом нуждаются в лечении при появлении симптомов инфекции CMV . Тип лечения зависит от признаков и симптомов и их степени тяжести.
Противовирусные препараты — наиболее распространенный вид лечения. Они могут замедлить размножение вируса, но не могут его устранить. Исследователи изучают новые лекарства и вакцины для лечения и профилактики CMV .
Клинические испытания
Изучите исследования клиники Mayo Clinic, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или контроля этого состояния.
Подготовка к приему
Вот некоторая информация, которая поможет вам подготовиться к приему.
Что вы можете сделать
Перед приемом выполните следующие действия:
- Запишите все симптомы, которые испытываете вы или ваш ребенок. Укажите признаки и симптомы, даже если они кажутся незначительными, например субфебрильная температура или слабость.
- Запишите вопросы, которые можно задать своему врачу.Ваше время с врачом ограничено, поэтому может быть полезно подготовить список вопросов.
Для CMV вопросы, которые следует задать своему врачу, включают:
- Что, вероятно, вызывает мои симптомы?
- Какие тесты мне нужны?
- Является ли мое состояние временным или хроническим?
- Как лучше всего действовать?
- Могу ли я заразить других?
- Есть ли какие-то ограничения, которые мне нужно соблюдать?
- У меня другие проблемы со здоровьем.Как мне лучше всего управлять ими вместе?
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов, в том числе:
- Как давно у вас есть симптомы?
- Вы работаете или живете с маленькими детьми?
- Вам недавно делали переливание крови или трансплантацию органов, костного мозга или стволовых клеток?
- Есть ли у вас заболевание, которое может ослабить вашу иммунную систему, например, ВИЧ или СПИД?
- Вы получаете химиотерапию?
- Практикуете ли вы безопасный секс?
- Вы беременны или кормите грудью?
Кроме того, если вы считаете, что подверглись воздействию во время беременности:
- Как вы думаете, когда вы могли подвергнуться разоблачению?
- Были ли у вас симптомы этого состояния?
- Проверялись ли вы раньше на CMV ?
Лечение | CMV Action
Лечение младенцев и детей, пораженных врожденным цитомегаловирусом, будет зависеть от многих факторов, включая наличие у них симптомов при рождении, их серьезность и время постановки диагноза.
В этом разделе описывается лечение, доступное в настоящее время для детей, у которых диагностирован диагноз в первые несколько недель жизни, включая преимущества и риски этого лечения.
Есть ли лечение врожденного ЦМВ?
Противовирусные препараты, такие как ганцикловир и валганцикловир, можно использовать для лечения детей с симптомами врожденного ЦМВ. Ганцикловир вводится внутривенно (в вену через «капельницу») и будет лекарством, используемым для младенцев, которые не могут принимать все пищу через рот, например, у недоношенных детей.Валганцикловир можно принимать внутрь, и его можно использовать для детей, которые кормятся нормально. Варианты лечения следует тщательно обсудить с врачом вашего ребенка и подобрать индивидуально в соответствии с потребностями вашего ребенка.
Когда следует использовать противовирусное лечение?
Противовирусное лечение рекомендуется для младенцев, если инфекция ЦМВ затронула центральную нервную систему, включая их слух, или значительно повлияла на другие органы. Лечение следует начинать в возрасте до четырех недель. Цель противовирусного лечения — уменьшить количество активного вируса, чтобы ребенок мог контролировать инфекцию с помощью собственной иммунной системы.
Следует ли лечить бессимптомных детей?
Большинство детей, рожденных с врожденным ЦМВ, протекает бессимптомно и не проявляет никаких симптомов при рождении. Однако к пяти годам у 15% людей может развиться потеря слуха. Обычно это поражает только одно ухо, но может поражать оба уха.
Противовирусное лечение бессимптомных новорожденных не рекомендуется, поскольку невозможно точно предсказать, у каких детей разовьется потеря слуха. В настоящее время нет доказательств того, что противовирусное лечение приносит пользу детям, у которых в более позднем возрасте развивается потеря слуха.Однако в настоящее время проводится исследование, чтобы лучше понять это.
Каковы преимущества противовирусного лечения?
Антивирусное лечение может помочь предотвратить потерю слуха или остановить его ухудшение, а также улучшить развитие общения. Эти преимущества наблюдались у двухлетних детей, центральная нервная система которых (головной и спинной мозг) уже была затронута ЦМВ, когда им был поставлен диагноз. В недавнем исследовании была отмечена небольшая положительная польза у младенцев, получавших шестимесячный курс лечения валганцикловиром, по сравнению с шестинедельным лечением.
Каковы риски противовирусного лечения?
Наиболее частым побочным эффектом противовирусного лечения является уменьшение количества лейкоцитов, которые помогают бороться с инфекцией. Примерно каждый пятый ребенок испытывает этот побочный эффект, чаще всего в первые несколько недель после начала противовирусного лечения. Реже противовирусное лечение может вызвать снижение количества тромбоцитов в крови (клеток, которые помогают свертыванию крови). В некоторых случаях также может поражаться печень.Анализы крови необходимы для тщательного наблюдения за кровяными тельцами и функцией печени. Если эти побочные эффекты действительно возникают, возможно, придется на время прекратить прием противовирусных препаратов.
Решение о начале противовирусного лечения непросто. Потенциальные преимущества лечения необходимо учитывать наряду с потенциальными побочными эффектами лечения. Важно, чтобы у вас была возможность обсудить варианты противовирусного лечения и продолжительность лечения с врачом, имеющим опыт лечения детей с врожденным ЦМВ, например, детским инфекционистом.
Врожденная цитомегаловирусная инфекция: достижения и проблемы в диагностике, профилактике и лечении | Итальянский педиатрический журнал
Kenneson A, Cannon MJ. Обзор и метаанализ эпидемиологии врожденной цитомегаловирусной (ЦМВ) инфекции. Rev Med Virol. 2007. 17: 253–76.
Артикул PubMed Google Scholar
долларов SC, Гросс С.Д., Росс Д.С.Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанных с врожденной цитомегаловирусной инфекцией. Rev Med Virol. 2007; 17: 355–63.
Артикул PubMed Google Scholar
Гросс С.Д., Росс Д.С., Доллард СК. Врожденная цитомегаловирусная (ЦМВ) инфекция как причина стойкой двусторонней потери слуха: количественная оценка. J Clin Virol. 2008. 41: 57–62.
Артикул PubMed Google Scholar
Боппана С.Б., Фаулер КБ. Стойкость в популяции: эпидемиология и передача. В: Арвин А., Кампаделли-Фьюме Дж., Мокарски Е., Мур П.С., Ройзман Б., Уитли Р., Яманиши К., редакторы. Герпесвирусы человека: биология, терапия и иммунопрофилактика. Кембридж: Издательство Кембриджского университета; 2007. с. 795–813. Глава 44.
Google Scholar
Manicklal S, Emery VC, Lazzarotto T, Boppana SB, Gupta RK. «Тихое» глобальное бремя врожденного цитомегаловируса.Clin Microbiol Rev.2013; 26: 86–102.
CAS Статья PubMed PubMed Central Google Scholar
Cannon MJ, Schmid DS, Hyde TB. Обзор серологической распространенности цитомегаловируса и демографических характеристик, связанных с инфекцией. Rev Med Virol. 2010; 20: 202–13.
Артикул PubMed Google Scholar
Bate SL, Dollard SC, Cannon MJ.Распространенность цитомегаловируса по серологии в Соединенных Штатах: национальные обследования здоровья и питания, 1988-2004 гг. Clin Infect Dis. 2010; 50: 1439–47.
Артикул PubMed Google Scholar
Boppana SB, Rivera LB, Fowler KB, Mach M, Britt WJ. Внутриутробная передача цитомегаловируса младенцам от женщин с преконцептивным иммунитетом. N Engl J Med. 2001; 344: 1366–71.
CAS Статья PubMed Google Scholar
Орной А., Диав-Цитрин О. Влияние первичной и вторичной цитомегаловирусной инфекции на плод во время беременности. Reprod Toxicol. 2006; 21: 399–409.
CAS Статья PubMed Google Scholar
Ван С., Чжан Х, Биалек С., Кэннон МДж. Отнесение врожденной цитомегаловирусной инфекции к первичной по сравнению с непервичной материнской инфекцией. Clin Infect Dis. 2011; 52: 11–3.
Артикул Google Scholar
Bodéus M, Hubinont C, Goubau P. Повышенный риск передачи цитомегаловируса в утробе матери на поздних сроках беременности. Obstet Gynecol. 1999; 93: 658–60.
PubMed Google Scholar
Эндерс Г., Даймингер А., Бадер У, Экслер С., Эндерс М. Внутриутробная передача и клинические исходы 248 беременностей с первичной цитомегаловирусной инфекцией в зависимости от гестационного возраста. J Clin Virol. 2011; 52: 244–6.
Артикул PubMed Google Scholar
Pass RF, Fowler KB, Boppana SB, Britt WJ, Stagno S. Врожденная цитомегаловирусная инфекция после инфицирования матери в первом триместре: симптомы при рождении и исход. J Clin Virol. 2006; 35: 216–20.
Артикул PubMed Google Scholar
Foulon I, Naessens A, Foulon W., Casteels A, Gordts F. Потеря слуха у детей с врожденной цитомегаловирусной инфекцией по сравнению с триместром беременности, в котором произошла первичная инфекция матери.Педиатрия. 2008; 122: 1123–7.
Артикул Google Scholar
de Vries JJ, Vossen AC, Kroes AC, van der Zeijst BA. Осуществление неонатального скрининга на врожденный цитомегаловирус: решение проблемы глухоты политиков. Rev Med Virol. 2011; 21: 54–61.
Артикул PubMed Google Scholar
Дреер А.М., Арора Н., Фаулер К.Б., Новак З., Бритт В., Боппана С.Б. и др.Спектр заболевания и исходы у детей с симптоматической врожденной цитомегаловирусной инфекцией. J Pediatr. 2014; 164: 855–9.
Артикул PubMed PubMed Central Google Scholar
Боппана С.Б., Росс С.А., Фаулер КБ. Врожденная цитомегаловирусная инфекция: клинические исходы. Clin Infect Dis. 2013; 57 Дополнение 4: 178–81.
Артикул Google Scholar
Fowler KB, McCollister FP, Sabo DL, Shoup AG, Owen KE, Woodruff JL и др .; КОЛОКОЛЫ Исследование. Целевой подход к скринингу на врожденный цитомегаловирус в рамках скрининга слуха новорожденных. Педиатрия. 2017; 139; DOI: 10.1542 / peds.2016-2128.
Kimberlin DW, Jester PM, Sánchez PJ, Ahmed A, Arav-Boger R, Michaels MG, et al. Национальная группа по изучению противовирусных препаратов Национального института аллергии и инфекционных заболеваний. Валганцикловир при симптоматическом врожденном цитомегаловирусном заболевании.N Engl J Med. 2015; 372: 933–43.
CAS Статья PubMed PubMed Central Google Scholar
Дале А.Дж., Фаулер КБ, Райт Д.Д., Боппана С.Б., Бритт В.Дж., Пасс РФ. Продольное исследование нарушений слуха у детей с врожденным цитомегаловирусом. J Am Acad Audiol. 2000; 11: 283–90.
CAS PubMed Google Scholar
Американская академия педиатрии, Объединенный комитет по детскому слуху.Заявление о позиции на 2007 год: Принципы и рекомендации по раннему обнаружению слуха и программам вмешательства. Педиатрия. 2007; 120: 898–921.
Артикул Google Scholar
Йошинага-Итано К. Раннее вмешательство после всеобщего неонатального скрининга слуха: влияние на результаты. Ment Retard Dev Disabil Res Rev.2003; 9: 252–66.
Артикул PubMed Google Scholar
Morton CC, Nance WE. Скрининг слуха новорожденных — тихая революция. N Engl J Med. 2006; 354: 2151–64.
CAS Статья PubMed Google Scholar
Бернар С., Винер-Вашер С., Ван ден Аббеле Т., Тейсье Н. Вестибулярные нарушения у детей с врожденной цитомегаловирусной инфекцией. Педиатрия. 2015; 136: 887–95.
Артикул Google Scholar
Coats DK, Demmler GJ, Paysse EA, Du LT, Libby C. Офтальмологические данные у детей с врожденной цитомегаловирусной инфекцией. J AAPOS. 2000. 4: 110–6.
CAS Статья PubMed Google Scholar
Страттон К.Р., Дарч Дж. С., Лоуренс Р.С., Редакционный комитет по изучению приоритетов разработки вакцин, Отдел укрепления здоровья и профилактики заболеваний Институт медицины. Вакцины для 21 века: инструмент для принятия решений.Вашингтон: Национальная академия прессы; 2000.
Boppana SB, Ross SA, Novak Z, Shimamura M, Tolan Jr RW, Palmer AL, Национальный институт глухоты и других коммуникативных расстройств Исследование CMV и многоцентрового скрининга слуха (CHIMES) и др. Анализ сухих пятен крови в режиме реального времени с помощью полимеразной цепной реакции для скрининга новорожденных на врожденную цитомегаловирусную инфекцию. ДЖАМА. 2010; 303: 1375–82.
CAS Статья PubMed PubMed Central Google Scholar
Боппана С.Б., Росс С.А., Шимамура М., Палмер А.Л., Ахмед А., Майклс М.Г., Национальный институт глухоты и других коммуникативных расстройств, исследование CHIMES, et al. Полимеразно-цепная реакция слюны для скрининга на цитомегаловирус у новорожденных. N Engl J Med. 2011; 364: 2111–8.
CAS Статья PubMed PubMed Central Google Scholar
Барби М., Бинда С., Примач В., Лураски К., Корбетта С. Диагностика врожденной цитомегаловирусной инфекции путем обнаружения вирусной ДНК в сухих пятнах крови.Clin Diagn Virol. 1996; 6: 27–32.
CAS Статья PubMed Google Scholar
Йоханссон П.Дж., Йонссон М., Альфорс К., Иварссон С.А., Сванберг Л., Гутенберг С. Ретроспективная диагностика врожденной цитомегаловирусной инфекции с помощью полимеразной цепной реакции в крови, хранящейся на фильтровальной бумаге. Scand J Infect Dis. 1997. 29: 465–8.
CAS Статья PubMed Google Scholar
Ямамото А.Ю., Мусси-Пинхата М.М., Пинто П.С., Фигейредо Л.Т., Хорхе С.М. Полезность образцов крови и мочи, собранных на фильтровальной бумаге, для обнаружения цитомегаловируса методом полимеразной цепной реакции. J Virol Methods. 2001; 97: 159–64.
CAS Статья PubMed Google Scholar
de Vries JJ, Claas EC, Kroes AC, Vossen AC. Оценка методов выделения ДНК из сухих пятен крови в диагностике врожденной цитомегаловирусной инфекции.J Clin Virol. 2009; 46 Дополнение 4: 37–42.
Артикул Google Scholar
Leruez-Ville M, Vauloup-Fellous C, Couderc S, Parat S, Castel C, Avettand-Fenoel V, et al. Перспективная идентификация врожденной цитомегаловирусной инфекции у новорожденных с использованием анализа полимеразной цепной реакции в режиме реального времени в сухих пятнах крови. Clin Infect Dis. 2011; 52: 575–81.
CAS Статья PubMed Google Scholar
Kimberlin DW, Acosta EP, Sánchez PJ, Sood S, Agrawal V, Homans J, Национальный институт аллергии и инфекционных заболеваний, совместная группа по изучению противовирусных препаратов, et al. Фармакокинетическая и фармакодинамическая оценка перорального валганцикловира при лечении симптоматической врожденной цитомегаловирусной болезни. J Infect Dis. 2008; 197: 836–45.
CAS Статья PubMed Google Scholar
Rawlinson WD, Boppana SB, Fowler KB, Kimberlin DW, Lazzarotto T., Alain S, et al.Врожденная цитомегаловирусная инфекция у беременных и новорожденных: согласованные рекомендации по профилактике, диагностике и терапии. Lancet Infect Dis. 2017. DOI: 10.1016 / S1473-3099 (17) 30143-3.
Росс С.А., Ахмед А., Палмер А.Л., Майклс М.Г., Санчес П.Дж., Стюарт А. и др. Национальный институт глухоты и других коммуникативных расстройств, исследование CHIMES. Метод сбора мочи для диагностики врожденной цитомегаловирусной инфекции. Pediatr Infect Dis J. 2015; 34: 903–5.
Артикул PubMed PubMed Central Google Scholar
Кояно С., Иноуэ Н., Ока А., Мориучи Н., Асано К., Ито Ю. и др.; Японская группа по изучению врожденного цитомегаловируса. Скрининг на врожденную цитомегаловирусную инфекцию с использованием образцов мочи новорожденных, собранных на фильтровальной бумаге: осуществимость и результаты многоцентрового исследования. BMJ Open. 2011; DOI: 10.1136 / bmjopen-2011-000118.
Нигро Г., Адлер С.П., Ла Торре Р., Лучший АМ, Сотрудничающая группа по врожденному цитомегаловирусу. Пассивная иммунизация во время беременности от врожденной цитомегаловирусной инфекции.N Engl J Med. 2005; 353: 1350–62.
CAS Статья PubMed Google Scholar
Buxmann H, Stackelberg OM, Schlößer RL, Enders G, Gonser M, Meyer-Wittkopf MJ, et al. Использование цитомегаловирусного гипериммуноглобулина для профилактики врожденного цитомегаловирусного заболевания: ретроспективный анализ. Perinat Med. 2012; 40: 439–46.
Google Scholar
Visentin S, Manara R, Milanese L, Da Roit A, Forner G, Salviato E, et al.Ранняя первичная цитомегаловирусная инфекция во время беременности: терапия материнским гипериммуноглобулином улучшает исходы у младенцев в возрасте 1 года. Clin Infect Dis. 2012; 55: 497–503.
CAS Статья PubMed Google Scholar
Японская группа по изучению врожденной цитомегаловирусной инфекции иммуноглобулиновой терапии плода. Испытание иммуноглобулиновой терапии плода при симптоматической врожденной цитомегаловирусной инфекции. J Reprod Immunol.2012; 95: 73–9.
Google Scholar
Ревелло М.Г., Лаццаротто Т., Герра Б., Спинилло А., Феррацци Е., Кустерманн А., Исследовательская группа CHIP и др. Рандомизированное исследование гипериммунного глобулина для предотвращения врожденного цитомегаловируса. N Engl J Med. 2014; 370: 1316–26.
CAS Статья PubMed Google Scholar
Leruez-Ville M, Ghout I, Bussières L, Stirnemann J, Magny JF, Couderc S, et al.Внутриутробное лечение врожденной цитомегаловирусной инфекции валацикловиром в многоцентровом открытом исследовании II фазы. Am J Obstet Gynecol. 2016; DOI: 10.1016 / j.ajog.2016.04.003.
Schleiss MR. Цитомегаловирусные вакцины находятся в стадии клинической разработки. J Virus Erad. 2016; 2: 198–207.
PubMed PubMed Central Google Scholar
Pass RF, Zhang C, Evans A, Simpson T., Andrews W., Huang ML, et al.Вакцинная профилактика материнской цитомегаловирусной инфекции. N Engl J Med. 2009; 360: 1191–9.
CAS Статья PubMed PubMed Central Google Scholar
Sabbaj S, Pass RF, Goepfert PA, Pichon S. Вакцина с гликопротеином B способна стимулировать как антитела, так и Т-клеточные ответы CD4 на цитомегаловирус у хронически инфицированных женщин. J Infect Dis. 2011; 203: 1534–41.
CAS Статья PubMed PubMed Central Google Scholar
Schleiss MR, Bierle CJ, Swanson EC, McVoy MA, Wang JB, Al-Mahdi Z, et al. Вакцинация живым аттенуированным цитомегаловирусом, лишенным гена, ингибирующего протеинкиназу R, приводит к снижению материнской виремии и улучшению исхода беременности на модели врожденной инфекции морской свинки. J Virol. 2015; 89: 9727–38.
CAS Статья PubMed PubMed Central Google Scholar
Прайс SM, Bonilla E, Zador P, Levis DM, Kilgo CL, Cannon MJ.Информирование женщин о врожденном цитомегаловирусе: оценка материалов по санитарному просвещению с помощью интернет-опроса. BMC Womens Health. 2014; DOI: 10.1186 / s12905-014-0144-3.
Адлер С.П., Финни Дж. У., Манганелло А. М., Лучший АМ. Профилактика передачи цитомегаловируса от ребенка к матери путем изменения поведения: рандомизированное контролируемое исследование. Pediatr Infect Dis J. 1996; 15: 240–6.
CAS Статья PubMed Google Scholar
Vauloup-Fellous C, Picone O, Cordier AG, Parent-du-Châtelet I, Senat MV, Frydman R, et al. Влияет ли гигиеническое консультирование на частоту первичной инфекции ЦМВ во время беременности? Результаты трехлетнего проспективного исследования во французской больнице. J Clin Virol. 2009; 46 Дополнение 4: 49–53.
Артикул Google Scholar
Kimberlin DW, Lin CY, Sánchez PJ, Demmler GJ, Dankner W, Shelton M, Группа совместных противовирусных исследований Национального института аллергии и инфекционных заболеваний, et al.Влияние терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. J Pediatr. 2003. 143: 16–25.
CAS Статья PubMed Google Scholar
Бауэр П.В., Паризи-Робинсон М., Роланд П.С., Егаппан С. Цитомегаловирус в перилимфатической жидкости. Ларингоскоп. 2005; 115: 223–5.
Артикул PubMed Google Scholar
Rivera LB, Boppana SB, Fowler KB, Britt WJ, Stagno S, Pass RF. Предикторы потери слуха у детей с симптоматической врожденной цитомегаловирусной инфекцией. Педиатрия. 2002; 110: 762–7.
Артикул PubMed Google Scholar
Boppana SB, Fowler KB, Pass RF, Rivera LB, Bradford RD, Lakeman FD, et al. Врожденная цитомегаловирусная инфекция: связь между вирусной нагрузкой в младенчестве и потерей слуха. J Pediatr. 2005; 146: 817–23.
Артикул PubMed Google Scholar
Lanari M, Lazzarotto T, Venturi V, Papa I, Gabrielli L, Guerra B, et al. Кровяная нагрузка неонатального цитомегаловируса и риск осложнений у новорожденных с симптоматической и бессимптомной врожденной инфекцией. Педиатрия. 2006. 117: 76–83.
Артикул Google Scholar
Форнер Дж., Абате Д., Менголи К., Пале Дж., Гуссетти Н.ДНКемия с высоким содержанием цитомегаловируса (ЦМВ) позволяет прогнозировать последствия ЦМВ у бессимптомных врожденно инфицированных новорожденных, рожденных женщинами с первичной инфекцией во время беременности. J Infect Dis. 2015; 212: 67–71.
Артикул PubMed Google Scholar
Росс С.А., Новак З., Фаулер К.Б., Арора Н., Бритт В.Дж., Боппана С.Б. Цитомегаловирусная вирусная нагрузка крови и потеря слуха у детей раннего возраста с врожденной инфекцией. Pediatr Infect Dis J. 2009; 28: 588–92.
Артикул PubMed PubMed Central Google Scholar
Достижения в лечении цитомегаловируса | Британский медицинский бюллетень
Абстрактные
Предпосылки
Цитомегаловирус человека (HCMV) представляет угрозу для иммунологически слабых пациентов. Несмотря на недавние достижения, HCMV пока не может быть устранен с помощью вакцины.
Источники данных
Источниками данных являются недавно опубликованные исследовательские работы и обзоры о лечении HCMV.
Области согласия
Современные противовирусные препараты нацелены на ДНК-полимеразу UL54 и ограничены нефротоксичностью и вирусной устойчивостью. Многообещающе, что летермовир нацелен на комплекс терминазы HCMV и недавно был одобрен FDA и EMA.
Спорные вопросы
Должны ли мы проводить скрининг новорожденных на ВГМВ и использовать противовирусные препараты для лечения нейросенсорной тугоухости после врожденной ВГМВ-инфекции?
Точки роста
Точки роста — это разработка лекарств против латентно инфицированных клеток.Помимо низкомолекулярных ингибиторов, слитный токсиновый белок на основе хемокинов, F49A-FTP, показал себя многообещающим в уничтожении как литически, так и латентно инфицированных клеток.
Своевременные области для развития исследований
Нам необходимо понять, какие иммунные ответы необходимы для контроля HCMV и как лучше всего повысить эти иммунные ответы с помощью вакцины.
Цитомегаловирус человека вызывает бессимптомную стойкую инфекцию у здоровых людей
Цитомегаловирус человека (HCMV) представляет собой большой ДНК-вирус подсемейства Betaherpesvirinae с геномом двухцепочечной ДНК приблизительно 230 т.п.н.Геном HCMV сложен и кодирует функциональные белки, микроРНК, длинные некодирующие РНК и небольшие пептиды. 1 , 2 Как и все герпесвирусы, HCMV сохраняется в течение всей жизни хозяина после первичной инфекции; эта стойкость, по крайней мере, частично поддерживается скрытой инфекцией, а также различными механизмами, позволяющими манипулировать иммунным ответом хозяина и уклоняться от него. 3
Лица со здоровым иммунным ответом обычно не проявляют никаких симптомов после первичной инфекции, но в редких случаях могут проявлять симптомы, подобные инфекционному мононуклеозу. 4 Очень редко тяжелые острые инфекции HCMV возникают у здоровых людей. Эти инфекции чаще всего связаны с симптоматическими инфекциями желудочно-кишечного тракта, печени и центральной нервной системы; гематологические проявления; и тромбоз глаз, легких, артериальной или венозной крови. 5 Этих пациентов лечат противовирусными препаратами, как правило, в индивидуальном порядке, аналогично пациентам с ослабленным иммунитетом, как обсуждается ниже. 5 Причины этих отдельных случаев тяжелых инфекций HCMV у иммунокомпетентных людей остаются неясными. 6
Инфекция HCMV обычно асимптотическая, потому что устойчивый здоровый иммунный ответ контролирует виремию. 4 Несмотря на это, HCMV не выводится из организма-хозяина, но сохраняется путем установления пожизненной латентной инфекции в недифференцированных клетках миелоидной линии (гематопоэтические клетки-предшественники CD34 + и их производные моноциты CD14 + ). Когда эти клетки выходят из костного мозга и дифференцируются в макрофаги и / или дендритные клетки, запускается реактивация вируса. 3 Эта спорадическая реактивация HCMV с латентного периода в дифференцированных миелоидных клетках также протекает бессимптомно у здоровых людей, но, вероятно, помогает пополнить запас латентно инфицированных клеток. 7 Такая спорадическая бессимптомная инфекция HCMV у здоровых серопозитивных людей была связана с повышенным уровнем атеросклероза, 8 артериальной гипертонией, 8 глиобластомой и другими видами рака (с большими противоречиями относительно того, является ли HCMV онкогенным или онкомодулирующим наблюдения являются просто артефактами) 9 , 10 и синдром Гийена – Барре, 11 , и такие условия сокращают общую продолжительность жизни у этих серопозитивных людей. 8 , 12
HCMV может быть опасным для жизни у пациентов с ослабленным иммунитетом, иммуносупрессивными и иммунологическими
Первичная инфекция HCMV, повторное инфицирование другим циркулирующим штаммом HCMV и реактивация из-за латентной инфекции представляют собой серьезную угрозу для лиц с ослабленным иммунитетом, иммуносупрессии и иммунитета. Возможность заражения HCMV многих различных тканей вызывает широкий спектр потенциальных симптомов, но в конечном итоге может произойти органная недостаточность, если противовирусные препараты HCMV не используются в качестве лечения. 13
HCMV у новорожденных
Врожденные инфекции HCMV (cCMVs) не всегда контролируются новорожденными с иммунитетом. Инфекция внутриутробно является обычным явлением (примерно 0,5% живорождений 14 ), и около 8–10% инфекций проявляются симптомами при рождении. 14 Эти случаи являются наиболее частой инфекционной причиной врожденных врожденных дефектов, которые в значительной степени влияют на продолжительность жизни с поправкой на инвалидность, связанную с HCMV 14 и, по оценкам, обошлись Великобритании в 723 миллиона фунтов стерлингов в 2016 году. 15 Хотя наибольший риск симптоматической врожденной инфекции HCMV наблюдается при первичном инфицировании серонегативных матерей в течение первого триместра беременности, новорожденные от серопозитивных матерей все еще подвержены риску из-за реактивации латентного вируса или повторного инфицирования другим HCMV. штамм (известный как суперинфекция). 16 В декабре 2017 года Национальный комитет Великобритании по скринингу не рекомендовал проводить скрининг всех новорожденных на HCMV с помощью теста слюны, 17 в основном потому, что в настоящее время невозможно провести скрининг детей с HCMV-инфекцией, которая приведет к долгосрочному проблемы со здоровьем, поэтому у большинства детей с положительным диагнозом HCMV не будет никаких симптомов (https: // legacyscreening.phe.org.uk/cytomegalovirus). Поскольку неясно, поможет ли скрининг исходам у бессимптомных детей, он не был рекомендован.
Симптомы cCMV включают цитомегалическую болезнь включения (гистопатологическое обнаружение телец включения в увеличенных, инфицированных HCMV клетках), задержку внутриутробного развития, желтуху и микроцефалию с задержкой развития, сенсоневральную тугоухость и значительную последующую смертность. 14 Выжившие могут страдать от множественной инвалидности из-за церебральной кальцификации с неврологическими, слуховыми и зрительными нарушениями. 18 Наиболее частым нарушением развития нервной системы, связанным с cCMV, является нейросенсорная потеря слуха, а cCMV является причиной до 15% нейросенсорной тугоухости в Великобритании. 17 cCMV у детей с умеренными или тяжелыми симптомами заболевания следует лечить валганцикловиром (VGCV, противовирусные препараты, которые будут обсуждаться позже) в течение первых 4 недель жизни на срок до 6 месяцев с мониторингом количества нейтрофилов и уровней трансаминаз. 15 , 19 , 20 Противовирусное лечение не рекомендуется при бессимптомной ЦМВ, инфекциях с легкими симптомами или изолированной нейросенсорной тугоухости, отчасти из-за отсутствия рандомизированных контрольных испытаний, дающих доказательства эффективности противовирусное лечение. 15 , 19 Частично для решения этой проблемы в настоящее время проводится рандомизированное контролируемое исследование по оценке преимуществ лечения детей старшего возраста с подтвержденной сенсоневральной тугоухостью и cCMV (ClinicalTrials.gov NCT01649869).
HCMV является основным осложняющим фактором для трансплантатов из-за иммуносупрессии
Иммуносупрессия после трансплантации органов подвергает пациентов риску HCMV. 21 Сюда входят пациенты, перенесшие трансплантацию твердых органов, а также трансплантаты костного мозга / гемопоэтических стволовых клеток; однако риск заболеваний, связанных с HCMV, различается между этими группами пациентов, и риск зависит от того, являются ли донор, реципиент или оба являются носителями HCMV.
Реципиенты трансплантата твердых органов (SOT), которые являются серонегативными (R-), подвергаются наибольшему риску заражения HCMV при получении органа от трупного серопозитивного донора (D +), вероятно, из-за переноса как литического, так и латентного вируса. пожертвованная ткань пациенту без предшествующего иммунитета против HCMV. 22 Серопозитивные реципиенты HCMV имеют средний риск заболевания, в то время как комбинация R- / D- имеет самый низкий риск (исходящий только от первичных инфекций HCMV). 23 Донорство трупных органов связано с повышенным риском HCMV, скорее всего, из-за повышенной иммуносупрессии, необходимой для донорства трупной ткани. 24 Как и болезнь HCMV, HCMV может быть связан с повышенным риском отторжения трансплантата, а также с общей заболеваемостью и смертностью. 25
Подобно реципиентам солидных органов, пациенты, получающие аллогенные трансплантаты гемопоэтических стволовых клеток (алло-ТГСК), также подвержены риску заболевания HCMV. Стволовые клетки пуповинной крови или стволовые клетки периферической крови, например, от доноров, мобилизованных с помощью G-CSF, в настоящее время являются наиболее распространенными источниками стволовых клеток для алло-HSCT и включают мультипотентные стволовые клетки CD34 + , которые расширяются и дифференцируются в восстановить иммунную систему.Эта клеточная дифференциация может вызвать реактивацию и распространение HCMV, поскольку латентно инфицированные клетки будут перенесены, если донор окажется HCMV-положительным. 3 Однако HCMV также может возникать в результате первичной инфекции и реактивации латентных вирусных резервуаров уже у реципиента R +. 26 Действительно, реактивация HCMV и распространение вируса могут происходить у 80% пациентов с алло-ТГСК, если распространение не лечить противовирусными препаратами. 27
Хотя лечение противовирусными препаратами HCMV, скрининг крови и подбор донора / реципиента на серостатус HCMV снизили частоту заболевания HCMV, HCMV по-прежнему остается значительной угрозой, особенно в более поздние сроки после трансплантации. 28 Соответствующий серостатус HCMV по-прежнему является золотым стандартом, но часто практически невозможно, поскольку он значительно сокращает пул потенциальных доноров органов и может потребовать совместного переноса Т-клеток (обсуждается ниже), что впоследствии увеличивает риск отторжения трансплантата и Заболевание HCMV. Учитывая это, вакцина для искоренения HCMV или методы лечения, которые могут удалить HCMV из инфицированных органов, несомненно, будут иметь клинические преимущества.
Приспособительный перенос Т-клеточного иммунитета против HCMV в трансплантатах гемопоэтических стволовых клеток
Для алло-HSCT, где донор является серопозитивным, донорские лимфоциты (которые будут содержать HCMV-специфические Т-клетки) также могут быть перенесены, чтобы помочь защитить реципиентов алло-HSCT от инфекции HCMV.Эти лимфоциты также могут играть роль в борьбе с другими условно-патогенными микроорганизмами, такими как аспергиллы. 29 Однако наличие Т-клеток в трансплантате также имеет недостаток, поскольку они увеличивают риск реакции «трансплантат против хозяина» (GVHD) 30 и, что усложняет это, сама GVHD коррелирует с заболеванием HCMV. 30
В идеале, преимущества адоптивного переноса Т-клеток против HCMV могли бы быть получены без риска РТПХ, если бы врач мог переносить только клоны донорских Т-клеток против HCMV без переноса Т-клеток, которые вызывали бы алло- признание, которое приводит к РТПХ.Адоптивный перенос специфических анти-HCMV CD8 + клонов Т-клеток эффективен 31 ; однако перенос этих клеток без хелперных Т-клеток CD4 + означает, что клоны CD8 + недолговечны. 31 Кроме того, выбор только небольшого набора моноклональных Т-клеток против HCMV создает риск выбора ускользающих мутаций, поэтому для защиты от HCMV клиницист в идеале перенесет широкие, поликлональные, анти-HCMV CD4 + и CD8 + Т-клетки. 32 Способы стимулирования пролиферации поликлональных Т-клеток против HCMV из смешанной популяции всех донорских Т-клеток включали использование тетрамеров HLA-пептида, праймирование PBMC и дендритных клеток лизатами HCMV и трансдукцию дендритных клеток аденовирусными векторами, экспрессирующими HCMV. антиген pp65. 32 Помимо переноса Т-клеток от донора стволовых клеток D +, можно также переносить Т-клетки от другого донора D +, который может обеспечить столь же эффективную защиту от вируса гепатита В. 33
Ганцикловир — золотой стандарт для профилактики HCMV
В настоящее время излюбленным лекарственным средством лечения активной HCMV-инфекции у лиц с ослабленным иммунитетом является внутривенное лечение ганцикловиром (GCV). GCV представляет собой аналог нуклеозида, который при фосфорилировании с образованием ганцикловиртрифосфата предпочтительно ингибирует вирусную ДНК-полимеразу UL54. 34 Первоначальное фосфорилирование катализируется киназой UL97, кодируемой HCMV, с последующим фосфорилированием, катализируемым клеточными киназами.Поскольку первая стадия фосфорилирования выполняется киназой, кодируемой HCMV, это приводит к селективности лекарственного средства для инфицированных клеток по сравнению с неинфицированными клетками. 34 Производным GCV является VGCV, пролекарство GCV с пероральной биодоступностью, которое обычно назначают реципиентам SOT в качестве профилактики. 34 Неудивительно, что мутации устойчивости к GCV и VGCV чаще всего встречаются в генах HCMV, кодирующих UL97 и UL54. 34 Доза GCV ограничена цитотоксичностью, которая может вызывать нейтропению и тромбоцитопению и вызывать временное и постоянное бесплодие в исследованиях на животных. 34 Эта нейтропения, опосредованная GCV, может привести к увеличению смертности от бактериальных и грибковых инфекций, 35 и, что наиболее тревожно, миелосупрессивные эффекты GCV, вероятно, мешают восстановлению иммунной системы после HSCT. 36 Несмотря на эти осложнения, GCV и VGCV очень эффективны и по-прежнему являются золотым стандартом противовирусного лечения, благодаря которому заболеваемость HCMV остается ниже 10%. Чтобы смягчить негативные побочные эффекты, GCV обычно назначают в течение 100 дней после SOT, чтобы ограничить нейтропению и нефротоксичность. 37 Однако большинство случаев заболевания HCMV происходит после этих 100 дней лечения (поздняя стадия HCMV). Отчасти это связано с виростатической природой GCV, а отчасти с тем, что эти противовирусные препараты не нацелены на латентно инфицированные клетки. Одно из предлагаемых решений — продлить курс лечения VGCV до 200 дней. Одно исследование показало, что этот режим значительно снижает виремию без увеличения побочных эффектов. 37 Другие альтернативы профилактическому лечению включают мониторинг пациентов на наличие виремии HCMV или вирусного генома с помощью ПЦР и превентивное лечение GCV, что демонстрирует эффективность, аналогичную универсальному профилактическому лечению.Эта стратегия ведения в настоящее время используется для пациентов после алло-ТГСК, поскольку ВГК, ВГКВ и фоскарнет (обсуждается позже) слишком токсичны для профилактического применения реципиентам ТГСК. 38
Препараты второго ряда против HCMV
В дополнение к GCV есть препараты второй линии цидофовир (CDV) и фоскарнет, которые оба предпочтительно ингибируют вирусную ДНК-полимеразу по сравнению с клеточными полимеразами. 34 Ацикловир также одобрен для профилактики инфекции HCMV в Европейском Союзе.Однако все эти противовирусные препараты нацелены на вирусную ДНК-полимеразу, UL54, и поэтому мутации устойчивости к GCV часто приводят к различным уровням перекрестной устойчивости к другим доступным противовирусным препаратам. 34 Известно также, что фоскарнет нефротоксичен; это может привести к метаболическим изменениям, а также к сердечным аритмиям и изъязвлениям половых органов. 39 Опять же, CDV нефротоксичен и вызывает нейтропению, метаболический ацидоз и глазную гипотонию. 39 Многообещающе, бринцидофовир представляет собой пролекарство CDV, которое конъюгировано с липидом и высвобождается внутриклеточно для повышения эффективности лекарства; однако недавно он не смог значительно снизить инфекцию HCMV у реципиентов почечного трансплантата и HSCT. 40 , 41 Учитывая эти осложнения, все еще существует острая потребность в новых противовирусных препаратах против HCMV, особенно в тех, которые не нацелены на ДНК-полимеразу UL54.
Лефлуномид не по назначению (иммунодепрессант, обычно используемый для лечения ревматоидного артрита) обладает анти-HCMV активностью в результате его способности ингибировать образование тегумента. 42 Хотя этот препарат используется в случаях резистентной к ВГС инфекции HCMV, результаты неоднозначны. 43
Летермовир — это недавно одобренный противовирусный препарат против HCMV, который ингибирует вирусный терминазный комплекс
Комплекс вирусных терминаз очень специфичен для вирусов герпеса; В клетках млекопитающих не обнаружен клеточный белок, выполняющий эту функцию, что делает этот вирусный комплекс хорошей мишенью для противовирусных препаратов.Тример белков pUL51 / pUL56 / pUL89, терминазный комплекс связывает недавно синтезированный геном HCMV и прокапсид HCMV и использует активность АТФазы для перемещения ДНК в капсид. 40 Соединения, которые нацелены на комплекс терминазы, продемонстрировали высокую эффективность против HCMV, включая соединение гидроксипиридонкарбоновой кислоты, которое ингибирует pUL89 при низких концентрациях, и другие соединения, которые были обнаружены за последние два десятилетия, но эффективность которых была подорвана из-за низкой биодоступность. 40
Летермовир (Prevymis ©), новый противовирусный препарат против HCMV, представляет собой хиназолин, нацелен на pUL56 терминального комплекса HCMV и имеет EC50 более чем в 400 раз ниже, чем GCV. 40 Летермовир, по-видимому, взаимодействует с иммунодепрессантами, назначаемыми пациентам после ТГСК, циклоспорином А или такролимусом, увеличивая их воздействие, в то время как летермовир также увеличивает фармакокинетику циклоспорина А. 40 Важно отметить, что летермовир, по-видимому, не оказывает антагонистического действия в сочетании с одобренными в настоящее время противовирусными препаратами in vitro против HCMV, что повышает вероятность того, что комбинации этих противовирусных препаратов могут быть использованы для лечения HCMV. 40 Поскольку почечная и печеночная недостаточность влияет на фармакокинетику летермовира, увеличивая экспозицию, это может повлиять на его использование у реципиентов почек и печени. 40
Летермовир, лицензированный AiCuris и Merck, недавно был одобрен для профилактического лечения HCMV у реципиентов HSCT в США, Канаде и Европейском Союзе. Это после успешных клинических испытаний фазы III (www.accessdata.fda.gov, Reference ID 4179078). 40 Летермовир не был рекомендован Национальным институтом здравоохранения и передового опыта (NICE) для профилактического использования, при этом лечение начиналось в любой день в течение 28 дней после ТГСК и продолжалось в течение 100 дней после начала.Это произошло из-за оценки экономической эффективности более 20 000 фунтов стерлингов на год жизни с поправкой на качество (QALY), неуверенности в том, снижает ли летермовир смертность от HCMV, и вопросов об обобщении данных испытаний для стандартной практики NHS. 44 Комитет по оценке, однако, признал необходимость в новых методах лечения, которые могли бы снизить потребность в превентивных методах лечения, а также признал, что на оценку экономической эффективности в расчете на QALY будут влиять небольшие изменения в снижении смертности от летермовира, и поэтому он, вероятно, был недооценен. . 44 Более низкая оценка экономической эффективности летермовира, которая могла бы разрешить одобрение NICE, может быть возможна, если будет собрано больше данных испытаний, особенно с участием пациентов в Великобритании, и которые анализируют смертность от всех причин и качество жизни, связанное со здоровьем, через 48 недель. после алло-ТГСК.
Марибавир — новый многообещающий противовирусный препарат против вирусной киназы UL97
Марибавир (MBV), разработанный ViroPharma, представляет собой еще одно многообещающее соединение против HCMV, которое вводится перорально и нацелено на вирусную киназу UL97. 45 UL97 требуется для правильного формирования вирусного тегумента, формирования комплекса сборки вируса в клетке и высвобождения вируса. 46 Однако совместное введение как MBV, так и GCV не рекомендуется, поскольку первый является ингибитором фермента UL97, необходимого для анаболизма последнего. 47 Одним из преимуществ MBV является то, что он демонстрирует пониженную гематотоксичность и нефротоксичность по сравнению с GCV и VGCV и, таким образом, в конечном итоге может заменить эти старые соединения. 48 Рандомизированное исследование фазы II, сравнивающее превентивное лечение взрослых реципиентов трансплантата, пришло к выводу, что эффективность MBV аналогична эффективности VGCV при дозах 400–1200 мг в день. 49 Однако исследование фазы III пришло к выводу, что не было никакой разницы между MBV (100 мг в день) и плацебо в качестве профилактики заболевания HCMV после HSCT. 50 В этом исследовании MBV применялся в самой низкой из трех доз, которые использовались в предыдущем клиническом исследовании фазы II (100, 200 и 400 мг). Повторение этого испытания с использованием максимальной дозы MBV (400 мг в день), которая является прогнозируемой дозой для адекватного IC50, может оказаться клинически полезным. 51 Несмотря на эту неудачу, MBV также проходит испытания в качестве средства лечения HCMV; одно испытание фазы III — тестирование MBV (200 мг в день) для реципиентов трансплантата с HCMV, которые уже демонстрируют устойчивость к GCV, CDV или фоскарнету (клинические испытания.gov, идентификатор: NCT02
9).
Терапевтические препараты на основе больших молекул против HCMV
Пассивная иммунизация иммуноглобулином HCMV (CMVIG) одобрена FDA США для профилактического лечения против HCMV в сочетании с GCV у реципиентов трансплантата легких из группы высокого риска. 52 Терапия иммуноглобулином HCMV также показала успех у реципиентов кардиоторакального трансплантата 52 и может быть особенно эффективной для пациентов с такими осложнениями, как резистентность GCV, плохая переносимость GCV 52 или гипогаммаглобунемия. 52 Одним из примеров эффективности CMVIG было исследование, в котором 15 бессимптомных реципиентов трансплантата сердца, у которых была острая инфекция HCMV без заболевания HCMV и с низкой вирусной нагрузкой, получали CMVIG без противовирусных препаратов. У девяти из этих пациентов был отрицательный результат на HCMV по результатам ПЦР-теста после однократной дозы, а у 14 — отрицательный результат после двух доз. 52 Доказательств в поддержку терапии CMVIG для предотвращения врожденного HCMV не хватает, и в рандомизированном исследовании CMVIG не оказал значительного снижения врожденного HCMV, 53 , но в группе лечения сообщалось о более высоких акушерских побочных эффектах. 53 CMVIG не рекомендуется для рутинного использования у беременных с первичной инфекцией HCMV. 19
В дополнение к терапии CMVIG был разработан гибридный токсиновый белок (FTP) с активностью против HCMV. Этот белок, названный F49A-FTP, состоит из растворимой части фракталкина (CX3CL1), сигнального хемокина, который контролирует воспаление и хемотаксис клеток, генетически слитого с белком pseudomonas exotoxin (PE) A. 54 Фракталкиновая составляющая связывается с белком US28 HCMV, хемокиновым рецептором, который экспрессируется на поверхности клетки, и это связывание приводит к интернализации как US28, так и F49A-FTP.Попав внутрь клетки, PE-часть F49A-FTP расщепляется и ингибирует трансляцию, что приводит к гибели клетки. F49A-FTP показал более высокую эффективность по сравнению с GCV как в инфицированных фибробластах, так и в модели HCMV на мышах SCID-hu. 54 HCMV быстро стал устойчивым к F49A-FTP, в результате чего в гене US28 появились мутации, снижающие связывание FTP. Поскольку US28 является незаменимым для репликации HCMV, это предполагает, что F49A-FTP вряд ли будет использоваться отдельно для лечения HCMV, но может использоваться в сочетании с другими противовирусными препаратами для лечения HCMV-резистентного HCMV.Действительно, F49A-FTP является вирулицидным, а не вирустатическим, и поэтому может использоваться для снижения вирусной нагрузки у пациентов, проходящих профилактическое лечение. Основная проблема при лечении F49A-FTP, вероятно, будет связана с нецелевым связыванием с рецептором фракталкина, CX3CR1, который экспрессируется на высоких уровнях в клетках иммунной системы и нервной системы. 54 F49A-FTP также продемонстрировал эффективность в уничтожении латентно инфицированных клеток (обсуждается в следующем разделе).
Терапия против латентного периода HCMV
Латентный период HCMV — это поддержание вирусного генома в инфицированной клетке, которое, в зависимости от используемой модели латентного периода, может сопровождаться экспрессией широкого числа вирусных транскриптов 55–57 , но, что важно, происходит в отсутствие продукции инфекционные вирионы. 3 Точно так же, по определению, такие латентно инфицированные клетки обладают потенциалом реактивироваться в литическую инфекцию при определенных стимулах. 3 Эти стимулы включают провоспалительные сигналы и миелоидную дифференцировку. 3 Все современные противовирусные терапии HCMV нацелены на аспекты репликации HCMV и продукции вируса и, следовательно, неэффективны против латентно инфицированных клеток, где HCMV не реплицируется активно. Действительно, поздняя стадия заболевания HCMV у реципиентов, вероятно, происходит частично из-за реактивации латентного HCMV.HCMV может установить латентную инфекцию в клетках ранней миелоидной линии, включая клетки-предшественники CD34 + и моноциты CD14 + , первые из которых составляют основной тип клеток, присутствующих в HSCT. Латентно инфицированные моноциты периферической крови также могут присутствовать в SOT и, следовательно, также могут содержать вирус, который не будет мишенью для лечения VGCV. Следовательно, уменьшение количества латентно инфицированных клеток в трансплантированных тканях может иметь далеко идущие клинические преимущества, и в последнее время наблюдается значительный интерес к лечению латентного периода HCMV. 58
Среди этих потенциальных методов лечения — винкристин, ингибитор тубулина, который используется для лечения ряда видов рака. Винкристин транспортируется из клеток с помощью белка 1, связанного с множественной лекарственной устойчивостью, переносчика лекарств (MRP-1). Однако вирусный ген UL138, который экспрессируется во время латентного периода HCMV, подавляет MRP-1, делая латентно инфицированные клетки чувствительными к токсичности винкристина. 59 Винкристин был первой опубликованной молекулой, которая могла убивать латентно инфицированные клетки в культуре, 59 , хотя потенциальная токсичность винкристина может ограничивать его клиническое применение.
Как обсуждалось выше, F49A-FTP связывает белок US28 HCMV и убивает инфицированные клетки через слитый белок PE. 54 US28 также экспрессируется HCMV во время латентной инфекции, 60 , 61 , и эта экспрессия US28 делает латентно инфицированные клетки чувствительными к уничтожению с помощью F49A-FTP. 61 Основным ограничением F49A-FTP является появление мутаций устойчивости в гене US28. Однако это менее проблематично при скрытом заражении, когда не происходит репликации вируса.Учитывая неизвестный потенциал нецелевых эффектов F49A-FTP, одной из возможностей может быть инфузия трансплантированных тканей с F49A-FTP для очистки инфицированных клеток перед трансплантацией.
В дополнение к непосредственно вирулицидным терапевтическим средствам в двух публикациях были предложены стратегии «пнуть и убить», направленные на латентный резервуар. Этот метод очистки латентно инфицированных клеток включает обработку, которая заставляет вирус, по крайней мере, частично реактивироваться с латентного периода, что приводит к экспрессии основных литических белков вируса.Эти клетки затем могут быть обнаружены и уничтожены иммунной системой хозяина, что особенно эффективно, поскольку значительная часть циркулирующих цитотоксических Т-клеток (CTL) CD8 + у здоровых серопозитивных носителей HCMV уже распознает эти вирусные IE-антигены 62 , которые являются обычно не экспрессируется на латентно инфицированных клетках. Обработка латентно инфицированных клеток вальпроатом натрия, ингибитором гистондеацетилазы 4 (HDAC4), обычно используемым для лечения эпилепсии и биполярного расстройства, вызывает изменения в структуре хроматина вокруг главного вирусного промотора IE. 63 Это приводит к временной аберрантной экспрессии белка IE HCMV в латентно инфицированной клетке, которая затем обнаруживается иммунной системой, позволяя этим клеткам погибнуть. 64 В качестве альтернативы, поскольку белок US28 HCMV абсолютно необходим для поддержания вирусной латентности 61 , 66 , ингибирование US28 также приводит к экспрессии немедленного раннего белка HCMV в латентно инфицированных клетках и их последующих CTL- опосредованное убийство. 65
Вакцины против HCMV все еще находятся в разработке
Вакцина против HCMV была отнесена к категории наивысшего приоритета Институтом медицины и второй по значимости приоритетной целью после ВИЧ Центрами по контролю за заболеваниями. 66 Это связано с признанным сочетанием широко распространенной инфекции, большого бремени болезней и ограниченного применения противовирусных препаратов и новейших терапевтических средств. 66 Такая вакцина могла бы значительно снизить риск заражения HCMV после трансплантации, а также снизить частоту инфицирования HCMV во время беременности, тем самым снижая частоту врожденной передачи HCMV — при условии, что эта вакцина вызвала иммунный ответ, аналогичный иммунному ответу естественный иммунитет. 66 Помимо острого заболевания HCMV, HCMV увеличивает риск сердечно-сосудистых заболеваний и смертности от всех причин. 8 Учитывая повышенную распространенность HCMV среди групп населения с более низким социально-экономическим статусом, таких как афроамериканцы, 67 вакцина против HCMV может помочь смягчить некоторые наблюдаемые социально-экономические различия в результатах в отношении здоровья между группами населения. 67
Анализ иммунного ответа на HCMV ясно показывает, что для обеспечения защиты необходимы устойчивые антитела и клеточный ответ. 68 Хотя попытки создать вакцину против HCMV относятся к 1970-м годам, успешный кандидат на вакцину еще не разработан, что предполагает, что HCMV требует сильного и специфического иммунного ответа для обеспечения защиты от первичной инфекции. 69 Живые аттенуированные вирусные вакцины на основе прошедшего лабораторного пассирования штамма вируса HCMV Towne (который адаптировался к росту в лабораторных фибробластах) имеют высокие показатели безопасности, и вирус не выделяется от вакцинированных лиц, что позволяет предположить, что вирус не распространяется. вызвать системную инфекцию. 69 Однако вакцины против вируса Таун обеспечивали лишь слабую защиту от заболевания HCMV у пациентов с трансплантатом почек 70 , 71 , первичная инфекция HCMV у серонегативных женщин 72 или защита от заражения штаммом Toledo нижнего пассажа HCMV. 73 Наиболее вероятная причина такой плохой защиты заключается в том, что вирус Таун слишком долго пассировал в лаборатории и, следовательно, показывает низкую эффективность из-за генетических различий между вирусом Таун и вирусом WT. 74 Основные генетические различия наблюдаются между вирусом дикого типа и Towne в области ULb ’генома, которая претерпевает обширные делеции, перестройки и мутации после серийного пассажа в лабораторных фибробластах. Область ULb ‘кодирует несколько белков иммунного уклонения, которые мешают распознаванию NK-клеток, таких как UL135 (нарушение иммунологического синапса), UL141 и UL142 (предотвращение экспрессии лигандов, активирующих NK-клетки), а также UL148, который нарушает экспрессию CD58, препятствуя как с NK-клетками, так и с распознаванием Т-клеток. 75 Нарушение этих генов приведет к более быстрому удалению вируса Таун с помощью врожденной иммунной системы. Кроме того, гены, необходимые для белковых компонентов пентамерного комплекса (PC), мутируют независимо от ULb ’. ПК представляет собой белковый пентамер, который присутствует на поверхности вириона и необходим для проникновения в эпителиальные клетки, эндотелиальные клетки и лейкоциты. 74 Поскольку вирус Таун имеет мутации в UL130, , делающие его неспособным к экспрессии PC, 69 , он не может вызывать ответ антител против PC, который, как известно, важен для защиты от вирусной инфекции WT. 69 , 76
Одно из решений этой проблемы состоит в рекомбинации лабораторного штамма Towne с высоким пассажем и нижнего пассажа, более похожего на дикий тип вируса Толедо, для создания химеры. Это все еще не позволяет установить системную инфекцию или латентный период, но может быть достаточно похожим на вирус дикого типа, чтобы обеспечить защиту от первичной инфекции. 74 Эти химеры показали сильные профили безопасности и индуцировали обычные CD8 + Т-клеточные ответы, но показали различия в иммуногенности между химерами. 74 К сожалению, анализ последовательности ДНК показал, что все четыре химеры имели разрушенные копии гена UL128 и поэтому не могли экспрессировать WT PC. 77 Однако эти данные секвенирования могут предоставить полезную информацию для понимания того, как генетические различия между аттенуированными вирусами коррелируют с различиями в иммуногенности между химерами, что может послужить основой для разработки будущей вакцины.
Плотные тельца HCMV, которые продуцируются HCMV-инфицированными клетками in vitro , состоят из вирусного тегумента и богатых гликопротеином оболочек (включая иммунодоминантные эпитопы pp65 и gB), но лишены вирусных капсидов или вирусной ДНК.Эти частицы индуцируют ответы антител и Т-клеток даже без адъювантов и, следовательно, являются потенциальным кандидатом в вакцины против HCMV. 78 Обеспечивают ли они защиту от вирусов и могут ли эти плотные тела образовываться в достаточных объемах (без заражения живым вирусом), еще предстоит ответить.
Субъединичные вакцины против HCMV на сегодняшний день показали наивысшую защиту от инфекции HCMV
Совсем недавно были разработаны рекомбинантные субъединичные вакцины на основе двух иммунодоминантных эпитопов HCMV: фосфопротеина (pp) 65, белка, присутствующего в тегументе вируса, и гликопротеина B (gB), который экспрессируется на поверхности вируса и требуется для проникновения вируса в клетки. 74 Иммунизация против этих двух белков была доставлена в виде вакцин с использованием различных методов, включая солюбилизированные белки, ДНК-вакцины, состоящие из плазмид, содержащих гены, кодирующие pp65 и gB, а также вирусные частицы репликона, которые представляют собой вирионы с дефицитом репликации, которые экспрессируют высокие уровни кодируемых белков и вызывают сильный иммунный ответ. 74 Недавняя историческая вакцина состояла из рекомбинантного gB HCMV с адъювантом MF59; это продемонстрировало 50% эффективность защиты молодых матерей от инфекции HCMV в испытаниях фазы II, а также защиту от виремии для реципиентов трансплантата R-D +, что является наиболее эффективными результатами на сегодняшний день. 79 Эта вакцина также была способна стимулировать ответные реакции антител к gB у серопозитивных женщин и, таким образом, могла помочь защитить беременных женщин от передачи cCMV, вызванной повторным заражением другим штаммом HCMV. 80 Учитывая относительно низкую силу инфицирования HCMV, вакцина gB / MF59, вероятно, будет иметь достаточную эффективность, чтобы существенно снизить циркуляцию HCMV в человеческой популяции. 81 , 82 Интересно, что несмотря на то, что эта вакцина демонстрирует защиту, антитела от пациентов, привитых этой вакциной, не смогли нейтрализовать HCMV в стандартных лабораторных анализах, что позволяет предположить, что могут потребоваться более подробные лабораторные анализы на вирусы, такие как HCMV, которые устанавливают пожизненная инфекция и, вероятно, передается от клетки к клетке. 83
До сих пор неясно, какие иммунные ответы необходимы для защиты от инфекции HCMV
Наблюдение за тем, что HCMV может суперинфицировать уже устойчиво инфицированного хозяина 84 , предполагает, что разработка эффективной вакцины против HCMV будет затруднена. Действительно, вакцины против HCMV могут быть эффективны только для снижения вероятности инфицирования HCMV в группах высокого риска, таких как беременные матери и реципиенты трансплантата. Также остается неясным, какие аспекты иммунитета против HCMV обеспечивают защиту в различных сценариях. 74 Например, данные свидетельствуют о том, что предшествующее инфицирование HCMV снижает риск вторичной инфекции для беременных матерей; однако терапия IgG к HCMV не обеспечивает аналогичной защиты 85 , несмотря на ранние доказательства того, что она могла быть защитной. 86 Другие исследования показали, что ранние ответы антител против HCMV PC, материнские CD4 + и CD8 + Т-клеточные ответы 85 и низкие относительные ответы интерферона на цитомегаловирус связаны с низкой вероятностью внутриутробной передачи вируса. и все вроде соотносится с защитой. 74 , 85 Наконец, как уже говорилось, присутствие нейтрализующих антител может не быть лучшим показателем эффективности вакцины 83 и, действительно, присутствие ненейтрализующих антител может быть контрпродуктивным, например, из-за содействие транслокации HCMV через плаценту через трофобласты, богатые рецепторами Fc, что приводит к повышенному риску врожденной инфекции. 87
Заключение
HCMV — серьезный патоген, и мы утверждаем, что искоренение этого вируса принесет огромную пользу человечеству.В настоящее время нет вакцины против HCMV, но есть основания для надежды: относительный успех вакцины против вируса ветряной оспы (VZV), 88 достижений в вакцинах против HSV-2 89 и субъединичной вакцины, которая обеспечила 50 % защиты от HCMV 79 все предполагают, что вакцина возможна. Из-за повсеместного распространения и пожизненного характера инфекции HCMV любая вакцина против HCMV для населения в целом, вероятно, займет очень много времени, чтобы искоренить вирус в человеческой популяции.До сих пор для лечения HCMV все еще отчаянно необходимы новые противовирусные препараты против HCMV. Одним из таких лекарств является летермовир, ингибитор упаковки вирусной ДНК, тогда как другие ингибиторы (как против литической репликации HCMV, так и против латентной инфекции HCMV) показали большие перспективы.
Благодарности
Эта работа финансировалась грантом Британской программы медицинских исследований (грант MR / S00081X / 1 для J.H.S. и M.R.W.), грантом на получение стипендии Wellcome Research (B.A.К.). B.A.K., M.R.W. и J.H.S. написал и отредактировал рукопись.
Заявление о конфликте интересов
У авторов нет потенциального конфликта интересов.
Список литературы
1.Gatherer
D
,Seirafian
S
,Cunningham
C
и др.Транскриптом цитомегаловируса человека высокого разрешения
.Proc Natl Acad Sci U S A
2011
;108
:19755
—60
.2.Stern-Ginossar
N
,Weisburd
B
,Michalski
A
и др.Расшифровка цитомегаловируса человека
.Наука
2012
;338
:1088
—93
.3.Sinclair
J
,Sissons
P
.Задержка и реактивация цитомегаловируса человека
.J Gen Virol
2006
;87
:1763
—79
.4.Sissons
JGP
,Carmichael
AJ
.Клинические аспекты и лечение цитомегаловирусной инфекции
.J Заражение
2002
;44
:78
—83
,5.Rafailidis
PI
,Mourtzoukou
EG
,Varbobitis
IC
и др.Тяжелая цитомегаловирусная инфекция у явно иммунокомпетентных пациентов: систематический обзор
.Virol J
2008
;5
:47
,6.Riou
R
,Bressollette-Bodin
C
,Boutoille
D
и др.Тяжелая симптоматическая первичная инфекция HCMV, несмотря на эффективный врожденный и адаптивный иммунный ответ
.J Virol
2016
;e02245
—16
.7.Пул
E
,Juss
JK
,Krishna
B
и др.Альвеолярные макрофаги, выделенные непосредственно из цитомегаловируса человека (HCMV) — серопозитивные люди являются сайтами реактивации HCMV in vivo
.J Infect Dis
2015
;211
:1936
—42
,8.Simanek
AM
,Dowd
JB
,Pawelec
G
и др.Серопозитивность к цитомегаловирусу, воспаление, общая смертность и смертность от сердечно-сосудистых заболеваний в США
.PLoS One
2011
;6
:e16103
.9.Dey
M
,Ahmed
AU
,Lesniak
MS
.Цитомегаловирус и глиома: поставить телегу впереди лошади
.J Neurol Neurosurg Psychiatry
2015
;86
:191
—9
.10.Dziurzynski
K
,Chang
SM
,Heimberger
AB
и др.Консенсус о роли цитомегаловируса человека в глиобластоме
.Neuro Oncol
2012
;14
:246
—55
.11.Орликовский
D
,Re
P
,Sivadon-Tardy
V
и др.Синдром Гийена-Барре после первичной цитомегаловирусной инфекции: проспективное когортное исследование
.Clin Infect Dis
2011
;52
:837
—44
.12.Savva
GM
,Pachnio
A
,Kaul
B
и др.Цитомегаловирусная инфекция связана с повышенной смертностью среди пожилого населения
.Ячейка старения
2013
;12
:381
—7
. 13.Sinzger
C
,Digel
M
,Jahn
G
.Тропизм клеток цитомегаловируса
.Curr Top Microbiol Immunol
2008
;325
:63
—83
,14.Бритт
W
.Материнский иммунитет и естественное течение врожденной цитомегаловирусной инфекции человека
.Вирусы
2018
;10
:405
.15.Retzler
J
,Hex
N
,Bartlett
C
и др.Экономическая стоимость врожденного ЦМВ в Великобритании
.Arch Dis Child
2018
. DOI: 0,16.Boppana
SB
,Rivera
LB
,Fowler
KB
и др.Внутриутробная передача цитомегаловируса младенцам от женщин с преконцептивным иммунитетом
.N Engl J Med
2001
;344
:1366
—71
. 17.Williams
E
,Kadambari
S
,Berrington
J
и др.Целевой скрининг слюны на врожденный ЦМВ в Великобритании осуществим, приемлем и может улучшить слух
.Arch Dis Child
2012
;97
:A31
—1
. 18.Cheeran
MC
,Lokensgard
JR
,Schleiss
MR
.Нейропатогенез врожденной цитомегаловирусной инфекции: механизмы заболевания и перспективы вмешательства
.Clin Microbiol Rev
2009
;22
:99
—126
,19.Rawlinson
WD
,Boppana
SB
,Fowler
KB
и др.Врожденная цитомегаловирусная инфекция у беременных и новорожденных: согласованные рекомендации по профилактике, диагностике и терапии
.Lancet Infect Dis
2017
;17
:e177
—88
.20.Shah
T
,Luck
S
,Sharland
M
и др.Пятнадцатиминутная консультация: диагностика и лечение врожденного ЦМВ
.Arch Dis Child Learning Pract Ed
2016
;101
:232
—5
,21.Раманан
P
,Razonable
RR
.Цитомегаловирусные инфекции при трансплантации твердых органов: обзор
.Infect Chemother
2013
;45
:260
—71
,22.Коттон
CN
.Ведение цитомегаловирусной инфекции при трансплантации солидных органов
.Nat Rev Nephrol
2010
;6
:711
—21
. 23.Humar
A
,Snydman
D
.Цитомегаловирус у реципиентов солидных трансплантатов
.Am J Transplant
2009
;9
:S78
—86
,24.Sia
IG
,Patel
R
.Новые стратегии профилактики и лечения цитомегаловирусной инфекции и заболеваний у реципиентов солидных трансплантатов
.Clin Microbiol Rev
2000
;13
:83
—121
,25.Перейра
F
,Rubin
RH
.Профилактика и лечение цитомегаловирусной инфекции у реципиентов солидных трансплантатов
.Curr Opin Infect Dis
2004
;17
:357
—61
,26.Джордж
B
,Pati
N
,Gilroy
N
и др.Серостатус перед трансплантацией цитомегаловируса (ЦМВ) остается наиболее важным детерминантом реактивации ЦМВ после трансплантации аллогенных гемопоэтических стволовых клеток в эпоху эпиднадзора и превентивной терапии
.Transpl Infect Dis
2010
;12
:322
—9
,27.Takenaka
K
,Nishida
T
,Asano-Mori
Y
и др.Реактивация цитомегаловируса после трансплантации аллогенных гемопоэтических стволовых клеток связана со снижением риска рецидива у пациентов с острым миелоидным лейкозом, доживших до 100-го дня после трансплантации: Рабочая группа
Японского общества трансплантации гемопоэтических клеток по осложнениям, связанным с трансплантацией.Пересадка костного мозга Biol
2015
;21
:2008
—16
,28.Бритт
W
.Проявления цитомегаловирусной инфекции человека: предложенные механизмы острого и хронического заболевания
.Curr Top Microbiol Immunol
2008
;325
:417
—70
,29.van Burik
JA
,Carter
SL
,Freifeld
AG
и др.Более высокий риск инфекций цитомегаловируса и аспергиллеза у реципиентов неродственного костного мозга с истощением Т-лимфоцитов: анализ инфекционных осложнений у пациентов, получавших истощение Т-лимфоцитов, по сравнению с иммуносупрессивной терапией для предотвращения болезни «трансплантат против хозяина»
.Пересадка костного мозга Biol
2007
;13
:1487
—98
.30.Delgado
J
,Pillai
S
,Benjamin
R
и др.Влияние истощения Т-клеток in vivo с помощью алемтузумаба на аллогенную трансплантацию гемопоэтических клеток пониженной интенсивности при хроническом лимфолейкозе
.Пересадка костного мозга Biol
2008
;14
:1288
—97
. 31.Riddell
SR
,Watanabe
KS
,Goodrich
JM
и др.Восстановление вирусного иммунитета у людей с иммунодефицитом путем адоптивного переноса клонов Т-клеток
.Science
1992
;257
:238
—41
.32.Пералес
М-А
.Приемная терапия цитомегаловирус-специфических Т-лимфоцитов: меньше больше?
Clin Infect Dis
2011
;52
:58
—60
. 33.Lindemann
M
,Eiz-Vesper
B
,Steckel
NK
и др.Приемная передача клеточного иммунитета против цитомегаловируса вирус-специфическими лимфоцитами от стороннего семейного донора
.Пересадка костного мозга
2018
;53
:1351
—5
. 34.Lischka
P
,Zimmermann
H
.Противовирусные стратегии борьбы с цитомегаловирусными инфекциями у реципиентов трансплантата
.Curr Opin Pharmacol
2008
;8
:541
—8
0,35.Николс
WG
,Кори
L
,Гули
T
и др.Высокий риск смерти от бактериальной и грибковой инфекции среди цитомегаловирусов (ЦМВ) — серонегативные реципиенты трансплантатов стволовых клеток от серопозитивных доноров: доказательства косвенных эффектов первичной ЦМВ-инфекции
.J Infect Dis
2002
;185
:273
—82
.36.Battiwalla
M
,Wu
Y
,Bajwa
RPS
и др.Ганцикловир подавляет пролиферацию лимфоцитов, нарушая синтез ДНК
.Пересадка костного мозга Biol
2007
;13
:765
—70
0,37.Humar
A
,Lebranchu
Y
,Vincenti
F
и др.Эффективность и безопасность 200-дневной профилактики цитомегаловируса валганцикловиром у реципиентов почечного трансплантата из группы высокого риска
.Am J Transplant
2010
;10
:1228
—37
.38.Mumtaz
K
,Faisal
N
,Husain
S
и др.Универсальная профилактика или превентивная стратегия цитомегаловирусной болезни после трансплантации печени: систематический обзор и метаанализ
.Am J Transplant
2015
;15
:472
—81
.39.Упадхьяюла
S
,Майклс
MG
.Ганцикловир, фоскарнет и цидофовир: противовирусные препараты не только против цитомегаловируса
.J Pediatric Infect Dis Soc
2013
;2
:286
—90
.40.Ligat
G
,Cazal
R
,Hantz
S
и др.Терминазный комплекс цитомегаловируса человека как противовирусная мишень: вид крупным планом
.FEMS Microbiol Ред.
2018
;42
:137
—45
.41.Марти
FM
,Winston
DJ
,Chemaly
RF
и др.Рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3 перорального бринцидофовира для профилактики цитомегаловируса при трансплантации аллогенных гемопоэтических клеток
.Пересадка костного мозга Biol
2019
;25
:369
—81
.42.Eid
AJ
,Razonable
RR
.Новые разработки в лечении цитомегаловирусной инфекции после трансплантации твердых органов
.Наркотики
2010
;70
:965
—81
.43.Verkaik
NJ
,Hoek
RA
,van Bergeijk
H
и др.Лефлуномид как часть лечения цитомегаловирусной болезни с множественной лекарственной устойчивостью после трансплантации легких: клинический случай и обзор литературы
.Transpl Infect Dis
2013
;15
:E243
—9
.45.Biron
KK
,Harvey
RJ
,Chamberlain
SC
и др.Сильное и селективное ингибирование репликации цитомегаловируса человека с помощью 1263W94, бензимидазол-L-рибозида с уникальным механизмом действия
.Противомикробные агенты Chemother
2002
;46
:2365
—72
. 46.Goldberg
MD
,Honigman
A
,Weinstein
J
и др.Киназа UL97 цитомегаловируса человека и неркиназные функции опосредуют вторичную оболочку цитоплазмы вируса
.J Virol
2011
;85
:3375
—84
. 47.Чоу
S
,Марусек
GI
.Марибавир противодействует противовирусному действию ганцикловира на цитомегаловирус человека
.Противомикробные агенты Chemother
2006
;50
:3470
—2
.48.Frange
P
,Leruez-Ville
M
.Марибавир, бринцидофовир и летермовир: эффективность и безопасность новых противовирусных препаратов для лечения цитомегаловирусных инфекций
.Med Mal Infect
2018
.49.Maertens
J
,Cordonnier
C
,Jaksch
P
и др.Сравнение марибавира и валганцикловира для превентивного лечения цитомегаловирусной (ЦМВ) виремии: рандомизированное исследование фазы 2 с рандомизированным диапазоном доз среди реципиентов трансплантатов гемопоэтических стволовых клеток (SCT) и трансплантатов твердых органов (SOT)
.Открытый форум Infect Dis
2016
;3
:2287
—7
,50.Марти
FM
,Ljungman
P
,Papanicolaou
GA
и др.Профилактика марибавиром для предотвращения цитомегаловирусной болезни у реципиентов аллогенных трансплантатов стволовых клеток: фаза 3, двойное слепое, плацебо-контролируемое, рандомизированное исследование
.Lancet Infect Dis
2011
;11
:284
—92
.51.Марти
FM
,Boeckh
M
.Марибавир и цитомегаловирус человека — что произошло во время клинических испытаний и почему лекарство могло потерпеть неудачу?
Curr Opin Virol
2011
;1
:555
—62
,52.Schulz
U
,Solidoro
P
,Müller
V
и др.ЦМВ-иммуноглобулины для лечения ЦМВ-инфекций у реципиентов грудного трансплантата
.Трансплантация
2016
;100
:S5
—S10
. 53.Revello
MG
,Lazzarotto
T
,Guerra
B
и др.Рандомизированное исследование гипериммунного глобулина для профилактики врожденного цитомегаловируса
.N Engl J Med
2014
;370
:1316
—26
. 54.Spiess
K
,Jeppesen
MG
,Malmgaard-Clausen
M
и др.Рационально разработанный токсин на основе хемокинов, нацеленный на вирусный рецептор US28, связанный с G-белком, эффективно ингибирует цитомегаловирусную инфекцию in vivo
.Proc Natl Acad Sci U S A
2015
;112
:8427
—32
.55.Cheng
S
,Полость
K
,Buehler
J
и др.Полнотранскриптомная характеристика цитомегаловируса человека при естественной инфекции и экспериментальный латентный период
.Proc Natl Acad Sci U S A
2017
;114
:E10586
—95
. 56.Dupont
L
,Ривз
MB
.Задержка и реактивация цитомегаловируса: недавнее понимание вековой проблемы
.Rev Med Virol
2015
. 57.Шнайдер
M
,Nachshon
A
,Кришна
B
и др.Определение транскрипционного ландшафта во время латентного периода цитомегаловируса с секвенированием одноклеточной РНК
.МБио
2018
;9
:e00013
—8
.58.Ljungman
P
,Hakki
M
,Boeckh
M
.Цитомегаловирус у реципиентов трансплантата гемопоэтических стволовых клеток
.Infect Dis Clin North Am
2010
;24
:319
—37
. 59.Weekes
MP
,Tan
SY
,Poole
E
и др.Ассоциированная с латентностью деградация переносчика лекарств MRP1 во время латентной цитомегаловирусной инфекции человека
.Science (Нью-Йорк, Нью-Йорк)
2013
;340
:199
—202
.60.Хамби
MS
,О’Коннор
CM
.HCMV US28 важен для латентной инфекции гемопоэтических клеток-предшественников
.J Virol
2015
;02507
.61.Кришна
BA
,Spiess
K
,Poole
EL
и др.Нацеливание на резервуар латентного цитомегаловируса с помощью антивирусного слитого токсинового белка
.Нац Коммуна
2017
;8
:14321
0,62.Wills
MR
,Poole
E
,Lau
B
и др.Иммунология латентного периода цитомегаловируса человека: можно ли избавиться от латентной инфекции с помощью новых иммунотерапевтических стратегий?
Cell Mol Immunol
2014
.63.Reeves
MB
,MacAry
PA
,Lehner
PJ
и др.Латентность, ремоделирование хроматина и реактивация цитомегаловируса человека в дендритных клетках здоровых носителей
.Proc Natl Acad Sci U S A
2005
;102
:4140
—5
.64.Кришна
BA
,Lau
B
,Jackson
SE
и др.Временная активация экспрессии литического гена цитомегаловируса человека во время латентного периода позволяет цитотоксическим Т-клеткам убивать латентно инфицированные клетки
.Sci Rep
2016
;6
.65.Кришна
BA
,Пул
EL
,Джексон
SE
и др.Связанная с латентностью экспрессия человеческого цитомегаловируса US28 ослабляет сигнальные пути клеток для поддержания латентной инфекции
.MBio
2017
;8
. DOI: 0,66.Arvin
AM
,Fast
P
,Myers
M
и др.Разработка вакцины для предотвращения цитомегаловирусной болезни: отчет Национального консультативного комитета по вакцинам
.Clin Infect Dis
2004
;39
:233
—9
0,67.Bate
SL
,долларов
SC
,Cannon
MJ
.Серологическая распространенность цитомегаловируса в Соединенных Штатах: Национальные обследования здоровья и питания, 1988–2004 годы
.Clin Infect Dis
2010
;50
:1439
—47
0,68.Лиля
AE
,Мейсон
PW
.Рекомбинантная вакцина-кандидат от цитомегаловируса человека нового поколения — сверх gB
.Вакцина
2012
;30
:6980
—90
.69.Adler
SP
,Manganello
A-M
,Lee
R
и др.Исследование фазы 1 4 живых рекомбинантных химерных вакцин против цитомегаловируса человека Towne / Toledo у мужчин, серонегативных по цитомегаловирусу
.J Инфекция Dis
2016
;214
:1341
—8
.70.Balfour
HH
Jr.Профилактика цитомегаловирусной болезни у реципиентов почечного аллотрансплантата
.Scand J Infect Dis Suppl
1991
;80
:88
—93
,71.Плоткин
SA
,Starr
SE
,Friedman
HM
и др.Влияние живой вирусной вакцины Таун на цитомегаловирусную болезнь после трансплантации почки: контролируемое испытание
.Ann Intern Med
1991
;114
:525
—31
,72.Адлер
СП
,Старр
SE
,Плоткин
SA
и др.Иммунитет, вызванный первичной цитомегаловирусной инфекцией человека, защищает от вторичной инфекции женщин детородного возраста
.J Infect Dis
1995
;171
:26
—32
,73.Плоткин
SA
,Starr
SE
,Friedman
HM
и др.Защитные эффекты вакцины против цитомегаловируса Таун против цитомегаловируса с малым пассажем, вводимого в качестве контрольного заражения
.J Infect Dis
1989
;159
:860
—5
,74.Андерхольм
K
,Bierle
C
,Schleiss
M
.Цитомегаловирусные вакцины: текущее состояние и перспективы на будущее
.Наркотики
2016
;76
:1625
—45
,75.Patel
M
,Vlahava
VM
,Forbes
SK
и др.Модуляторы NK, кодируемые HCMV: уроки генетических вариаций in vitro и in vivo
.Фронт Иммунол
2018
;9
:2214
,76.Ha
S
,Li
F
,Troutman
MC
и др.Нейтрализация различных штаммов цитомегаловируса человека, вызванная антителами, нацеленными на пентамерный комплекс gH / gL / pUL128-131 вируса
.J Virol
2017
;91
:e02033
—16
.77.Suárez
NM
,Lau
B
,Kemble
GM
и др.Геномный анализ химерных вакцин-кандидатов против цитомегаловируса человека, полученных из штаммов Towne и Toledo
.Вирусные гены
2017
;53
:650
—5
,78.Cayatte
C
,Schneider-Ohrum
K
,Wang
Z
и др.Плотные тела вакцинного штамма цитомегаловируса, полученные из плотных клеток, вызывают широкие клеточные иммунные ответы и нейтрализующие антитела, которые предотвращают инфицирование фибробластов и эпителиальных клеток
.J Virol
2013
;87
:11107
—20
,79.Pass
RF
,Zhang
C
,Evans
A
и др.Вакцинная профилактика материнской цитомегаловирусной инфекции
.N Engl J Med
2009
;360
:1191
—9
.80.Sabbaj
S
,Pass
RF
,Pichon
S
и др.Вакцина с гликопротеином B способна стимулировать как антитела, так и Т-клеточные ответы CD4 на цитомегаловирус у хронически инфицированных женщин
.J Infect Dis
2011
;203
:1534
—41
.81.Griffiths
P
,McLean
A
,Emery
V
.Обнадеживающие перспективы иммунизации против первичной цитомегаловирусной инфекции
.Вакцина
2001
;19
:1356
—62
.82.Schleiss
MR
,Permar
SR
,Plotkin
SA
.Прогресс в разработке вакцины против врожденной цитомегаловирусной инфекции
.Clin Vaccine Immunol
2017
;24
:e00268
—17
,83.Бараняк
I
,Kropff
B
,Ambrose
L
и др.Защита от цитомегаловирусной виремии после вакцинации гликопротеином B не зависит от нейтрализующих антител
.Proc Natl Acad Sci
2018
;201800224
,84.Hansen
SG
,Powers
CJ
,Richards
R
и др.Уклонение CD8 + Т-клеток критически важно для суперинфекции цитомегаловирусом
.Science
2010
;328
:102
—6
.85.Schleiss
MR
.Цитомегаловирусные вакцины в стадии клинической разработки
.J Virus Erad
2016
;2
:198
,86.Nigro
G
,Adler
SP
,La Torre
R
и др.Пассивная иммунизация во время беременности от врожденной цитомегаловирусной инфекции
.N Engl J Med
2005
;353
:1350
—62
,87.Maidji
E
,McDonagh
S
,Genbacev
O
и др.Материнские антитела усиливают или предотвращают цитомегаловирусную инфекцию в плаценте посредством трансцитоза, опосредованного рецепторами fc
.Am J Pathol
2006
;168
:1210
—26
.88.Чавес
SS
,Gargiullo
P
,Zhang
JX
и др.Утрата прививочного иммунитета к ветряной оспе с течением времени
.N Engl J Med
2007
;356
:1121
—9
.89.Петро
C
,Гонсалес
PA
,Чешенко
N
и др.Вирус простого герпеса типа 2, удаленный в гликопротеине D, защищает от вагинальных, кожных и нервных заболеваний
.Элиф
2015
;4
: e06054.© Автор (ы) 2019. Опубликовано Oxford University Press.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), который разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.Как лечить резистентную цитомегаловирусную инфекцию у реципиентов трансплантации гемопоэтических клеток | Кровь
27-летняя женщина CMV R + с острым Т-клеточным лимфобластным лейкозом перенесла двойную HCT пуповинной крови после кондиционирования бусульфаном, клофарабином, АТГ и облучением всего тела.Началась стандартная профилактическая терапия, приживление произошло на Д + 18. На D + 30 течение осложнилось реактивацией человеческого герпесвиура-6. В течение 2 недель лечилась фоскарнетом. Во время лечения у нее развилось острое повреждение почек и серьезный дисбаланс электролитов, который исчез после завершения терапии. На Д + 60 анализ ПЦР показал, что ЦМВ в сыворотке определялся при 255 МЕ / мл, для чего она снова начала лечение фоскарнетом в дозе 90 мг / кг каждые 12 часов в течение 21 дня.Первоначально сывороточный ЦМВ увеличился до 2370 МЕ / мл, но затем снизился до <137 МЕ / мл через 11 дней противовирусной терапии. Во время приема фоскарнета у нее было рецидивирующее острое повреждение почек, требующее корректировки дозы для снижения CrCl. После индукционной терапии пациент завершил 2-недельную поддерживающую терапию фоскарнетом, а затем получил валганцикловир в качестве вторичной профилактики. На Д + 112 у нее развилась рецидивирующая реактивация ЦМВ с сывороткой ЦМВ 377 МЕ / мл. Она снова начала лечение фоскарнетом; однако в течение 7 дней после противовирусного лечения уровень ЦМВ в сыворотке достиг 38 440 МЕ / мл.Добавляли ганцикловир в дозе 5 мг / кг каждые 12 часов, и генотипический анализ показал доказательства мутации V715M UL54 ; foscarnet был прекращен. После 21 дня лечения ганцикловиром сывороточный ЦМВ снизился до <137 МЕ / мл. На Д + 169 у нее появились тошнота и рвота, а верхняя эндоскопия выявила РТПХ желудочно-кишечного тракта, по поводу которой она получала высокие дозы кортикостероидов. ЦМВ снова реактивировался при 475 МЕ / мл, и лечение ганцикловиром было возобновлено; однако после 2 недель противовирусной терапии при оптимальной дозировке уровень ЦМВ в сыворотке оставался высоким и составлял 12 552 МЕ / мл, без признаков поражения органов-мишеней ЦМВ.Абсолютное количество лимфоцитов составило 170 клеток / мм 3 . Генотипический анализ показал V715M UL54 и новую мутацию A594V UL97 . И фоскарнет, и ганцикловир были отменены, и пациентка получала цидофовир, лефлуномид и 2 инфузии ЦТЛ, специфичных для ЦМВ. Через две недели после начала новой схемы уровень ЦМВ в сыворотке снизился до 907 МЕ / мл. Были сделаны две дополнительные инфузии ЦТЛ, специфичных для ЦМВ, и в общей сложности 4 недели внутривенного цидофовира в дозе 5 мг / кг один раз в неделю, в то время как пациенту продолжалось лечение лефлуномидом при уровнях сыворотки ≥50 мкг / мл.На Д + 253 уровень ЦМВ в сыворотке был <137 МЕ / мл, и она продолжала монотерапию лефлуномидом с прерывистыми «всплесками» ЦМВ в диапазоне от 137 до 250 МЕ / мл без явного ЦМВ-заболевания.
Цитомегаловирус CMV | Южный крест NZ
Цитомегаловирус (ЦМВ) — распространенное и обычно легкое вирусное заболевание. Большинство людей не знают, что у них ЦМВ, потому что он редко вызывает симптомы у здоровых людей.Однако людям с ослабленной иммунной системой и беременным женщинам (из-за риска осложнений для младенцев) следует обратиться к врачу, если у них есть гриппоподобные симптомы или если они думают, что они могли подвергнуться воздействию ЦМВ.
Трансмиссия
ЦМВ принадлежит к семейству вирусов герпеса, которое также включает вирусы, вызывающие ветряную оспу, железистую лихорадку и герпес. Как и эти другие состояния, вирус остается в организме на всю жизнь. Может произойти реактивация вируса, но это случается нечасто и обычно не приводит к заболеванию.ЦМВ не считается очень заразным. Однако человек с активной ЦМВ-инфекцией может передать вирус другому человеку при тесном контакте, который позволяет передавать жидкости организма, такие как моча, слезы, слюна, кровь, сперма, цервикальные выделения и грудное молоко.
Чаще всего вирус распространяется воздушно-капельным путем при кашле или чихании инфицированного человека.
Дети в детских садах и дошкольных учреждениях представляют собой значительную группу риска. В таких условиях дети находятся в тесном контакте друг с другом, и дети часто не соблюдают правила личной гигиены, которые помогли бы предотвратить передачу вируса ЦМВ.
Инкубационный период вируса ЦМВ варьируется, но симптомы обычно проявляются через 3–12 недель после контакта с вирусом.
Признаки и симптомы
У большинства здоровых людей с ЦМВ-инфекцией симптомы отсутствуют. Однако когда симптомы присутствуют, они часто похожи на симптомы железистой лихорадки. Степень тяжести и продолжительность могут быть разными, но в среднем длится от двух до трех недель. Симптомы могут включать:
- Лихорадка
- Головная боль
- Усталость
- Мышечные боли
- Увеличенные сальники
- Боль в горле
- Увеличенная селезенка.
Лица с ослабленной иммунной системой (например, люди с ВИЧ-инфекцией, реципиенты трансплантатов органов или больные раком) подвергаются наибольшему риску серьезных осложнений ЦМВ. Они могут быть опасными для жизни и могут включать:
- Анемия
- Лихорадка
- Пневмония
- Воспаление сетчатки глаза (ретинит)
- Воспаление головного мозга (энцефалит)
- Воспаление толстого кишечника (колит)
- Воспаление печени (гепатит).
Врожденный ЦМВ (вирус передается от матери к еще не родившемуся ребенку до рождения) может быть причиной родовых осложнений. Обычно риск возникает только тогда, когда у матери впервые во время беременности развивается инфекция ЦМВ. Большинство младенцев не заразятся этим вирусом, и лишь у небольшого процента из них возникнут серьезные осложнения.
Некоторые дети с врожденным ЦМВ могут родиться с очевидными проблемами, такими как:
- Недоношенность
- Низкая масса тела при рождении
- Желтуха
- Увеличение печени и селезенки
- Проблемы с легкими
- Ретинит.
В редких случаях врожденный ЦМВ может вызвать выкидыш или рождение ребенка мертворожденным.
Перинатальный CMV
Перинатальный ЦМВ — это когда дети заражаются ЦМВ от матери при передаче по родовым путям, во время родов или во время кормления грудью.Такая инфекция обычно не приводит к заболеванию, но дети, рожденные преждевременно, могут подвергаться большему риску заболевания и осложнений со стороны легких и печени.
Диагноз
По оценкам, более половины населения будут инфицированы ЦМВ к тому времени, когда достигнут среднего возраста. Однако признаки и симптомы ЦМВ обычно не являются серьезными или специфическими, поэтому инфекция редко диагностируется.У людей, инфицированных ЦМВ, вырабатываются антитела (специальные белки, которые помогают бороться с инородными телами, такими как вирусы, и уничтожать их).Эти антитела можно обнаружить в крови, поэтому анализы крови можно использовать для диагностики ЦМВ-инфекции. Обычно перед постановкой точного диагноза берут два образца крови с интервалом в две недели. Для диагностики активной инфекции ЦМВ также можно культивировать из образцов слюны, мочи и тканей.
Тестирование беременных на ЦМВ-инфекцию может иметь важное значение. Беременные женщины, у которых уже развились антитела против ЦМВ, имеют небольшую вероятность реактивации ЦМВ, которая может заразить их будущих детей.Пренатальный тест (амниоцентез) может определить, был ли плод инфицирован, если во время беременности будет обнаружена новая инфекция ЦМВ.
Лечение
Когда инфекция ЦМВ приводит к легкому заболеванию, напоминающему железистую лихорадку, часто требуется только постельный режим. Обильное питье поможет облегчить боль в горле и предотвратить обезвоживание. Также может быть полезным парацетамол для лечения лихорадки и дискомфорта. Поскольку ЦМВ вызывается вирусом, антибиотики не помогут в борьбе с ним.В случае серьезных ЦМВ-инфекций у людей с ослабленной иммунной системой могут быть назначены противовирусные препараты. Эти лекарства, такие как ганцикловир и фоскарнет, обычно вводятся в виде инфузии в кровоток, но также могут вводиться в форме таблеток. Противовирусные препараты могут уменьшить продолжительность заболевания и его тяжесть, но не излечивают ЦМВ.
Использование этих препаратов для лечения врожденных ЦМВ-инфекций все еще исследуется. Было показано, что противовирусная терапия улучшает слух и некоторые результаты развития у младенцев с симптомами ЦМВ.
Профилактика
Частое мытье рук с мылом и теплой водой и их тщательное высушивание поможет предотвратить распространение ЦМВ. Не делиться едой, столовыми приборами и стаканами, а также избегать тесного контакта с кем-либо, кто инфицирован, также поможет предотвратить распространение вируса. Это особенно важно для беременных женщин, работающих с младенцами и детьми.
Вакцины против ЦМВ изучаются, но в настоящее время вакцины нет.
Список литературы
KidsHealth (2018). Цитомегаловирус (ЦМВ) (веб-страница). Филадельфия: Фонд Nemours, Inc. https://kidshealth.org/en/parents/cytomegalovirus.html?ref=search# [дата обращения: 16.07.20]Мариско, К. и Кимберлин, Д. В. (2017). Врожденная цитомегаловирусная инфекция: достижения и проблемы в диагностике, профилактике и лечении. Ital J Pediatr. 2017; 43 (1): 38
Клиника Мэйо (2020). Цитомегаловирусная инфекция (веб-страница). Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований.https://www.mayoclinic.org/diseases-conditions/cmv/symptoms-causes/syc-20355358 [дата обращения: 16.07.20]
Выбор NHS (2017). Цитомегаловирус (ЦМВ) (веб-страница). Реддич: Национальная служба здравоохранения (NHS) Англии. https://www.nhs.uk/conditions/cytomegalovirus-cmv/ [дата обращения: 16.07.20]
О’Тул, М. (Ред.) (2017). Цитомегаловирус (ЦМВ). Словарь Мосби по медицине, медсестринскому делу и медицинским профессиям (10-е изд.). Сент-Луис, Мичиган: Эльзевьер.
О’Тул, М. (Ред.) (2017). Цитомегаловирусная болезнь включения (CID).Словарь Мосби по медицине, медсестринскому делу и медицинским профессиям (10-е изд.). Сент-Луис, Мичиган: Эльзевьер.
Последний раз отзыв — июль 2020 г.


