Перинатальная энцефалопатия (ПЭП) — мифы и реальность
Аббревиатура ПЭП (перинатальная энцефалопатия) знакома многим родителям детей первого года жизни. К сожалению, в нашей стране этот диагноз очень распространен и активно ставиться детскими неврологами. Помимо страхов и волнений родителей из-за возможных отрицательных прогнозов состояния здоровья ребенка, такой диагноз влечет за собой медикаментозное лечение, медотводы от прививок, долгую череду внеплановых неврологических осмотров и массажей.
Что же такое ПЭП и насколько она опасна для малыша?
Сегодня термин ПЭП не применяется, как устаревший. Современная неврология использует определение – перинатальная асфиксия или гипоксически-ишемическая перинатальная энцефалопатия.
Причиной перинатальной асфиксии является дефицит кислорода в крови и/или снижение показателей мозгового кровотока у плода перед родами или новорожденного в родах или первые часы жизни.
В России данный диагноз выставляют каждому 5-му младенцу, в то время как в странах Европы и Северной Америки от 1 до 8 случаев на 1000 новорожденных.
По данным крупных западных исследований, прогноз перинатальной энцефалопатии зависит от степени тяжести данного состояния, которую примерно можно соотнести с оценкой по шкале Апгар.
Легкая степень (Апгар 6-7 баллов) – в 97-100% случаев полное восстановление без последствий и без медикаментозного лечения.
Средняя степень (Апгар 4-5 баллов) – в 20-35% случаев приводит к неврологическим нарушениям.
Тяжелая степень (Апгар 0-3 балла) – крайне высокий риск стойкой неврологической патологии
Таким образом, если у Вашего ребенка оценка по Апгар была выше 7 баллов, не было никаких осложнений после рождения, ребенка вовремя выписали из роддома без дополнительных обследований и лечения, малыш развивается в соответствии с возрастными нормами, хорошо ест, прибавляет в весе и т.д., однако врач ставит Вашему ребенку диагноз ПЭП, то правомочность такого диагноза под большим сомнением.
Назначение в данном случае медикаментозной терапии (актовегин, кавинтон, циннаризин, энцефабол и др. ) никак не обосновано. Как было сказано выше, исследования показали, что у 97-100% пациентов при шкале Апгар 6-7 баллов и обоснованно выставленной легкой степени тяжести ПЭП без какого-либо медикаментозного лечения полностью отсутствуют какие-либо неврологические последствия. А в оставшихся менее 3% случаев изменения минимальны и не проявляются ни снижением IQ, ни задержкой развития или двигательными нарушениями.
) никак не обосновано. Как было сказано выше, исследования показали, что у 97-100% пациентов при шкале Апгар 6-7 баллов и обоснованно выставленной легкой степени тяжести ПЭП без какого-либо медикаментозного лечения полностью отсутствуют какие-либо неврологические последствия. А в оставшихся менее 3% случаев изменения минимальны и не проявляются ни снижением IQ, ни задержкой развития или двигательными нарушениями.
Если Вы думаете, что Вашему ребенку возможно поставили необоснованный диагноз ПЭП и назначили медикаментозное лечение, не стоит полностью игнорировать данную ситуацию. Ради его здоровья подумайте об альтернативной консультации детского невролога, который руководствуется принципами доказательной медицины. Это поможет принять правильное решение, избежать приема ненужных лекарств и сохранить спокойствие в Вашей семье в такие важные первые месяцы жизни малыша.
В Детской клинике ЕМС опытные детские неврологи всегда готовы прийти на помощь детям и их родителям с первых дней жизни малыша, в том числе, если малыш родился с низким весом и/или перинатальными нарушениями нервной системы. В распоряжении врачей клиники современное оборудование для диагностики и лечения маленьких пациентов по стандартам мировой доказательной медицины (УЗИ головного мозга, ЭЭГ, КТ, МРТ и др.).
В распоряжении врачей клиники современное оборудование для диагностики и лечения маленьких пациентов по стандартам мировой доказательной медицины (УЗИ головного мозга, ЭЭГ, КТ, МРТ и др.).
Перинатальная энцефалопатия: причины, симптомы и лечение
Перинатальная энцефалопатия — целый ряд заболеваний (отклонений в работе) центральной нервной системы у новорожденных. Заболевание может проявляться по-разному, а потому его весьма непросто диагностировать, особенно у младенцев. С этим и связан тот факт, что симптомы энцефалопатии зачастую расцениваются педиатрами как признаки совсем других заболеваний. В итоге лечению заболевания не уделяется необходимого внимания в раннем возрасте, когда наиболее велика вероятность полного выздоровления. Прогрессирующее заболевание при взрослении ребенка зачастую также диагностируется симптоматически, и лечение назначается соответствующее.
Избавление от ПЭП без остеопатического воздействия на первопричины возникновения заболевания, если не полностью невозможно (все-таки организм является саморегулирующей системой, которая вполне способна справиться с рядом серьезных заболеваний), то существенно затруднено.
Симптомы и последствия перинатальной энцефалопатии
Симптомы заболевания проявляются по-разному в различные периоды жизни ребенка. Для простоты классификации и улучшения диагностики принято выделять три основных периода ПЭП: острый (в течение первого месяца жизни), восстановительный (до 1 года, реже до 2 лет — в основном у недоношенных детей) и исход заболевания. Существует вероятность, что организм ребенка — как саморегулирующая система, с точки зрения остеопатии, — может полностью восстановиться и нейтрализовать симптомы болезни, адаптировавшись к ним. Это не означает полного выздоровления, так как последствия ПЭП могут проявиться в более позднем возрасте. Поэтому при возникновении подозрений на заболевание необходимо сразу же показать ребенка врачу-остеопату, который сможет поставить правильный диагноз и назначить грамотное адекватное лечение, направленное на избавление организма не от последствий, а от причин болезни.
Основные симптомы перинатальной энцефалопатии
В острый период развития заболевания наблюдаются:
- синдром угнетения ЦНС. Характеризуется общей вялостью новорожденных, сниженной реакцией на внешние раздражители, наличием спонтанных двигательных рефлексов;
- коматозный синдром. Обычно развивается быстро и внезапно, вызывая бессознательное состояние у ребенка. Может проявляться в остром нарушении жизненно важных функций организма;
- повышенная нервно-рефлекторная возбудимость. Проявляется в виде тремора конечностей и ненормально-возбужденной реакцией на внешние раздражители;
- повышенное черепное давление с последующим гипертензионно-гидроцефальным синдромом и непропорциональным увеличением размера черепа;
- судороги.
В восстановительный период к этим симптомам могут добавляться:
- двигательные нарушения. Проявляются по-разному, но общим является то, что ребенок полностью или частично не контролирует свои движения;
- задержка психомоторного развития (ЗПР).
 Проявляется в замедленном развитии, проблемах с речью, нарушении памяти, проблемах с вниманием и т.д.;
Проявляется в замедленном развитии, проблемах с речью, нарушении памяти, проблемах с вниманием и т.д.; - эпилептические припадки.
Признаки заболевания могут проявляться как комбинированно, так и поодиночке. Причем в разном возрасте. При обнаружении хотя бы одного симптома рекомендуется обратиться к специалисту-остеопату для проведения более детального обследования.
Исходом заболевания могут быть:
- выздоровление;
- минимальная мозговая дисфункция;
- умственное недоразвитие;
- ДЦП;
- невротические заболевания;
- эпилепсия;
- гидроцефалия.
Как показывает практика, при легких формах перинатальной энцефалопатии вероятность полного выздоровления достаточно велика. Особенно при правильном остеопатическом лечении, которое может сочетаться с другими методами воздействия на детский организм.
При более тяжелой форме понадобится более длительное лечение, которое в силу различных факторов может не иметь стопроцентной результативности. Некоторые проблемы с памятью, вниманием, координацией движений у ребенка могут сохраняться как в течение длительного периода, так и на протяжении всей жизни. Но остеопатия способствует если и не полному излечению, то существенной минимизации симптомов перинатальной энцефалопатии.
Некоторые проблемы с памятью, вниманием, координацией движений у ребенка могут сохраняться как в течение длительного периода, так и на протяжении всей жизни. Но остеопатия способствует если и не полному излечению, то существенной минимизации симптомов перинатальной энцефалопатии.
Факторы риска
К факторам риска, повышающим опасность возникновения заболевания, относятся:
- хронические болезни матери. Зачастую они не передаются ребенку напрямую, так как не являются наследственными, но на генетическом уровне обуславливают проявления различных патологий и отклонений в развитии плода и уже родившегося ребенка;
- инфекционные заболевания, перенесенные во время беременности. Очень опасны недолеченные патологии, которые могут проявиться на фоне общего ослабления иммунитета организма из-за беременности;
- неправильное питание. В период вынашивания плода организм матери должен получать весь необходимый набор белков, витаминов и минеральных веществ.
 Питание должно быть сбалансированным и согласовываться с врачом — во избежание возникновения пищевой аллергии и расстройств органов пищеварения;
Питание должно быть сбалансированным и согласовываться с врачом — во избежание возникновения пищевой аллергии и расстройств органов пищеварения; - слишком молодой возраст матери. Организм девушки может быть просто неготовым к вынашиванию полноценного и здорового ребенка. В случае слишком юного возраста или недостаточного физического развития будущей матери она должна находиться под постоянным контролем специалиста в течение всего периода беременности и после родов;
- нарушение обмена веществ в организме матери. Так как ее организм тесно взаимосвязан с организмом будущего ребенка, любые нарушения отражаются на питании и здоровье плода. Поэтому столь важно правильное питание, о котором говорилось ранее, а также безотказная работа органов, отвечающих за обмен веществ в организме;
- патологии во время беременности. Очень опасны ранние и поздние токсикозы, стрессы, физические нагрузки и другие факторы, которые могут привести к прерыванию и ненормальному течению беременности;
- неблагоприятная экологическая обстановка.

- недоношенность или переношенность плода.
- Таким образом, большинство факторов риска связаны
именно со здоровьем матери. Поэтому в период беременности она должна тщательно следить за своим самочувствием, прислушиваясь к совету хорошего врача. Параллельно с другими специалистами рекомендуется регулярно посещать остеопата, который также будет следить за ходом протекания беременности и сможет скорректировать вероятные отклонения остеопатическими методами, без применения лекарств, способных навредить будущему ребенку.
Опасность перинатальной энцефалопатии
Как и многие другие младенческие заболевания, не будучи вылеченной на ранних стадиях, перинатальная энцефалопатия прогрессирует с возрастом и может проявляться в виде самых различных нарушений, которые на первый взгляд покажутся не связанными:
- синдром частой заболеваемости.
 Это могут быть как частые простуды, так и периодические недомогания, связанные с плохим самочувствием, повышенной утомляемостью, головными болями и т.д.;
Это могут быть как частые простуды, так и периодические недомогания, связанные с плохим самочувствием, повышенной утомляемостью, головными болями и т.д.; - хронические заболевания дыхательной системы. Могут проявляться на фоне частых ОРЗ, постепенно переходя в хроническую форму. При отсутствии грамотного остеопатического лечения с возрастом могут перерасти в астму и другие не менее опасные заболевания;
- отставание в развитии. Могут проявляться в не очень явной форме, как затруднения в учебе, особенно в точных науках и творческих дисциплинах;
- нарушения осанки. Незаметные родовые травмы и нарушения в работе ЦНС, возникшие еще на этапе беременности, в дальнейшем нередко приводят к искривлению позвоночника и появлению таких серьезных заболеваний, как сколиоз, со всеми вытекающими из него последствиями, влекущими опускание внутренних органов и их частичную или полную дисфункцию;
- нарушения в работе внутренних органов, системы обмена веществ и системы кровообращения.
 Обычно эти нарушения неизменно влекут за собой другие заболевания, так как из-за нарушенного кровотока различные участки организма начинают недополучать кислород, что приводит к гибели клеток и дисфункции.
Обычно эти нарушения неизменно влекут за собой другие заболевания, так как из-за нарушенного кровотока различные участки организма начинают недополучать кислород, что приводит к гибели клеток и дисфункции.
Как расценивают перинатальную энцефалопатию специалисты-остеопаты
С точки зрения остеопатии весь комплекс заболеваний ЦНС, объединяемых под этим термином, является последствием механических нарушений в теле плода новорожденного ребенка. Причем возникнуть они могут еще на этапе беременности или позже — при сложных родах и/или кесаревом сечении. Причинами, приводящими к появлению заболевания, являются:
- дисфункция позвоночного столба или отдельных его участков;
- нарушения в работе внутренних органов;
- продолжительное кислородное голодание;
- нарушение кровообращения.
Но даже в том случае, если во время беременности плод развивался нормально, существует большая вероятность получения повреждения во время родов, так как, проходя между костями таза, плод поворачивается на 360 градусов, что может вызвать нарушения в структуре скелета, мышечных тканях. Наиболее часто наблюдается нарушения в положении шейных позвонков. В большинстве случаев в первые недели роста ребенка последствия повреждений полностью нейтрализуются организмом самостоятельно. Но так бывает далеко не всегда, любые изменения или отклонения в развитии могут привести к осложнениям, которые впоследствии спровоцируют нарушения кровоснабжения мозга и проявление перинатального расстройства.
Наиболее часто наблюдается нарушения в положении шейных позвонков. В большинстве случаев в первые недели роста ребенка последствия повреждений полностью нейтрализуются организмом самостоятельно. Но так бывает далеко не всегда, любые изменения или отклонения в развитии могут привести к осложнениям, которые впоследствии спровоцируют нарушения кровоснабжения мозга и проявление перинатального расстройства.
Как диагностируется перинатальная энцефалопатия у новорожденных и младенцев
Существует ряд безопасных методов исследования головного мозга, которым могут подвергаться новорожденные. Они позволяют составить полную клиническую картину, определить наличие заболевания, его степень, характер течения. Наиболее информативной и эффективной является нейросонография, которая точно выявляет наличие поврежденных участков в мозгу младенца. Дополнительно к ней можно провести доплерографию — для оценки кровотока в сосудах головного мозга.
В случае выявления отклонений в развитии рекомендуется пройти электроэнцефалографическое обследование, направленное на определение степени задержки в развитии. Эта процедура также позволяет выявить очаги эпилептического поражения и оценить степень их активности и опасности для организма.
Эта процедура также позволяет выявить очаги эпилептического поражения и оценить степень их активности и опасности для организма.
В некоторых случаях также рекомендуется осмотр окулиста, который поможет выяснить степень поражения путем оценки состояния зрительных нервов и анализа глазного дна.
Лечение энцефалопатии остеопатическими методами
Хороший врач-остеопат способен диагностировать ранние симптомы заболевания и составить полную картину его течения. Это дает возможность назначить грамотное лечение, способствующее адаптации организма к новым условиям, запуску и стимуляции его функций саморегулирования.
Воздействия остеопата — в зависимости от течения и сложности заболевания — направляются, в первую очередь, на пораженные участки тела, чтобы снять болевые ощущения и спазмы, образующиеся в результате неправильного развития и нарушений в системе кровообращения. Параллельно с этим специалист осуществляет комплекс процедур с целью нормализации работы мозга. Обычно для этого применяются различные техники мышечно-энергетического воздействия, которые позволяют мануальным путем восстановить равновесие натяжения внутричерепных оболочек. Это способствует восстановлению микропульсаций костей черепа и самого мозга, нормализации кровообращения.
Обычно для этого применяются различные техники мышечно-энергетического воздействия, которые позволяют мануальным путем восстановить равновесие натяжения внутричерепных оболочек. Это способствует восстановлению микропульсаций костей черепа и самого мозга, нормализации кровообращения.
После нормализации мозговой деятельности организм получает мощный стимул к саморегуляции и избавлению от энцефалопатии. Дальнейшие действия остеопата заключаются в том, чтобы помочь телу малыша справиться с болезнью. Для этого применяется мануальная терапия, массаж, лечебная физкультура и другие методики, которые, по мнению специалиста, смогут помочь скорейшему выздоровлению.
Как показывает практика, перинатальная энцефалопатия у новорожденных излечивается полностью в 30% случаев — при раннем обнаружении и грамотном лечении. Еще примерно в 20–30% — обычно при тяжелых и среднетяжелых случаях течения — новорожденные излечиваются не полностью. Какие-то симптомы при этом остаются, но зачастую часть из них удается скорректировать комплексной терапией, включающей как ЛФК, остеопатию, массажные техники, так и особое воспитание, обучение и т. д.
д.
К сожалению, во многих случаях, когда перинатальная энцефалопатия проявляется в форме серьезного поражения клеток коры головного мозга, избавиться от заболевания невозможно. Причина в гибели клеток мозга и нарушении нейронных связей, которые не могут быть восстановлены из-за недостатка или отсутствия физических носителей в мозге ребенка. Даже в этих случаях остеопатия может помочь снять некоторые неврологические симптомы, но полное восстановление мозговой деятельности оказывается невозможным.
Важно, чтобы возможная энцефалопатия новорожденных диагностировалась на самых ранних стадиях развития — в первые месяцы жизни ребенка. Чтобы поспособствовать этому, рекомендуется посетить остеопата на 3 месяце жизни, для проведения полного обследования. Специалист назначит необходимые анализы и проведет самостоятельные осмотр, что в комплексе позволит обнаружить симптомы и выявить возможное наличие заболевания.
Нередко при обнаружении ПЭП врачи-педиатры советуют начинать медикаментозное лечение. Причем делать это необходимо с раннего младенческого возраста. Каждый родитель должен осознавать, что такой подход далеко не всегда действенен и способен скорее навредить ребенку. Дело в том, что организм новорожденного достаточно слаб, но при этом сбалансирован и способен к адаптации и саморегуляции. Воздействие на него сильнодействующих лекарств приводит к необратимым изменениям, которые даже остеопат не сможет нейтрализовать. Поэтому, если у ребенка диагностирована перинатальная энцефалопатия или имеются серьезные подозрения на ее наличие, рекомендуется пройти обследование также и у остеопата. Остеопатические техники более тонкие и деликатные, а потому — эффективные. Они точечно воздействуют на участки тела и мозга, нервную систему ребенка, приводя ее в нормальное состояние.
Причем делать это необходимо с раннего младенческого возраста. Каждый родитель должен осознавать, что такой подход далеко не всегда действенен и способен скорее навредить ребенку. Дело в том, что организм новорожденного достаточно слаб, но при этом сбалансирован и способен к адаптации и саморегуляции. Воздействие на него сильнодействующих лекарств приводит к необратимым изменениям, которые даже остеопат не сможет нейтрализовать. Поэтому, если у ребенка диагностирована перинатальная энцефалопатия или имеются серьезные подозрения на ее наличие, рекомендуется пройти обследование также и у остеопата. Остеопатические техники более тонкие и деликатные, а потому — эффективные. Они точечно воздействуют на участки тела и мозга, нервную систему ребенка, приводя ее в нормальное состояние.
Профилактика заболевания
Наиболее действенным методом профилактики является соблюдение матерью режима в период беременности. В большинстве случаев новорожденные отличаются хорошим здоровьем, если мама заботится о своем организме (а значит, и о малыше). Также рекомендуется регулярное посещение врача-остеопата, который поможет следить за здоровьем в предродовой период.
Также рекомендуется регулярное посещение врача-остеопата, который поможет следить за здоровьем в предродовой период.
Очень важно и внимание к здоровью и состоянию ребенка в первые недели и месяцы его жизни. Любые отклонения в развитии, аномалии и патологии должны выявляться и фиксироваться специалистом для точной диагностики и лечения.
Энцефалопатия новорожденного — хотя и очень серьезный диагноз, но еще не приговор. Это заболевание вполне эффективно лечится.
процедуры связанные с заболеванием
причины, виды и лечение — Офтоп на TJ
{«id»:80989,»url»:»https:\/\/tjournal.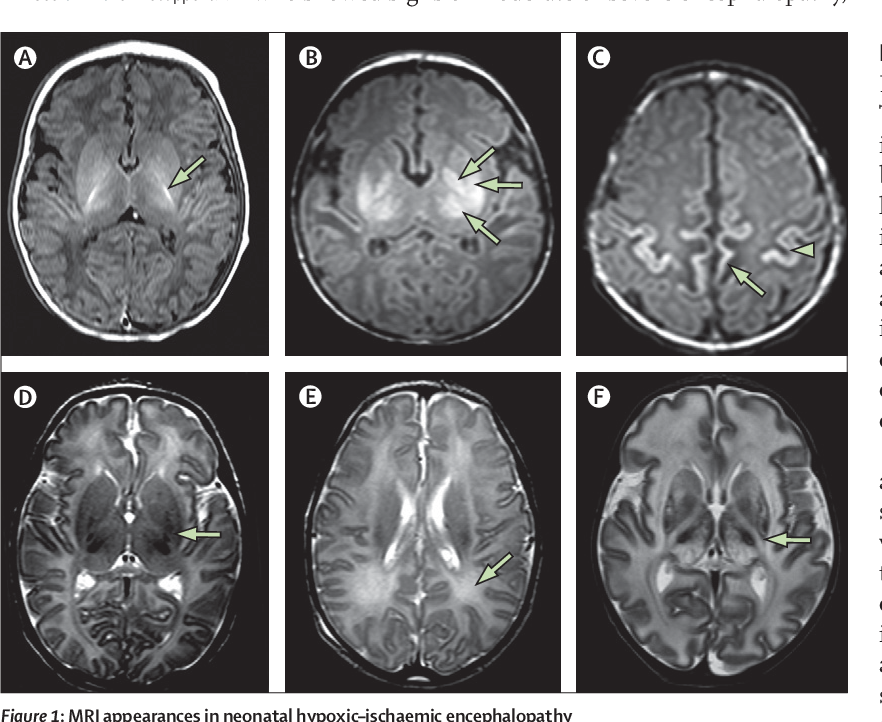 ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»title»:»\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»services»:{«vkontakte»:{«url»:»https:\/\/vk.com\/share.php?url=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie&title=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»short_name»:»VK»,»title»:»\u0412\u041a\u043e\u043d\u0442\u0430\u043a\u0442\u0435″,»width»:600,»height»:450},»facebook»:{«url»:»https:\/\/www.facebook.com\/sharer\/sharer.php?u=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»short_name»:»FB»,»title»:»Facebook»,»width»:600,»height»:450},»twitter»:{«url»:»https:\/\/twitter.com\/intent\/tweet?url=https:\/\/tjournal.
ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»title»:»\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»services»:{«vkontakte»:{«url»:»https:\/\/vk.com\/share.php?url=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie&title=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»short_name»:»VK»,»title»:»\u0412\u041a\u043e\u043d\u0442\u0430\u043a\u0442\u0435″,»width»:600,»height»:450},»facebook»:{«url»:»https:\/\/www.facebook.com\/sharer\/sharer.php?u=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»short_name»:»FB»,»title»:»Facebook»,»width»:600,»height»:450},»twitter»:{«url»:»https:\/\/twitter.com\/intent\/tweet?url=https:\/\/tjournal. ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie&text=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»short_name»:»TW»,»title»:»Twitter»,»width»:600,»height»:450},»telegram»:{«url»:»tg:\/\/msg_url?url=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie&text=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435&body=https:\/\/tjournal.
ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie&text=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»short_name»:»TW»,»title»:»Twitter»,»width»:600,»height»:450},»telegram»:{«url»:»tg:\/\/msg_url?url=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie&text=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435″,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/tjournal.ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u042d\u043d\u0446\u0435\u0444\u0430\u043b\u043e\u043f\u0430\u0442\u0438\u044f: \u043f\u0440\u0438\u0447\u0438\u043d\u044b, \u0432\u0438\u0434\u044b \u0438 \u043b\u0435\u0447\u0435\u043d\u0438\u0435&body=https:\/\/tjournal. ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
ru\/flood\/80989-encefalopatiya-prichiny-vidy-i-lechenie»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
10 994 просмотров
Энцефалопатия является тяжелым следствием патологий и внешних факторов, требует неотложного лечения, чтобы предотвратить опасные для жизни состояния.
Насколько опасна энцефалопатия у детей и взрослых
Энцефалопатия – это синдром, при котором происходит дистрофическое изменение тканей головного мозга. Наиболее частым фактором таких изменений является гипоксия и ишемия – недостаток кислорода и питательных веществ, в результате чего начинается гибель клеток.
Наиболее частым фактором таких изменений является гипоксия и ишемия – недостаток кислорода и питательных веществ, в результате чего начинается гибель клеток.
Причины
Работа тканей головного мозга зависит от поступления питательных компонентов и кислорода. Когда стабильное их поступление нарушается, клетки мозга живут несколько минут, после чего начинается их некроз.
Повышенный риск энцефалопатии и при тяжелых отравлениях, инфекционных поражениях, так как клетки мозга чувствительны к токсическим веществам любого происхождения.
Виды
Патология по происхождению бывает:
· лучевой – поражение под действием ионизирующего излучения;
· токсико-метаболической – на фоне нарушения вывода токсических продуктов метаболизма;
· токсической – на фоне острого и длительного отравления химическими веществами;
· гипоксической – при недостатке кислорода;
· посттравматической – при черепно-мозговых травмах.
Еще один вид – ангиоэнцефалопатия на фоне гипертонии, атеросклероза. Хронические патологии сосудов и ишемия – наиболее частые причины заболевания. Следствием ишемии является инсульт, кровоизлияния в мозг.
Комплекс симптомов
Выраженность и количество симптомов зависят от того, какой участок органа поражен ишемией. Пациенты жалуются на такие проявления:
· нестабильность настроения;
· нарушения сна;
· трудности мышления;
· снижение работоспособности;
· головная боль;
· раздражительность.
Невролог может обнаружить повышенные сухожильные рефлексы, нарушения моторики, координации. При тяжелых поражениях развивается тошнота, спутанность сознания, боли в голове, сильное беспокойство, паника, судорожность.
У новорожденных
Перинатальная энцефалопатия развивается на фоне таких причин:
· сильный токсикоз при беременности;
· вредные привычки у беременной;
· сильные стрессы, инфекционные заболевания при вынашивании ребенка;
· асфиксия ребенка при родах;
· инфицирование околоплодных вод;
· экстренные роды при отслойке плаценты;
· травмы при прохождении по узким родовым путям.
Факторы риска: слишком быстрые или долгие роды, инфекции в грудном возрасте. У детей симптомы проявляются в высокой возбудимости,
при средней степени тяжести отмечаются двигательные расстройства, нарушение рефлексов. Тяжелая стадия опасна комой.
Лечение
Лечение подбирается врачом и направлено на устранение причины. Назначаются препараты для снижения внутричерепного давления, питания тканей мозга, дезинтоксикации организма, восстановления кровоснабжения мозга, ноотропы для поддержания экстрапирамидных функций. В период восстановления показаны массажи, электрофорез, лечебные упражнения, в зависимости от степени поражения и длительности реабилитации.
В период восстановления показаны массажи, электрофорез, лечебные упражнения, в зависимости от степени поражения и длительности реабилитации.
симптомы, лечение резидуальной энцефалопатии в Ижевске
Резидуальная энцефалопатия – это заболевание головного мозга, вызванное повреждением тканей и гибелью нервных клеток (нейронов). Встречается у людей разного возраста, в том числе и у детей. Болезнь может быть врожденной и приобретенной.Патологические изменения развиваются, если нарушается кровоснабжение в головном мозге и клетки испытывают кислородное голодание. Спровоцировать подобное состояние способны черепно-мозговые травмы, вегетососудистая дистония, атеросклероз, гипертония, инфекции, ишемия, инсульт, сахарный диабет, токсические вещества, радиация, неконтролируемый прием лекарств, употребление наркотиков и психотропных препаратов, операции на головном мозге. Врожденная энцефалопатия может возникать вследствие осложненной беременности, аномалий внутриутробного развития, вредных привычек будущей мамы, родовых травм.
Врожденная энцефалопатия может возникать вследствие осложненной беременности, аномалий внутриутробного развития, вредных привычек будущей мамы, родовых травм.
Симптомы резидуальной энцефалопатии
При врожденной форме болезни наблюдаются нервные расстройства. Ребенок становится раздражительным либо апатичным, у него часто изменяется настроение, ухудшается память, возможны судороги.Приобретенная резидуальная энцефалопатия является «бомбой замедленного действия», так как в течение нескольких лет может протекать бессимптомно. На начальной стадии функции погибших клеток берут на себя другие нейроны. Но с возрастом головной мозг теряет компенсаторные свойства.
В результате обнаруживаются следующие симптомы:
- головная боль и головокружение;
- тошнота и рвота;
- бессонница ночью и сонливость днем;
- ослабление остроты зрения и слуха;
- невнятная речь;
- ухудшение умственных способностей;
- нарушение координации;
- заторможенность;
- вялость либо повышенная возбудимость;
- судороги и обмороки;
- парезы (ослабление двигательных функций) и параличи.

Диагностирование болезни
Чтобы поставить правильный диагноз, невролог выслушивает жалобы больного и изучает анамнез заболевания. По показаниям врач направляет пациента на инструментальные и лабораторные обследования (методы диагностики подбирают индивидуально):- рентгенографию шейного отдела;
- эхоэнцефалографию;
- электроэнцефалографию;
- ультразвуковое исследование головного мозга;
- дуплексное сканирование;
- реовазографию;
- компьютерную или магнитно-резонансную томографию;
- анализы крови и мочи.
Лечение резидуальной энцефалопатии
Неврологи клиники Елены Малышевой для каждого больного подбирают индивидуальное лечение, учитывая причины болезни, симптомы и их выраженность, тяжесть состояния.
Обычно резидуальную энцефалопатию лечат консервативными методами, которые могут включать:
- лекарственную терапию – устраняет неприятную симптоматику, восстанавливает деятельность головного мозга, нормализует обмен веществ и мозговое кровообращение;
- физиотерапию – активирует защитные силы организма, мобилизует их на борьбу с болезнью;
- лечебный массаж – стимулирует приток крови к головному мозгу, обеспечивая его питательными веществами и кислородом;
- лечебную физкультуру – активирует циркуляцию крови, восстанавливает двигательную активность, улучшает координацию.
Преимущества лечения в клинике Елены Малышевой
Важное значение для успешного лечения резидуальной энцефалопатии имеет правильная диагностика, что бывает сильно затруднительным. В клинике Елены Малышевой практикуют высококвалифицированные неврологи с многолетним опытом. В своей работе они используют современное оборудование последнего поколения, что обеспечивает правильную постановку диагноза и способствует успешному лечению.
В клинике Елены Малышевой практикуют высококвалифицированные неврологи с многолетним опытом. В своей работе они используют современное оборудование последнего поколения, что обеспечивает правильную постановку диагноза и способствует успешному лечению.Если вы заметили малейшие отклонения в состоянии здоровья, не игнорируйте проблему. Обратитесь к специалистам, что позволит в кратчайшие сроки выявить и вылечить болезнь, предотвратив опасные последствия, приводящие к деградации личности.
Записаться на прием к неврологу можно по телефону (3412) 52-50-50, либо заказав обратный звонок.
Лечение перинатальной энцефалопатии в Ижевске
Перинатальная энцефалопатия – это повреждение головного мозга ребенка, произошедшее в перинатальном периоде (беременность, роды, первый месяц после рождения).
Перинатальная энцефалопатия не совсем точный (не принят к использованию в зарубежной неврологии), но используемый в отечественной неврологии термин.
Нужно сказать, что в перинатальном периоде может отмечаться повреждение не только головного, но и спинного мозге, периферических нервных стволов и сплетений.
Таким образом, основной критерий диагноза “перинатальная энцефалопатия”– время воздействия повреждающего фактора.
Каковы основные причины перинатального поражения нервной системы?
- Патология беременности;
- Гестоз;
- Нарушения маточно-плацентарного кровотока;
- Интоксикации;
- Хронические заболевания внутренних органов.
Все эти состояния приводят к нарушению кровотока в отделах нервной системы или токсическому их повреждению. В течение беременности необходимо наблюдаться в консультативном центре для своевременного выявления и лечения патологии, в интересах женщины и плода.
Преждевременные роды (недоношенность) – один из важнейших факторов риска развития перинатального поражения ЦНС. Роды на сроке менее 28 недель практически в 100% случаев приводят к неврологическим нарушениям у ребенка.
Патология родов. В процессе родов может отмечаться обвитие пуповины, дискоординация родовой деятельности, преждевременная отслойка плаценты, кровотечение. Все это может привести к нарушению кровообращения и гипоксии в отделах нервной системы.
Все это может привести к нарушению кровообращения и гипоксии в отделах нервной системы.
Неквалифицированные акушерские пособия могут стать причиной родовой травмы головного, спинного мозга, периферических нервов.
Ранний послеродовый период. Высокий уровень билирубина, нарушения обмена углеводов, аминокислот, дефекты ухода (в частности переохлаждение недоношенных детей или перегрев в бане) могут привести к токсико-метаболическому и сосудистому повреждению нервной системы.
Повреждения нервной системы в перинатальном периоде могут иметь преимущественно травматический характер: повреждения периферических нервов и сплетений (лицевой нерв, плечевое сплетение), переломы костей черепа и позвоночника с прямым повреждением головного и спинного мозга.
Чаще встречаются опосредованные перинатальные повреждения нервной системы за счет нарушений кровотока в ее отделах. У новорожденных (особенно у недоношенных) отмечаются нарушения кровообращения в центральной нервной системе по типу инсульта у взрослых (снижение кровотока – ишемия и кровоизлияние).
Сосудистое повреждение в перинатальном периоде – наиболее частая причина таких заболеваний как детский церебральный паралич, гидроцефалия, эпилепсия, умственная отсталость, поведенческие нарушения. Использование инструментальной диагностики позволяет выставлять более точный диагноз с конкретным топическим и функциональным заключением (наличие гематом, кист, лейкомаляций, нарушений нервной проводимости, количественная оценка выпадения функций).
Повторю, что заключение “перинатальная энцефалопатия” является неточным, незаконченным и неразвернутым диагнозом.
Перинатальные поражения центральной нервной системы в ЦКБ РАН
Перинатальные поражения центральной нервной системы в ЦКБ РАН- МЕНЮ РАЗДЕЛА
Меню раздела
Акции
Контакты
Записаться на прием
Оставьте свои контактные данные чтобы записаться на прием
Заявка отправлена
Наши специалисты свяжутся с вами, в ближайшее время
Последние новости
Прямой телефон НИИ педиатрии +7 (499) 137-01-97
Перинатальные поражения центральной нервной системы (ПП ЦНС) или гипоксически-ишемическая энцефалопатия — это группа патологических состояний, связанная с повреждением головного мозга в перинатальный период.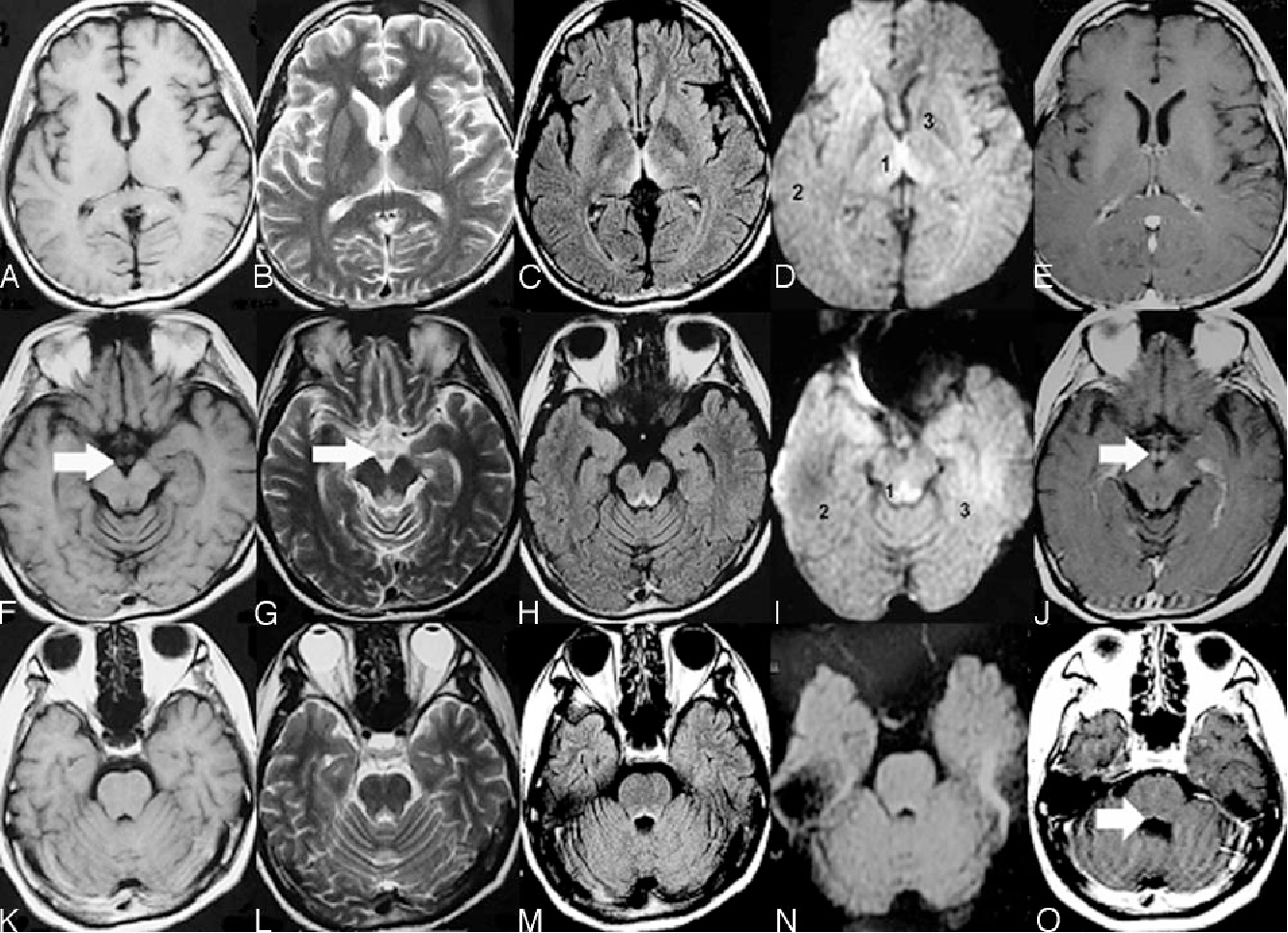
Основные причины ПП ЦНС:
- Гипоксия плода (хроническая внутриутробная; острая в родах)
- Родовая травма
- Интоксикация (билирубиновая энцефалопатия)
- Гипогликемия
- Инфекционный фактор
Клинические проявления ПП ЦНС
- Синдром возбудимости нервной системы: избыточные и множественные движения, тремор подбородка, языка, конечностей, срыгивания, нарушения сна (избыточное бодрствование), спонтанный рефлекс Моро (раскидывание ручек в положении на спине)
- Синдром угнетения нервной системы: снижение спонтанной двигательной активности, кратковременное бодрствование, избыточный сон, слабость сосательного рефлекса, недостаточная ответная эмоциональная реакция при взаимодействии с ребенком.
- Синдром вегетативно-висцеральных дисфункций: расстройства терморегуляции, преходящий цианоз, нарушение частоты сердечных сокращений и ритма дыхания, мраморность кожи, гипотермия конечностей, вегетативно-сосудистые пятна на коже, срыгивания, рвота, неустойчивый стул.

- Синдром внутричерепной гипертензии, гидроцефальный синдром: избыточный прирост окружности головы, выбухание родничка, запрокидывание головы назад, громкий монотонный плач (мозговой крик), запрокидывание головы назад вплоть до выгибания туловища (опистотонус), упорные рвоты и срыгивания не связанные с приемом пищи, повышенная чувствительность к звуковым раздражителям (гиперестезия), спонтанные выпучивание глаз (синдром Грефе), трудности засыпания (хочет спать, а уснуть не может), кратковременный и поверхностный сон, возбудимость.
- Судорожный синдром: разнообразные внезапные и повторяющиеся сокращения век, мышц лица, отведение глаз, пароксизмально возникающие жевание, глотание, сосание, высовывания языка, плавательные движения рук, педалирование, тоническое напряжение туловища или конечностей, единичные или групповые подергивания мышц конечностей, сопровождающиеся судорожными движениями глаз или «остановкой» взора, апноэ.
- Нарушение регуляции мышечного тонуса (мышечные дистонии) повышенный, пониженный, смешанный тонус мышц в конечностях, объем движений в суставах, спонтанная поза во сне и в бодрствовании, положение кистей и стоп, опора при вертикализации, положение головы при тракции ( подтягивании) за ручки.

Исходы и последствия ПП ЦНС
Последствия ПП ЦНС можно определить к 1 году жизни. Ниже представлены основные их проявления:
- Нарушение моторного развития: задержка приобретения навыков удерживания головы, переворотов, сидения, ползания, вставания, самостоятельной ходьбы относительно физического возраста ребенка.
- Формирование парезов и параличей как одной, так и нескольких конечностей (моноплегия, диплегия, гемипарез, тетрапарез), которые относятся к различным формам детского церебрального паралича.
- Нарушение психо-речевого развития: задержка приобретения навыка гуления, лепета, первых слов и фраз, качество произносимых звуков, сроки формирования пинцетного захвата и указательного жеста, понимание обращенной речи, интерес к окружающим предметам и использование их по назначению, характер игры, запоминание новой информации, концентрация внимания с формированием синдрома дефицита внимания с гиперактивностью.

- Нарушение поведения и эмоций: сроки формирования комплекса оживления, дифференцировка родных и чужих, эмоциональный резонанс, степень выраженности эмоций, общение со сверстниками и взрослыми, возможность совместной игры, формирование навыков опрятности, возможно приводящие к расстройствам аутистического спектра.
- Гидроцефалия: избыточный прирост окружности головы, деформация головы, выраженность подкожных вен в височных областях, признаки гипертензионного и гидроцефального синдромов.
- Пароксизмальные состояния не эпилептического генеза: аффективно-респираторные приступы, доброкачественный миоклонус младенчества ( синдром Фиджермана), доброкачественные неонатальный миоклонус сна, синдром Сандиффера, младенческий тортиколис, беспокойный сон, ночные страхи, ритмичные движения во сне (раскачивания, мотание головой, сосание пальца, скрежет зубов).
- Возрастзависимые эпилептические синдромы: ранняя инфантильная эпилептическая энцефалопатия ( синдром Отахара), ранняя миоклоническая энцефалопатия, синдром Драве, синдром Веста, доброкачественные неонатальные эпилептические синдромы, доброкачественная миоклоническая эпилепсия младенчества, доброкачественная парциальная эпилепсия младенчества.

Инструментальная диагностика
В КДЦ НИИ педиатрии и восстановительного лечения проводят инструментальную диагностику с целью уточнения диагноза:
- УЗИ мозга ( нейросонография)
- ЭЭГ дневного сна и бодрствования
- КТ головного мозга
- МРТ головного мозга и позвоночника
Наша помощь
На базе КДЦ работают специалисты отдела нейробиологии развития НИИ педиатрии и охраны здоровья ЦКБ РАН:
- Диагностику, наблюдение и лечение проводят опытные неврологи, кандидаты медицинских наук с 20 летним стажем работы с этой проблемой. Наши специалисты являются авторами книги «Современные нейробиологические аспекты перинатальных поражений ЦНС», выпущенной издательством российской академии наук.
- К диагностике привлекаются дефектологи и клинические психологи, которые помогают уточнить наличие нарушений в развитии. Оценка развития проводится по унифицированным таблицам развития.

- При необходимости дети могут получить специализированные лечебно-коррекционные, развивающие занятия со специалистами по раннему развитию, направленные на а стимуляцию сенсорных, зрительных, аудиальных, тактильных, координаторных функций.
- Имеется возможность комплексного наблюдения детей с перинатальным поражением ЦНС с привлечение квалифицированных специалистов, кандидатов медицинских наук.
- Сопровождение опытного педиатра, который ответит на все вопросы по уходу, питанию, профилактике рахита и ОРВИ, закаливанию.
- Отделение вакцинопрофилактики: консультация вакцинолога-иммунолога с целью составления индивидуального календаря прививок и непосредственное проведение вакцинации под его контролем.
- Привлечение любых других специалистов педиатрического профиля, включая ортопедов и офтальмологов.
Запись на прием
Заявка отправлена
Наши специалисты свяжутся с вами, в ближайшее время
Запись на прием по телефону
Многоканальный
Прикрепленный контингент (ул. Фотиевой)
Фотиевой)
- Адреса больниц:
- м. Ясенево, Литовский бульвар, д 1 А
- м. Ленинский проспект, ул. Фотиевой, д.10
- Время работы колл-центра:
- Пн-Пт с 8:00 до 20:00
- Сб с 9:00 до 18:00
- ВС с 9:00 до 15:00
Online
Заявка отправлена
Мы перезвоним вам,
в ближайшее время
Нам важно ваше мнение о сайте.
Пожалуйста, оставьте свой отзыв
Оставить отзыв
Центральная клиническая больница Российской академии наук Контакты:Адрес: Литовский бульвар, дом 1а Москва,
Телефон:+7 (495) 400-47-33, Электронная почта: callcenter@ckbran. ru
ru Массаж при перинатальной энцефалопатии | Курсы института МИРК в Москве
Форма обучения: очно, заочно, дистанционно.
Специалистам, уже работающим в сфере медицинского массажа в педиатрии, а также всем, кто столкнулся с нарушениями внутриутробного развития и патологиями первого года жизни ребенка, МИРК предлагает курс углубленного изучения техник восстановительного массажа при перинатальной энцефалопатии.
Перинатальная энцефалопатия (ПЭП) — собирательный диагноз, объединяющий большую группу мозговых дисфункций, разных по причинам возникновения и появляющихся в перинатальный период (с 28 недели беременности – по 7 день жизни ребенка).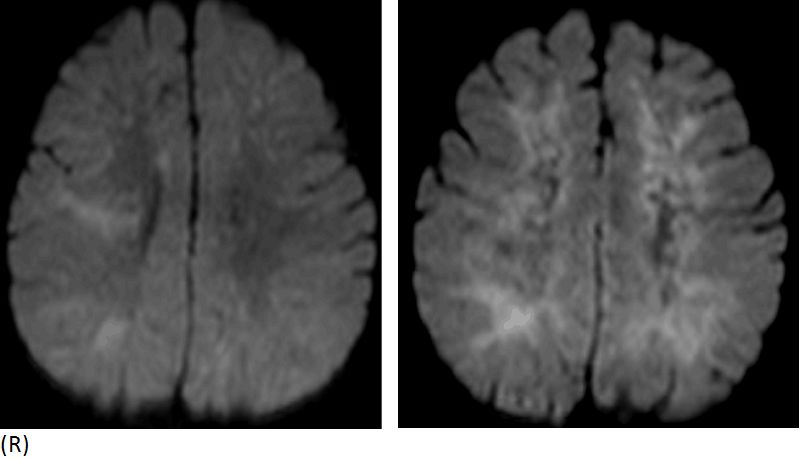 Причиной развития ПЭП могут быть внутриутробная гипоксия и инфекции, воздействие стресса, токсинов, травматические и гормональные воздействия и др.
Причиной развития ПЭП могут быть внутриутробная гипоксия и инфекции, воздействие стресса, токсинов, травматические и гормональные воздействия и др.
Самыми распространенными синдромами ПЭП являются меняющийся мышечный тонус и его асимметрия, вялость, судороги, беспокойство и вздрагивание, подергивание и напряжение ручек и ножек, плач без причины, беспокойный сон, задержки в физическом развитии.
Вовремя поставленный диагноз и лечение перинатальной энцефалопатии на ранних стадиях обычно имеет положительные результаты: к первому-второму годам жизни у ребенка восстанавливаются нарушенные мозговые функции. Отсутствие лечения перинатальной энцефалопатии может привести к серьезным осложнениям — минимальной церебральной дисфункции, гидроцефалии, судорожному синдрому, ДЦП, олигофрении и пр.
В комплексном лечении применяют симптоматическую терапию, в том числе массаж и лечебную физкультуру, помогающую улучшить обмен веществ и нормализовать тонус мышц. В результате комлексной терапии с элементами ЛФК, физиотерапии, детского массажа нормализуются функции мышечного аппарата, восстанавливаются рефлексы, налаживается работа отделов головного мозга и центральной нервной системы, усиливается кровообращение, улучшается функция суставого и связочного аппарата.
Современная неблагоприятная экологическая ситуация, вредные привычки и стресс, применение лекарств и воздействие токсинов, гормональные отклонения и инфекционные заболевания могут привести к отклонениям во внутриутробном развитии ребенка, нарушении работы его головного мозга и стать причиной появления одного из часто встречающихся диагнозов — перинатальная энцефалопатия, которая проявляется с первых дней жизни ребенка в виде отклонений в нервно-психическом развитии, в гиперактивности, судорогах, измененном мыышечном тонусе, заторможенности, нарушениях аутистического характера. Одним из эффективных методов лечения ПЭП является медицинский массаж, лечебная физкультура и физиотерапевтические процедуры.
Курс по восстановительной работе с детьми с перинатальной энцефалопатией предназначен для педиатров, коррекционных педагогов, детских массажистов, а также станет незаменимым помощников родителей, чьим детям поставлен диагноз «перинатальная энцефалопатия». МИРК гарантирует Вам качественное обучение, профессиональную постановку рук, отработку техник и приемов детского восстановительного массажа и обучение комплексу ЛФК для лечения перинатальной энцефалопатии.
Вы можете выбрать любой наиболее удобный вам режим и график обучения:
- Утренняя группа: с 9.00 до 15.00
- Дневная группа: с 15.00 до 21.00
- Группа выходного дня: с 9.00 до 15.00 или с 15.00 до 21.00
Режим обучения групп:
- пн-ср-пт (утренняя и дневная группы)
- сб-вс (группа выходного дня)
Некоторые курсы можно пройти заочно, дистанционно. Уточняйте информацию у менеджеров.
Ближайшие даты курса указаны на нашем сайте в разделе «Расписание и цены».
Что даст вам курс? По окончанию обучения вы будете:
ЗНАТЬ:
- основы работы центральной нервной системы. Нарушения центральной нервной системы в перинатальном периоде;
- причины возникновения перинатальной энцефалопатии, ее симптоматика, клинические проявления и методы диагностики;
- основные патологии при ПЭП;
- показания и противопоказания к медицинскому массажу и ЛФК при ПЭП.
УМЕТЬ:
- определять симптомы ПЭП;
- выполнять комплекс детского массажа по клиническим показаниям при ПЭП;
- использовать методы физической культуры и подбирвать комплекс ЛФК для коррекции нарушений при ПЭП.

ВЛАДЕТЬ:
- техникой проведения детского массажа при лечении ПЭП;
- техникой ведения лечебной гимнастики при различной симптоматике ПЭП;
- технологией сочетания массажа, гимнастических комплексов и физиотерапевтических методов при лечении ПЭП.
Наш Институт предоставляет возможность оплаты в рассрочку и индивидуальные условия платежей. Приглашаем вас на День открытых дверей, где вы можете посетить бесплатные уроки и мастер-классы, лично познакомиться с преподавателями, посмотреть учебную базу Института, задать все интересующие вопросы и выбрать индивидуальную стратегию профессионального развития.
Перинатальная гипоксически-ишемическая энцефалопатия
Невропатологические особенности перинатальной ГИЭ значительно различаются в зависимости от гестационного возраста младенца, природы инсульта и типов вмешательства. Исследования влияния гипоксемии на энергетический метаболизм головного мозга в незрелом мозге крысы очертили определенное окно уязвимости, характеризующееся большей уязвимостью во вторую постнатальную неделю, сравнимую с человеческим мозгом в срок, чем в первую постнатальную неделю, сравнимым с человеческий преждевременный мозг. Кроме того, на основании доказательств большей устойчивости мозгового энергетического метаболизма и большей продолжительности выживания в незрелом мозге, чем в мозге взрослого человека, подвергшегося асфиксии, существует давнее общее представление о том, что перинатальный мозг более терпим к асфиксии, чем мозг взрослого [4, 5]. Однако нейропатологические исследования показывают, что многие критические нейрональные группы более уязвимы к повреждению HI у неполовозрелых животных, особенно в связи с повышенной плотностью и функцией возбуждающих аминокислотных рецепторов и повышенной уязвимостью к атакам со стороны активных форм кислорода (АФК) и активных форм азота ( РНС) [5].
Кроме того, на основании доказательств большей устойчивости мозгового энергетического метаболизма и большей продолжительности выживания в незрелом мозге, чем в мозге взрослого человека, подвергшегося асфиксии, существует давнее общее представление о том, что перинатальный мозг более терпим к асфиксии, чем мозг взрослого [4, 5]. Однако нейропатологические исследования показывают, что многие критические нейрональные группы более уязвимы к повреждению HI у неполовозрелых животных, особенно в связи с повышенной плотностью и функцией возбуждающих аминокислотных рецепторов и повышенной уязвимостью к атакам со стороны активных форм кислорода (АФК) и активных форм азота ( РНС) [5].
2.1. Основная невропатология
Развитие черепно-мозговой травмы после инсульта HI — это развивающийся процесс, имитируемый во время острого инсульта и переходящий в фазу реперфузии. Основным патогенетическим механизмом, лежащим в основе неврологического повреждения при ГИЭ в результате гипоксемии / ишемии или того и другого, является лишение поступления глюкозы и кислорода, которое вызывает сбой первичной энергии и запускает каскад биохимических событий, ведущих к дисфункции клеток и, в конечном итоге, к гибели клеток [6, 7] .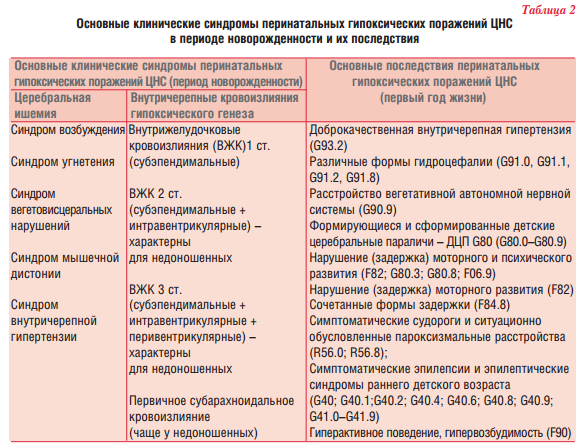 Последующее реперфузионное повреждение часто ухудшает метаболизм мозга за счет увеличения повреждения, вызванного окислительным стрессом. Подчеркивается особая роль в увеличении внеклеточного глутамата, чрезмерной активации рецепторов глутамата (эксайтотоксичность), увеличении цитозольного кальция (Ca 2+ ) и генерации свободных радикалов.
Последующее реперфузионное повреждение часто ухудшает метаболизм мозга за счет увеличения повреждения, вызванного окислительным стрессом. Подчеркивается особая роль в увеличении внеклеточного глутамата, чрезмерной активации рецепторов глутамата (эксайтотоксичность), увеличении цитозольного кальция (Ca 2+ ) и генерации свободных радикалов.
Были идентифицированы временные аспекты изменений глюкозы и энергетического метаболизма после инсульта HI, включая отказ первичной энергии и отказ вторичной энергии [8–13].Сразу после поражения HI первичная энергетическая недостаточность, истощение кислорода предотвращает окислительное фосфорилирование (уменьшение высокоэнергетических фосфорилированных соединений, таких как АТФ и фосфокреатин) и приводит к переключению на анаэробный метаболизм, вызывая накопление лактата и связанного с ним H + . Накопление лактата и связанного с ним H + изначально полезно для адаптации к кислородной недостаточности, но позже, по мере прогрессирования образования лактата, оно оказывает пагубное влияние на (1) нарушение ауторегуляции сосудов, потенциал для серьезного ишемического повреждения, ( 2) ингибирование активности фосфофруктокиназы при низком pH и (3) биохимический каскад, приводящий к повреждению клеток [8]. Возникновение вторичного энергетического сбоя варьируется в зависимости от вида и характера повреждения, начиная с 8–16 часов и заканчивая надиром через 24–48 часов. Уровни высокоэнергетического фосфата восстановились до исходного уровня через 2–3 часа после реперфузии и реоксигенации, а второе снижение уровня высокоэнергетического фосфата было выражено в следующие 48 часов [9, 11, 12].
Возникновение вторичного энергетического сбоя варьируется в зависимости от вида и характера повреждения, начиная с 8–16 часов и заканчивая надиром через 24–48 часов. Уровни высокоэнергетического фосфата восстановились до исходного уровня через 2–3 часа после реперфузии и реоксигенации, а второе снижение уровня высокоэнергетического фосфата было выражено в следующие 48 часов [9, 11, 12].
Первоначальное снижение уровня высокоэнергетического фосфата запускает ряд дополнительных механизмов, начиная с отказа АТФ-зависимого насоса Na + -K + .Отказ трансцеллюлярной ионной помпы приводит к внутриклеточному накоплению Na + , Ca 2+ и воды (цитотоксический отек) с последующей деполяризацией мембраны, чрезмерным высвобождением возбуждающих нейромедиаторов, в частности глутамата, увеличением цитозольного Ca 2+ , активация фосфолипазы и образование свободных радикалов. В течение последних двух десятилетий замечательные исследования продемонстрировали критическую роль глутамата как медиатора гибели нейронов при инсульте HI [14–16]. Глутамат является преобладающим возбуждающим аминокислотным нейромедиатором в головном мозге и имеет 3 основных типа ионотропных рецепторов, NMDA, AMPA и KA, а также группу метаботропных рецепторов глутамата, связанных с G-белком, которые присутствуют в большинстве нейронов и глии. Обычно глутамат-ионотропные рецепторы работают сообща в стабилизации синапсов и демонстрируют последовательное участие в зависимой от активности пластичности нейронов и возбуждении нейронов для выполнения обычных задач, таких как обучение и память.Однако их жизненно важная роль и улучшенная функция в перинатальном периоде также делают нейроны более уязвимыми для эксайтотоксичности. Концентрации внеклеточного глутамата многократно увеличиваются при поражении HI [17–19], а специфические блокаторы каналов рецептора глутамата улучшают повреждение головного мозга при HIE [20]. Онтогенез глутамата, кратковременная плотная экспрессия рецепторов NMDA и GluR2-дефицитных рецепторов AMPA, имеет отношение к уязвимости незрелых областей мозга к гибели эксайтотоксических клеток при ГИЭ [21, 22].
Глутамат является преобладающим возбуждающим аминокислотным нейромедиатором в головном мозге и имеет 3 основных типа ионотропных рецепторов, NMDA, AMPA и KA, а также группу метаботропных рецепторов глутамата, связанных с G-белком, которые присутствуют в большинстве нейронов и глии. Обычно глутамат-ионотропные рецепторы работают сообща в стабилизации синапсов и демонстрируют последовательное участие в зависимой от активности пластичности нейронов и возбуждении нейронов для выполнения обычных задач, таких как обучение и память.Однако их жизненно важная роль и улучшенная функция в перинатальном периоде также делают нейроны более уязвимыми для эксайтотоксичности. Концентрации внеклеточного глутамата многократно увеличиваются при поражении HI [17–19], а специфические блокаторы каналов рецептора глутамата улучшают повреждение головного мозга при HIE [20]. Онтогенез глутамата, кратковременная плотная экспрессия рецепторов NMDA и GluR2-дефицитных рецепторов AMPA, имеет отношение к уязвимости незрелых областей мозга к гибели эксайтотоксических клеток при ГИЭ [21, 22]. Присутствие субъединицы GluR2 делает рецепторы AMPA непроницаемыми для кальция. Приблизительное время максимальной чувствительности эксайтотоксичности у крыс составляет 6 дней для NMDA и 9-10 дней для AMPA, что соответствует недоношенным людям и доношенным новорожденным соответственно [23, 24]. Более того, топография глутаматных синапсов, ранняя экспрессия глутаматных рецепторов в человеческом гиппокампе, коре головного мозга и глубоких ядерных структурах аналогична регионам, уязвимым к повреждению HI у новорожденных [18, 19, 25]. Повышение концентрации внеклеточного глутамата и активация рецепторов глутамата после гипоксии-ишемии запускает эксайтотоксический каскад.Происходит увеличение цитозольного Ca 2+ за счет притока через открытые NMDA и кальций-проницаемые каналы рецепторов AMPA и другие потенциал-зависимые каналы Ca 2+ , а также высвобождение кальция из внутриклеточных запасов. Вредные эффекты повышенного содержания кальция в цитозоле включают активацию нейрональной синтазы оксида азота (nNOS) с образованием оксида азота, образование свободных радикалов и деградацию клеточных липидов путем активации фосфолипаз, клеточных белков путем активации протеазы и клеточной ДНК.
Присутствие субъединицы GluR2 делает рецепторы AMPA непроницаемыми для кальция. Приблизительное время максимальной чувствительности эксайтотоксичности у крыс составляет 6 дней для NMDA и 9-10 дней для AMPA, что соответствует недоношенным людям и доношенным новорожденным соответственно [23, 24]. Более того, топография глутаматных синапсов, ранняя экспрессия глутаматных рецепторов в человеческом гиппокампе, коре головного мозга и глубоких ядерных структурах аналогична регионам, уязвимым к повреждению HI у новорожденных [18, 19, 25]. Повышение концентрации внеклеточного глутамата и активация рецепторов глутамата после гипоксии-ишемии запускает эксайтотоксический каскад.Происходит увеличение цитозольного Ca 2+ за счет притока через открытые NMDA и кальций-проницаемые каналы рецепторов AMPA и другие потенциал-зависимые каналы Ca 2+ , а также высвобождение кальция из внутриклеточных запасов. Вредные эффекты повышенного содержания кальция в цитозоле включают активацию нейрональной синтазы оксида азота (nNOS) с образованием оксида азота, образование свободных радикалов и деградацию клеточных липидов путем активации фосфолипаз, клеточных белков путем активации протеазы и клеточной ДНК. активацией нуклеаз, а также усилением митохондриальных повреждений [26–28].Проницаемость внешней мембраны митохондрий, в свою очередь, вызывает высвобождение митохондриями цитохрома С, активацию расщепления каспаз 9 и 3 и фактора, индуцирующего апоптоз (AIF), что приводит к апоптозу [29]. Комбинированные эффекты энергетической недостаточности клетки, ацидоза, высвобождения глутамата, внутриклеточного накопления Ca 2+ , перекисного окисления липидов и нейротоксичности оксида азота служат для разрушения основных компонентов клетки с ее окончательной гибелью. Механизм гибели нейрональных клеток после гипоксии-ишемии включает некроз нейронов и апоптоз, в зависимости, главным образом, от тяжести поражения и состояния созревания клетки.Существует континуум некроза и апоптоза, и часто ранняя гибель клеток проявляется некротической, а более поздняя гибель клеток проявляется апоптозом [30, 31]. Первоначальное снижение уровня высокоэнергетических фосфатов приведет к нарушению АТФ-зависимого насоса Na + -K + , который при тяжелом поражении вызывает острый приток Na + , Cl — и воды с последующим набухание клеток, лизис клеток и, следовательно, ранняя гибель клеток из-за некроза, тогда как при менее тяжелом инсульте вызывает деполяризацию мембраны, за которой следует каскад эксайтотоксичности и окислительного стресса, приводящий к отсроченной гибели клеток, в основном апоптозу.
активацией нуклеаз, а также усилением митохондриальных повреждений [26–28].Проницаемость внешней мембраны митохондрий, в свою очередь, вызывает высвобождение митохондриями цитохрома С, активацию расщепления каспаз 9 и 3 и фактора, индуцирующего апоптоз (AIF), что приводит к апоптозу [29]. Комбинированные эффекты энергетической недостаточности клетки, ацидоза, высвобождения глутамата, внутриклеточного накопления Ca 2+ , перекисного окисления липидов и нейротоксичности оксида азота служат для разрушения основных компонентов клетки с ее окончательной гибелью. Механизм гибели нейрональных клеток после гипоксии-ишемии включает некроз нейронов и апоптоз, в зависимости, главным образом, от тяжести поражения и состояния созревания клетки.Существует континуум некроза и апоптоза, и часто ранняя гибель клеток проявляется некротической, а более поздняя гибель клеток проявляется апоптозом [30, 31]. Первоначальное снижение уровня высокоэнергетических фосфатов приведет к нарушению АТФ-зависимого насоса Na + -K + , который при тяжелом поражении вызывает острый приток Na + , Cl — и воды с последующим набухание клеток, лизис клеток и, следовательно, ранняя гибель клеток из-за некроза, тогда как при менее тяжелом инсульте вызывает деполяризацию мембраны, за которой следует каскад эксайтотоксичности и окислительного стресса, приводящий к отсроченной гибели клеток, в основном апоптозу. Апоптоз более распространен как способ смерти в перинатальном мозге, и были признаны как каспазозависимые, так и независимые от каспаз механизмы апоптотической гибели клеток ().
Апоптоз более распространен как способ смерти в перинатальном мозге, и были признаны как каспазозависимые, так и независимые от каспаз механизмы апоптотической гибели клеток ().
Предполагаемый патогенез гипоксически-ишемической энцефалопатии. Центральные роли в истощении АТФ, деполяризации мембраны, опосредованной глутаматом эксайтотоксичности и потенциал-зависимых и активируемых глутаматом каналов Ca 2+ очевидны. Первоначальное уменьшение высокоэнергетических фосфатов может привести к резкому притоку Na + , Cl — и воды с последующей гибелью клеток (некрозом) при тяжелом поражении, тогда как при менее тяжелом поражении это вызывает деполяризацию мембраны с последующей каскадом эксайтотоксичности и окислительного стресса, приводящего к замедленной гибели клеток, в основном апоптозу.Устойчивая деполяризация мембраны приводит к чрезмерному высвобождению пресинаптического глутамата, обращению транспорта глутамата в глии и нервных окончаниях, а также к активации NMDA и незрелых (дефицит GluR2) рецепторов AMPA с сильным притоком Ca 2+ с серией опосредованных Ca 2+ каскады к гибели клеток. Вредные эффекты цитозольного Ca 2+ многочисленны, включая деградацию клеточных липидов путем активации фосфолипазы и клеточной ДНК путем активации нуклеаз и усиление образования свободных радикалов и оксида азота (NO) за счет увеличения синтазы оксида азота ( NOS) [7, 8, 26].AMPA: α -амино-3-гидроксил-5-метил-4-изоксазолпропионат; ER: эндоплазматический ретикулум; mGlu: метаботропный глутамат; NMDA: N-метил-D-аспарагиновая кислота; БДУ: синтаза оксида азота; VDCC: потенциалзависимые кальциевые каналы
Вредные эффекты цитозольного Ca 2+ многочисленны, включая деградацию клеточных липидов путем активации фосфолипазы и клеточной ДНК путем активации нуклеаз и усиление образования свободных радикалов и оксида азота (NO) за счет увеличения синтазы оксида азота ( NOS) [7, 8, 26].AMPA: α -амино-3-гидроксил-5-метил-4-изоксазолпропионат; ER: эндоплазматический ретикулум; mGlu: метаботропный глутамат; NMDA: N-метил-D-аспарагиновая кислота; БДУ: синтаза оксида азота; VDCC: потенциалзависимые кальциевые каналы
Экспериментальные исследования показывают, что первое наблюдаемое изменение в нейроне — это цитоплазматическая вакуолизация, вызванная набуханием митохондрий, происходящая в течение 5-30 минут после начала гипоксии, и дифференцирующиеся олигодендроциты проявляют примерно такую же чувствительность. к недостатку глюкозы и кислорода, как и нейроны.В незрелом и зрелом мозге последовательность клеточных элементов, уязвимых для гипоксии-ишемии, — нейрон> олигодендроглия> астроцит> микроглия [32].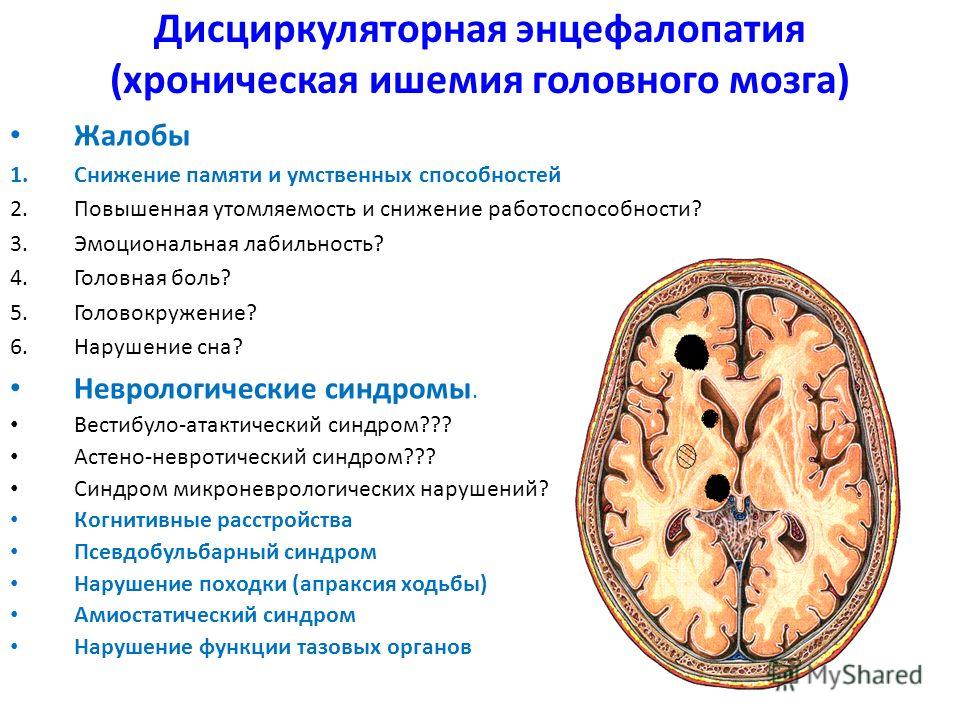 Юэ и др. продемонстрировали, что апоптотическая гибель нейронов преобладала среди незрелых нейронов, тогда как гибель некротических клеток преобладала среди зрелых нейронов [33]. Признак невропатологии варьирует в зависимости от возраста, как гипоксия-ишемия. Три основных региональных паттерна селективного нейронального некроза у новорожденных с ГИЭ, особенно термин новорожденные, диффузное заболевание, церебрально-глубокое ядро с заметным поражением неокортекса головного мозга, гиппокамп и базальные ганглии-таламус, а также глубокая ядерно-стволовая болезнь мозга [34, 35].Основная форма гипоксически-ишемического повреждения головного мозга в незрелом головном мозге включает белое вещество головного мозга, вызывающее перивентрикулярную лейкомаляцию (ПВЛ), и данные указывают на причастность особой внутренней уязвимости премиелинизирующих олигодендроцитов (пре-OL), зависящей от созревания, по отношению к обоим эндогенным факторам. и экзогенные активные формы кислорода [35–37]. Незрелый мозг имеет склонность к ишемии белого вещества головного мозга из-за наличия (1) концевых и пограничных зон сосудов в этой области и (2) нарушения ауторегуляции цереброваскулярной системы [7].
Юэ и др. продемонстрировали, что апоптотическая гибель нейронов преобладала среди незрелых нейронов, тогда как гибель некротических клеток преобладала среди зрелых нейронов [33]. Признак невропатологии варьирует в зависимости от возраста, как гипоксия-ишемия. Три основных региональных паттерна селективного нейронального некроза у новорожденных с ГИЭ, особенно термин новорожденные, диффузное заболевание, церебрально-глубокое ядро с заметным поражением неокортекса головного мозга, гиппокамп и базальные ганглии-таламус, а также глубокая ядерно-стволовая болезнь мозга [34, 35].Основная форма гипоксически-ишемического повреждения головного мозга в незрелом головном мозге включает белое вещество головного мозга, вызывающее перивентрикулярную лейкомаляцию (ПВЛ), и данные указывают на причастность особой внутренней уязвимости премиелинизирующих олигодендроцитов (пре-OL), зависящей от созревания, по отношению к обоим эндогенным факторам. и экзогенные активные формы кислорода [35–37]. Незрелый мозг имеет склонность к ишемии белого вещества головного мозга из-за наличия (1) концевых и пограничных зон сосудов в этой области и (2) нарушения ауторегуляции цереброваскулярной системы [7]. Ness et al. отметили переход гибели клеток в белом веществе от ранней некротической гибели к гибели гибридных клеток к классическому апоптозу между 4 и 24 часами восстановления после гипоксии-ишемии [38]. Отсроченный ход апоптоза в пред-OL поддерживает возможность вмешательств для улучшения клинических исходов новорожденных, переживших асфиксию при рождении.
Ness et al. отметили переход гибели клеток в белом веществе от ранней некротической гибели к гибели гибридных клеток к классическому апоптозу между 4 и 24 часами восстановления после гипоксии-ишемии [38]. Отсроченный ход апоптоза в пред-OL поддерживает возможность вмешательств для улучшения клинических исходов новорожденных, переживших асфиксию при рождении.
ГИЭ — гипоксическая ишемическая энцефалопатия
Перинатальная гипоксически-ишемическая энцефалопатия (ГИЭ) — один из наиболее серьезных и опасных для жизни типов повреждения головного мозга младенцев, которое может возникнуть во время родов.ГИЭ возникает, когда поступление кислорода и крови в мозг ребенка ограничивается или прерывается во время родов (перинатальная асфиксия), что приводит к гибели клеток мозга через короткие промежутки времени.
Что такое гипоксическая ишемическая энцефалопатия (ГИЭ)? ГИЭ — это очень серьезный тип повреждения головного мозга младенца, который возникает во время родов, когда мозг ребенка лишен крови и кислорода. Из-за недостатка крови и кислорода клетки головного мозга ребенка умирают в считанные минуты.
Из-за недостатка крови и кислорода клетки головного мозга ребенка умирают в считанные минуты.
Энцефалопатия — это медицинское слово, которое используется для обозначения различных родственных состояний, возникающих в результате повреждения головного мозга.Гипоксическая ишемическая энцефалопатия (ГИЭ) — это особый тип повреждения головного мозга, вызванный комбинацией (1) гипоксии — прерывания циркуляции кислорода; и (2) ишемия — ограничение кровотока. Перинатальный ГИЭ возникает, когда кровь и кислород, поступающие в мозг, одновременно снижаются или прекращаются во время родов или сразу после них. ГИЭ — относительно редкое событие, происходящее примерно у 3 из 1000 рождений.
Что вызывает гипоксическую ишемическую энцефалопатию (ГИЭ)? ГИЭ вызывается острой потерей притока крови и кислорода к мозгу ребенка во время родов или во время беременности.Недостаток кислорода и крови приводит к тому, что клетки развивающегося мозга ребенка быстро разлагаются, а затем умирают. Кислородная недостаточность, вызывающая ГИЭ, обычно вызвана акушерскими осложнениями во время родов и родоразрешения, но также может быть результатом пренатальных осложнений или событий. Осложнения, которые могут вызвать ГИЭ, включают:
Кислородная недостаточность, вызывающая ГИЭ, обычно вызвана акушерскими осложнениями во время родов и родоразрешения, но также может быть результатом пренатальных осложнений или событий. Осложнения, которые могут вызвать ГИЭ, включают:
Роды и Осложнения при родах:
Осложнения новорожденных:
Последствия ГИЭГИЭ — чрезвычайно серьезный тип черепно-мозговой травмы.Несмотря на то, что это происходит менее чем в 0,05% всех рождений, ГИЭ является одной из ведущих причин младенческой смертности в США каждый год.
Помимо опасности для жизни, ГИЭ вызывает необратимое повреждение головного мозга. Примерно 15-20% новорожденных с диагнозом ГИЭ умрут в первую неделю. Из оставшихся выживших 25% получат необратимые повреждения головного мозга различной степени тяжести. Повреждения головного мозга в результате ГИЭ часто приводят к физическим недостаткам и когнитивным нарушениям.
У меньшего процента детей с ГИЭ хорошие результаты. Эти дети полностью выздоравливают и испытывают лишь легкие симптомы неврологической травмы, если таковые имеются. Нет данных о продолжительности жизни 80-85% детей с ГИЭ, как выживают в первую неделю жизни. Но очевидно, что в тяжелых случаях это влияет на прогнозируемую продолжительность жизни.
Эти дети полностью выздоравливают и испытывают лишь легкие симптомы неврологической травмы, если таковые имеются. Нет данных о продолжительности жизни 80-85% детей с ГИЭ, как выживают в первую неделю жизни. Но очевидно, что в тяжелых случаях это влияет на прогнозируемую продолжительность жизни.
Симптомы ГИЭ сразу после рождения будут значительно различаться в зависимости, главным образом, от тяжести основного повреждения головного мозга:
Легкая ГИЭ
- Сухожильные рефлексы ненормальны, и мышцы жесткие в первые несколько дней
- Сильная раздражительность, проблемы с кормлением, чрезмерный плач или сон
- Симптомы легкой ГИЭ часто проходят в течение нескольких недель
Умеренная ГИЭ
- Недостаток мышечного тонуса (синдром гибкого ребенка) с отсутствием рефлексов
- Невозможно схватка и слабый сосательный рефлекс
- Спорадическое апноэ
- Припадки (обычно в течение первого дня)
Тяжелая ГИЭ
- Экстремальные приступы, которые учащаются в первые 2 дня
- Не реагируют на внешние раздражители
- Нерегулярное дыхание
- Сильная гипотония (как тряпичная кукла)
- Abn нормальный контроль глаз или движение с расширенными зрачками
- Аномальная частота сердечных сокращений и артериальное давление
- Кардиореспираторная недостаточность (часто со смертельным исходом)
Основным лечением ГИЭ, набирающим обороты в последние годы, является охлаждение тела и головы. Это лечение обычно называют терапевтическим переохлаждением. Лечебная гипотермия направлена на снижение температуры тела ребенка ниже нормы сразу после рождения. Это эффективно замедляет процессы распада и повреждения клеток в головном мозге. Замедляя этот процесс, терапия гипотермии направлена на минимизацию долгосрочного воздействия ГИЭ. К сожалению, повреждение головного мозга от гипоксии новорожденных является постоянным и не может быть просто исправлено хирургическим вмешательством или лекарствами. Итак, ОТО — это необратимая травма.Варианты лечения включают терапию и лекарства, которые помогают справиться с последствиями любого повреждения мозга. Младенцы с тяжелыми травмами ГИЭ часто нуждаются в пожизненной поддержке и приспособлении.
Это лечение обычно называют терапевтическим переохлаждением. Лечебная гипотермия направлена на снижение температуры тела ребенка ниже нормы сразу после рождения. Это эффективно замедляет процессы распада и повреждения клеток в головном мозге. Замедляя этот процесс, терапия гипотермии направлена на минимизацию долгосрочного воздействия ГИЭ. К сожалению, повреждение головного мозга от гипоксии новорожденных является постоянным и не может быть просто исправлено хирургическим вмешательством или лекарствами. Итак, ОТО — это необратимая травма.Варианты лечения включают терапию и лекарства, которые помогают справиться с последствиями любого повреждения мозга. Младенцы с тяжелыми травмами ГИЭ часто нуждаются в пожизненной поддержке и приспособлении.
Но есть и удивительные истории выздоровления от ГИЭ, когда ребенок получил необратимую травму с фантастическим исходом. Истории успеха после HIE не редкость. В конце концов, масштабы травмы ребенка, а это не утешение для родителей, часто не до конца понимают, пока ребенок не станет намного старше.
Научные источники
Йылдыз и др. «Неонатальная гипоксическая ишемическая энцефалопатия: обновленная информация о патогенезе и лечении болезни». Экспертный обзор нейротерапии 17.5 (2017): 449-459.
Моллой, Элеонора Дж. И Синтия Беэрр. «Неонатальная энцефалопатия против гипоксически-ишемической энцефалопатии». (2018): 574-574.
Finder, Mikael, et al. «Двухлетние исходы нервного развития после легкой гипоксической ишемической энцефалопатии в эпоху терапевтического гипотермии.» JAMA pediatrics 174.1 (2020): 48-55.
Greco, P., et al.» Патофизиология гипоксически-ишемической энцефалопатии: обзор прошлого и взгляд на будущее «. Acta Neurologica Belgica 120.2 (2020): 277-288.
Что такое гипоксико-ишемическая энцефалопатия (ГИЭ)?
Что такое гипоксико-ишемическая энцефалопатия (ГИЭ)?
Гипоксико-ишемическая энцефалопатия (ГИЭ) является типом новорожденных повреждение мозга, вызванное кислородным голоданием и ограниченным кровотоком. ГИЭ представляет собой тип родовой травмы ; это широкий термин, используемый для обозначения любого вреда, который ребенок испытывает во время или почти во время рождения. Другие термины, используемые для ГИЭ, включают асфиксия при рождении , перинатальная асфиксия и неонатальная энцефалопатия .
ГИЭ представляет собой тип родовой травмы ; это широкий термин, используемый для обозначения любого вреда, который ребенок испытывает во время или почти во время рождения. Другие термины, используемые для ГИЭ, включают асфиксия при рождении , перинатальная асфиксия и неонатальная энцефалопатия .
В некоторых случаях терапевтическая гипотермия может предотвратить или минимизировать необратимое повреждение головного мозга, хотя ее следует назначать в течение нескольких часов после рождения ребенка / травмы, вызванной кислородным голоданием (дополнительную информацию см. В разделе «Лечение ГИЭ»).Однако при терапевтической гипотермии и без нее у многих младенцев с ГИЭ развиваются постоянные состояния здоровья и расстройства. К ним относятся церебральный паралич (ДЦП), когнитивные нарушения, эпилепсия, нарушения слуха и зрения и многое другое.
Полная степень повреждения от HIE обычно не проявляется сразу после рождения по двум основным причинам:
- Повреждение мозга в результате HIE — это развивающийся процесс.
 Когда кровоток к частям мозга прекращается, клетки начинают разрушаться, умирать и выделять вещества, токсичные для других клеток.Затем эти клетки начинают отмирать и продолжают цепную реакцию, которая вызывает повреждение головного мозга в течение нескольких часов или дней. Разрушить эту цепную реакцию может терапевтическое переохлаждение.
Когда кровоток к частям мозга прекращается, клетки начинают разрушаться, умирать и выделять вещества, токсичные для других клеток.Затем эти клетки начинают отмирать и продолжают цепную реакцию, которая вызывает повреждение головного мозга в течение нескольких часов или дней. Разрушить эту цепную реакцию может терапевтическое переохлаждение. - Повреждения от ГИЭ могут иногда не проявляться до тех пор, пока у ребенка не появится задержка в развитии. Например, влияние на подвижность может быть незаметно до тех пор, пока ребенок не преодолеет такие важные вехи, как ползание или ходьба.
- Повреждение мозга в результате HIE — это развивающийся процесс.
Если есть необратимое повреждение мозга, от ГИЭ нет лекарства.Однако существует множество методов лечения и лечения, которые могут улучшить симптомы и улучшить функции у детей с ГИЭ.
Каковы причины ГИЭ?
ГИЭ может быть вызвано различными медицинскими осложнениями во время родов. Во многих случаях врачебная халатность также играет роль. Например, врачи могут не следить за здоровьем матери и ребенка и не выявлять потенциальные проблемы. Или же они могут распознать проблемы, но не воспринимать их достаточно серьезно / не вмешиваться.Для получения дополнительной информации о связи между HIE и злоупотреблением служебным положением, а также о юридических вариантах щелкните здесь.
Например, врачи могут не следить за здоровьем матери и ребенка и не выявлять потенциальные проблемы. Или же они могут распознать проблемы, но не воспринимать их достаточно серьезно / не вмешиваться.Для получения дополнительной информации о связи между HIE и злоупотреблением служебным положением, а также о юридических вариантах щелкните здесь.
Следующие проблемы со здоровьем и небрежные действия могут привести к ГИЭ (это лишь несколько примеров; дополнительную информацию см. На этой странице):
- Неправильное ведение беременности с высоким риском : Женщины с такими состояниями, как преэклампсия и гестационный диабет требуют более тщательного наблюдения и лечения.
- Осложнения пуповины : Пуповина подобна спасательному кругу между матерью и младенцем, снабжая кислородом и питательными веществами и удаляя отходы плода.Все, что сжимает пуповину или снижает ее функцию, подвергает ребенка риску ГИЭ.
- Плацентарные или маточные осложнения: Плацента и матка также играют очень важную роль в обеспечении ребенка насыщенной кислородом кровью.
 Примеры проблем с плацентой и маткой, которые могут вызвать ГИЭ, включают:
Примеры проблем с плацентой и маткой, которые могут вызвать ГИЭ, включают:- Отслойка плаценты: когда плацента отделяется от матки до рождения ребенка
- Предлежание плаценты: когда плацента прикрепляется слишком близко к шейке матки; это может вызвать опасное кровотечение и кислородную недостаточность во время родов
- Плацентарная недостаточность: когда плацента не может доставить достаточно крови к ребенку
- Разрыв матки: при частичном или полном разрыве матки
- Инфекции: инфекции у матери может передаваться ребенку во время схваток и родоразрешения, особенно если медицинская бригада не примет адекватных мер предосторожности (таких как проведение обследования на наличие инфекции и назначение антибиотиков при необходимости).
- Неправильный мониторинг сердца плода: Если у ребенка появляются признаки дистресса плода на кардиомониторе плода, врачи и медсестры часто могут вмешаться, чтобы восстановить его кислородное снабжение.
 При необходимости это может включать экстренное кесарево сечение. Однако, если мониторинг носит спорадический характер или не проводится, важные признаки опасности могут быть упущены.
При необходимости это может включать экстренное кесарево сечение. Однако, если мониторинг носит спорадический характер или не проводится, важные признаки опасности могут быть упущены. - Неспособность предотвратить преждевременные роды: Недоношенные дети подвергаются более высокому риску ГИЭ и других родовых травм, потому что их легкие настолько недоразвиты.Поэтому очень важно, чтобы врачи делали все возможное для предотвращения преждевременных родов, например, выполняли шейный серкляж (наложение шва на шейку матки, чтобы она не открылась слишком рано) или лечение прогестероном.
- Продолжение продолжительных родов: роды вызывают стресс у младенцев, потому что сокращения матки сжимают плаценту и пуповину, которые снабжают их кислородом. Если что-то мешает прогрессу родов, а врачи не предлагают вмешательство (например, экстренное кесарево сечение), это халатность.Длительные роды более вероятны, если ребенок крупнее обычного или таз матери меньше обычного.
- Проблемы с лекарствами: Иногда врачи прописывают лекарства, такие как Pitocin и Cytotec, чтобы вызвать или усилить роды.
 К сожалению, эти лекарства также могут стать причиной того, что сокращения матки станут настолько сильными и частыми, что ребенок будет опасно лишен кислорода.
К сожалению, эти лекарства также могут стать причиной того, что сокращения матки станут настолько сильными и частыми, что ребенок будет опасно лишен кислорода. - Неправильное ведение неонатального состояния: Гипоксико-ишемическое повреждение может быть вызвано осложнениями в неонатальном периоде, т.е.е. первый месяц жизни ребенка. Такие проблемы, как респираторный дистресс, желтуха и неонатальная гипогликемия, могут способствовать диагностике ГИЭ, особенно при неправильном лечении.
Каковы признаки и симптомы ГИЭ?
Младенцы с ГИЭ могут проявлять любой из следующих признаков (среди прочего):
- Проблемы с дыханием
- Проблемы с кормлением
- Отсутствие рефлексов (например, ребенок не реагирует на громкие звуки)
- Судороги
- Низкий уровень Апгар баллов
- Низкий или высокий мышечный тонус
- Измененный уровень сознания (например,грамм. не тревожный)
Как вы произносите «гипоксически-ишемическая энцефалопатия» (ГИЭ)?
youtube.com/embed/zPvBoFT0TsA?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Лечение ГИЭ
ГИЭ проводится с помощью лечения, называемого терапевтической гипотермией, при котором мозг или тело ребенка охлаждают до температуры ниже нормальной, чтобы замедлить каскадный эффект, вызывающий обширные повреждения. Это позволяет мозгу ребенка восстановиться и снижает уровень инвалидности, которую он может иметь по мере роста. В соответствии с действующими руководящими принципами лечение следует проводить в течение шести часов после рождения, хотя есть некоторые свидетельства того, что лечение может быть полезным при продолжении до 24 часов.
Лечебная гипотермия длится около 72 часов, что позволяет замедлить метаболизм ребенка. Это предотвращает дальнейшее повреждение, известное как реперфузионное повреждение , которое возникает, когда нормальная оксигенация и кровоток восстанавливаются слишком быстро в клетках мозга.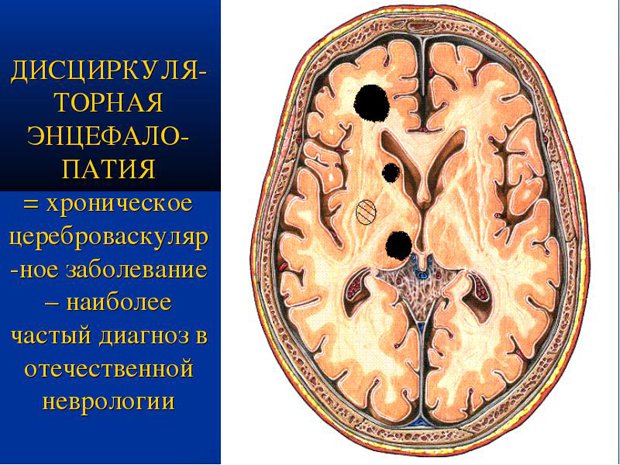 Хотя может показаться нелогичным, что быстрое восстановление кровотока может вызвать дальнейшее повреждение, клетки мозга по-разному реагируют на быстрое насыщение кислородом после кислородного голодания. После травмы, вызванной кислородным голоданием, быстрое насыщение кислородом может вызвать усиление воспаления и выделение определенных вредных соединений.Лечение гипотермии стабилизирует клетки мозга и предотвращает или ограничивает повреждающее воспаление.
Хотя может показаться нелогичным, что быстрое восстановление кровотока может вызвать дальнейшее повреждение, клетки мозга по-разному реагируют на быстрое насыщение кислородом после кислородного голодания. После травмы, вызванной кислородным голоданием, быстрое насыщение кислородом может вызвать усиление воспаления и выделение определенных вредных соединений.Лечение гипотермии стабилизирует клетки мозга и предотвращает или ограничивает повреждающее воспаление.
В дополнение к терапевтическому переохлаждению медицинский персонал должен оказывать поддерживающую терапию, которая может означать помощь ребенку в дыхании, контроль и предотвращение припадков и низкого уровня сахара в крови, уменьшение отека мозга и многое другое. В долгосрочной перспективе младенцам с поражением головного мозга в результате ГИЭ может быть полезен широкий спектр лечения и терапии. Хотя они не являются лечебными, они могут минимизировать симптомы и улучшить функцию.Для получения дополнительной информации нажмите здесь.
Типы и формы ГИЭ
Если они подозревают ГИЭ, медицинский персонал может провести визуализацию головного мозга, такую как УЗИ и МРТ, чтобы увидеть, насколько сильно повреждены ткани мозга. Воспитатели также проводят анализ газов крови, чтобы определить pH крови ребенка, который также может предоставить некоторую информацию об уровне кислорода в крови ребенка.
Тяжесть ГИЭ определяется с использованием стадирования Sarnat, которое учитывает клиническую картину, результаты обследования, наличие приступов и продолжительность заболевания.Легкая ГИЭ классифицируется как степень I по Sarnat, а степень тяжести увеличивается до максимальной степени III (1).
Распространенность и заболеваемость ГИЭ
ГИЭ оценивается от 2 до 9 случаев на 1000 живорождений. Появление терапевтической гипотермии значительно снизило уровень смертности и инвалидности, но результаты все еще могут быть тяжелыми. В одном исследовании почти половина новорожденных с ГИЭ либо умерли, либо имели серьезные нарушения развития нервной системы в течение 18 месяцев наблюдения. Однако 40 процентов детей в этом исследовании имели нормальное раннее развитие (2).
Однако 40 процентов детей в этом исследовании имели нормальное раннее развитие (2).
Ожидаемая продолжительность жизни людей с ГИЭ и церебральным параличом
Ожидаемая продолжительность жизни людей с гипоксически-ишемической энцефалопатией во многом зависит от степени их поражения и их доступа к лечению и терапии. По этой причине трудно определить «среднюю» продолжительность жизни людей с ГИЭ. Поскольку многим детям с ГИЭ также ставится диагноз церебральный паралич, может быть более полезно посмотреть на продолжительность жизни людей с церебральным параличом.
Ожидается, что люди с церебральным параличом очень легкой степени будут жить столько же, сколько их сверстники в общей популяции.В целом, ожидаемая продолжительность жизни человека с церебральным параличом зависит от степени его поражения:
- Продолжительность жизни легкого церебрального паралича : Для людей с довольно легким церебральным параличом (определяемым как ходьба без посторонней помощи) продолжительность жизни женщин оценивается в 70-80 лет, а у мужчин — в 66-76 лет.

- Продолжительность жизни тяжелого церебрального паралича : Для тех, кто более серьезно поражен (определяется как неспособность поднимать голову и получать питание через зонд), продолжительность жизни, по оценкам, была короче как для женщин, так и для мужчин, в зависимости от качество полученной медицинской помощи.
Эти цифры продолжительности жизни были взяты из исследования 2008 года, проведенного в журнале Developmental Medicine and Child Neurology . Щелкните здесь, чтобы просмотреть документ, в котором содержится подробная таблица ожидаемой продолжительности жизни людей с церебральным параличом. Он учитывает возраст, пол, подвижность и механизм кормления (3).
Более подробная информация о HIE
Для получения дополнительной информации о HIE, пожалуйста, посетите наш раздел «Медицинская информация».
О справочном центре HIE и юридических центрах ABC
Справочный центр HIE находится в ведении юридического центра ABC — юридической фирмы, занимающейся врачебной халатностью, занимающейся исключительно случаями, связанными с HIE и другими родовыми травмами. Наши юристы имеют более чем 100-летний совместный опыт работы с этим типом права и защищают интересы детей с ВИЭ и связанными с ними инвалидностями с момента основания фирмы в 1997 году.
Наши юристы имеют более чем 100-летний совместный опыт работы с этим типом права и защищают интересы детей с ВИЭ и связанными с ними инвалидностями с момента основания фирмы в 1997 году.
Мы с энтузиазмом помогаем семьям получить компенсацию, необходимую для покрытия их обширных медицинских услуг. счета, потеря заработной платы (если один или оба родителя вынуждены пропускать работу, чтобы ухаживать за своим ребенком), вспомогательные технологии и другие предметы первой необходимости.
Если вы подозреваете, что причиной ГИЭ у вашего ребенка стала халатность со стороны врача, свяжитесь с нами сегодня, чтобы узнать больше о расследовании дела.Мы предоставляем бесплатные юридические консультации, в ходе которых мы проинформируем вас о ваших юридических вариантах и ответим на любые ваши вопросы. Более того, вы не будете платить ничего на протяжении всего судебного процесса , если мы не добьемся благоприятного урегулирования.
Вы также можете обращаться к нам с запросами, не связанными с злоупотреблением служебным положением. Мы не можем предоставить индивидуальные медицинские консультации, но мы будем рады найти для вас информационные ресурсы.
Мы не можем предоставить индивидуальные медицинские консультации, но мы будем рады найти для вас информационные ресурсы.
Цитаты
- Сарнат, Х.Б. и Сарнат М.С. (1976). Энцефалопатия новорожденных после дистресса плода: клиническое и электроэнцефалографическое исследование. Архив неврологии , 33 (10), 696-705.
- (нет данных). Получено 15 января 2019 г. с сайта https://www.uptodate.com/contents/clinical-features-diagnosis-and-treatment-of-neonatal-encephalopathy
- Strauss, D., Brooks, J., Rosenbloom, L. , & Шавелле Р. (2008). Ожидаемая продолжительность жизни при церебральном параличе: обновленная информация. Медицина развития и детская неврология , 50 (7), 487-493.
Гипоксико-ишемическая энцефалопатия | CP | CerebralPalsy.orgCerebralPalsy.org
Кислородная депривация или асфиксия во время родов могут вызвать церебральный паралич. Один из наиболее распространенных типов повреждения мозга, вызванного потерей кислорода, называется гипоксически-ишемической энцефалопатией или ГИЭ. Когда происходит ГИЭ, это часто приводит к серьезным задержкам в развитии или когнитивных способностях или моторным нарушениям, которые становятся более очевидными по мере продолжения развития ребенка.
Когда происходит ГИЭ, это часто приводит к серьезным задержкам в развитии или когнитивных способностях или моторным нарушениям, которые становятся более очевидными по мере продолжения развития ребенка.
Повреждение головного мозга — недостаток кислорода в головном мозге или асфиксия
Гипоксически-ишемическая энцефалопатия, или ГИЭ, — это повреждение головного мозга, вызванное кислородным голоданием мозга, также широко известное как асфиксия во время родов.Организм новорожденного может компенсировать кратковременное истощение кислорода, но если асфиксия длится слишком долго, ткань мозга разрушается. Гипоксически-ишемическая энцефалопатия, вызванная асфиксией плода или новорожденного, является ведущей причиной смерти или тяжелых нарушений у младенцев.
Такие нарушения могут включать эпилепсию, задержку развития, двигательные нарушения, задержку нервного развития и когнитивные нарушения. Обычно степень тяжести нарушения невозможно определить, пока ребенку не исполнится три-четыре года.
Обычно степень тяжести нарушения невозможно определить, пока ребенку не исполнится три-четыре года.
Долгое время считалось, что причиной церебрального паралича является асфиксия, но два исследования показали, что только 9% случаев являются прямым результатом асфиксии. В остальных 91% случаев такие факторы, как преждевременные роды, родовые осложнения или проблемы сразу после родов, вызывают церебральный паралич. В некоторых случаях причину невозможно установить окончательно.
Когда возникает гипоксически-ишемическая энцефалопатия?
Гипоксико-ишемическая энцефалопатия чаще всего встречается у доношенных детей, хотя также встречается и у недоношенных.Сроки и тяжесть асфиксии могут повлиять на область мозга, которая получила травму. Если повреждение происходит до 35 недели внутриутробного развития, гипоксически-ишемическая энцефалопатия, вероятно, приведет к перивентрикулярной лейкомаляции, или ПВЛ.
На 40 неделе степень гипоксии коррелирует с областью поврежденного мозга; легкая гипоксия влияет на парасагиттальное белое вещество, в то время как тяжелая гипоксия влияет на скорлупу, таламус и парацентральное белое вещество. Пораженная область мозга в значительной степени влияет на симптомы, которые испытывает ребенок.
Пораженная область мозга в значительной степени влияет на симптомы, которые испытывает ребенок.
Каковы факторы риска и причины гипоксически-ишемической энцефалопатии?
Асфиксия — наиболее значительный фактор риска ГИЭ. Степень и продолжительность кислородного голодания влияют на возникновение гипоксически-ишемической энцефалопатии и ее тяжесть. События, которые приводят к асфиксии, включают, но не ограничиваются:
- Острая гипотензия у матери
- Кровь, содержащая меньше кислорода из-за плохой работы легких
- Сердечные осложнения
- Травма из-за диспропорции головного и таза
- Травма от осложнения пуповины
- Нарушение кровоснабжения головного мозга при родах
- Прерывание дыхания или недостаточная подача кислорода
- Внутриродовое кровотечение
- Халатность по медицинским показаниям
- Выпуклый шнур
- Отслойка плаценты
- Давление на череп, изменяющее его форму, что приводит к кровотечению или снижению кровотока
- Разрыв предлежания сосудов
- Напряжение труда и родоразрешение
- Травма
- Разрыв матки
Инсульт плода также увеличивает вероятность возникновения гипоксически-ишемической энцефалопатии. Факторы, которые могут привести к инсульту плода, включают:
Факторы, которые могут привести к инсульту плода, включают:
- Нарушения свертываемости крови
- Блокировка кровотока в плаценте
- Деформированные или слабые кровеносные сосуды, которые могут разорваться
- Высокое или низкое кровяное давление матери
- Инфекция матери, особенно воспалительные заболевания органов малого таза
Как диагностируется гипоксически-ишемическая энцефалопатия?
При подозрении на гипоксически-ишемическую энцефалопатию для диагностики используются методы нейровизуализации, особенно МРТ.Новые методы, включая диффузионно-взвешенную визуализацию и МР-спектроскопию, считаются эффективными при использовании в соответствующие временные рамки.
Для проведения этих тестов врачи должны сначала заподозрить гипоксически-ишемическую энцефалопатию. Если роды были травматическими или если во время беременности был известен значительный фактор риска, такой как инсульт плода, при рождении можно заподозрить гипоксически-ишемическую энцефалопатию. В противном случае родители, врачи и опекуны замечают видимые признаки — нарушение двигательной функции, задержку этапов развития и задержку роста посредством клинического наблюдения с течением времени.Указание уровня серьезности предоставляется, когда можно точно оценить когнитивное развитие.
В противном случае родители, врачи и опекуны замечают видимые признаки — нарушение двигательной функции, задержку этапов развития и задержку роста посредством клинического наблюдения с течением времени.Указание уровня серьезности предоставляется, когда можно точно оценить когнитивное развитие.
Определенные признаки могут появиться вскоре после рождения. Дисфункция органов, особенно сердца, легких, почек, печени и крови, указывает на возможную ГИЭ. Судороги в первые 24 часа жизни также могут указывать на возможность гипоксически-ишемической энцефалопатии.
Существует три уровня гипоксически-ишемической энцефалопатии: легкая, умеренная и тяжелая.
Необходимо соблюдать осторожность, чтобы исключить несколько нейродегенеративных и метаболических состояний, которые медленно прогрессируют и имитируют церебральный паралич.
Как лечится гипоксически-ишемическая энцефалопатия?
Лечение гипоксически-ишемической энцефалопатии направлено на то, чтобы помочь ребенку адаптироваться к симптомам, возникающим в результате травмы головного мозга. Физическая и профессиональная терапия обычно используются для лечения церебрального паралича, вызванного гипоксически-ишемической энцефалопатией.
Физическая и профессиональная терапия обычно используются для лечения церебрального паралича, вызванного гипоксически-ишемической энцефалопатией.
Асфиксия обычно вызывает необратимые повреждения, которые иногда продолжают прогрессировать даже после того, как асфиксия прошла. Чтобы предотвратить дальнейшие повреждения, ребенок может находиться под наблюдением врача по телефону:
- Поддерживать нормальный уровень глюкозы в крови
- Поддерживать нормальное артериальное давление
- Профилактика приступов или борьба с ними
- Предотвратить или минимизировать отек мозга
Как предотвратить гипоксически-ишемическую энцефалопатию?
Лучший способ предотвратить ГИЭ — исключить асфиксию во время беременности и родов.Осведомленность о факторах риска гипоксически-ишемической энцефалопатии может помочь родителям и медицинскому персоналу предотвратить возможные осложнения и подготовиться к ним.
Меры профилактики, которые необходимо предпринять во время беременности и во время родов, включают:
- Узнайте о важности электронного мониторинга плода во время родов
- Подтвердить, что практикующие врачи, выбранные для участия в процессе родов, обладают квалификацией для наблюдения за беременностью и родами
- Предоставить персоналу конкретные медицинские консультации и личные предпочтения по прибытии в больницу, особенно если врач матери недоступен.
- Подтвердите наличие квалифицированного, сертифицированного и должным образом обученного акушера и анестезиолога во время родов
- Понимать права пациента, особенно право на второе мнение, право не спешить с трудным решением, когда в этом нет необходимости, и право запрашивать личные медицинские записи
Причина: Уточнение терминологии
Поскольку используемая терминология настолько специфична, но в то же время удивительно похожа, такие термины, как дефект мозга, порок развития мозга и поражение мозга, могут показаться запутанными. При попытке понять причину церебрального паралича полезно знать разницу между терминами.
При попытке понять причину церебрального паралича полезно знать разницу между терминами.
Развитие мозга начинается вскоре после зачатия. Относительно небольшое количество клеток делится и умножается на миллиарды клеток. Небольшая полоска ткани сворачивается в нервную трубку. Один конец переходит в мозг, другой — в спинной мозг. Повсюду разные типы клеток образуются, группируются и мигрируют, образуя различные области мозга. Мозг считается полностью развитым через два-пять лет после рождения.
Дефекты мозга — это нарушения в структуре мозга, которые обычно вызывают нарушения. Дефекты могут возникать в результате уродства, травмы, болезни или болезни. Степень нарушения часто связана с серьезностью повреждения. Мозг иногда компенсирует дефекты, по сути, «перестраивая», чтобы обойти или компенсировать поврежденные области. По этой причине обычно рекомендуется начинать лечение как можно раньше.
Пороки развития головного мозга — это дефекты, которые возникают в результате аномального развития мозга. Хотя дефекты могут возникнуть в любое время во время развития плода, в первые 20 недель ребенок наиболее уязвим; любая аномалия, возникающая при формировании нервной трубки, может иметь необратимые последствия. Пороки развития головного мозга могут привести к неразвитым областям, аномальному росту, порокам развития или неправильному разделению мозга на полушария и доли.
Хотя дефекты могут возникнуть в любое время во время развития плода, в первые 20 недель ребенок наиболее уязвим; любая аномалия, возникающая при формировании нервной трубки, может иметь необратимые последствия. Пороки развития головного мозга могут привести к неразвитым областям, аномальному росту, порокам развития или неправильному разделению мозга на полушария и доли.
Поражения головного мозга — это дефекты, возникшие в результате травмы или болезни. Причины поражения головного мозга во время внутриутробного развития включают кровотечение в головном мозге, инфекции, токсины, асфиксию и многие другие.Поражения обычно возникают в результате инцидента или события, которое приводит к отмиранию ткани мозга. Отверстия, которые часто заполняются жидкостью, остаются для образования кист.
Перинатальная гипоксически-ишемическая энцефалопатия
Перинатальная гипоксико-ишемическая энцефалопатия (ГИЭ) является важной причиной травм головного мозга у новорожденных и может иметь долгосрочные разрушительные последствия. Перинатальная гипоксия является жизненно важной причиной долгосрочных неврологических осложнений, варьирующихся от легких поведенческих нарушений до тяжелых припадков, умственной отсталости и / или церебрального паралича у новорожденных.В развивающемся мозге млекопитающих продолжающиеся исследования патофизиологического механизма повреждения нейронов и терапевтической стратегии после перинатальной гипоксии все еще ограничены. С появлением многообещающей терапии гипотермии при ГИЭ в данной статье рассматривается патофизиология ГИЭ и будущие потенциальные нейропротективные стратегии с учетом клинического потенциала больных гипоксией.
Перинатальная гипоксия является жизненно важной причиной долгосрочных неврологических осложнений, варьирующихся от легких поведенческих нарушений до тяжелых припадков, умственной отсталости и / или церебрального паралича у новорожденных.В развивающемся мозге млекопитающих продолжающиеся исследования патофизиологического механизма повреждения нейронов и терапевтической стратегии после перинатальной гипоксии все еще ограничены. С появлением многообещающей терапии гипотермии при ГИЭ в данной статье рассматривается патофизиология ГИЭ и будущие потенциальные нейропротективные стратегии с учетом клинического потенциала больных гипоксией.
1. Введение
Перинатальная гипоксически-ишемическая энцефалопатия (ГИЭ) встречается у одного-трех на 1000 доношенных живых детей [1].Из пораженных новорожденных 15-20% пораженных новорожденных умрут в послеродовой период, и еще у 25% разовьются тяжелые и постоянные нейропсихологические последствия, включая умственную отсталость, зрительно-моторную или зрительную перцептивную дисфункцию, повышенную гиперактивность, церебральный паралич и эпилепсия [2]. Последствия ОВЗ разрушительны и необратимы, что делает его тяжелым бременем для пациента, семьи и общества. Крайне важно определить и разработать терапевтические стратегии для уменьшения травм головного мозга у новорожденных с ГИЭ.Патофизиологию перинатального ГИЭ трудно изучить на людях, поэтому для моделирования этого состояния человека была разработана модель неонатальной крысиной травмы головного мозга ГИ. Многое из того, что нам известно, получено в результате исследований, проведенных на моделях животных. Грызуны были наиболее часто используемыми животными в исследованиях HIE, за ними следовали поросята и овцы [3].
Последствия ОВЗ разрушительны и необратимы, что делает его тяжелым бременем для пациента, семьи и общества. Крайне важно определить и разработать терапевтические стратегии для уменьшения травм головного мозга у новорожденных с ГИЭ.Патофизиологию перинатального ГИЭ трудно изучить на людях, поэтому для моделирования этого состояния человека была разработана модель неонатальной крысиной травмы головного мозга ГИ. Многое из того, что нам известно, получено в результате исследований, проведенных на моделях животных. Грызуны были наиболее часто используемыми животными в исследованиях HIE, за ними следовали поросята и овцы [3].
2. Гестационный и хронологический возраст
Невропатологические особенности перинатального ГИЭ значительно различаются в зависимости от гестационного возраста младенца, природы инсульта и типов вмешательства.Исследования влияния гипоксемии на энергетический метаболизм головного мозга в незрелом мозге крысы очертили определенное окно уязвимости, характеризующееся большей уязвимостью во вторую постнатальную неделю, сравнимую с человеческим мозгом в срок, чем в первую постнатальную неделю, сравнимым с человеческий преждевременный мозг. Кроме того, на основании доказательств большей устойчивости мозгового энергетического метаболизма и большей продолжительности выживания в незрелом мозге, чем в мозге взрослого человека, подвергшегося асфиксии, существует давнее общее представление о том, что перинатальный мозг более терпим к асфиксии, чем мозг взрослого [4, 5].Однако нейропатологические исследования показывают, что многие критические нейрональные группы более уязвимы к повреждению HI у неполовозрелых животных, особенно в связи с повышенной плотностью и функцией возбуждающих аминокислотных рецепторов и повышенной уязвимостью к атакам со стороны активных форм кислорода (АФК) и активных форм азота ( РНС) [5].
Кроме того, на основании доказательств большей устойчивости мозгового энергетического метаболизма и большей продолжительности выживания в незрелом мозге, чем в мозге взрослого человека, подвергшегося асфиксии, существует давнее общее представление о том, что перинатальный мозг более терпим к асфиксии, чем мозг взрослого [4, 5].Однако нейропатологические исследования показывают, что многие критические нейрональные группы более уязвимы к повреждению HI у неполовозрелых животных, особенно в связи с повышенной плотностью и функцией возбуждающих аминокислотных рецепторов и повышенной уязвимостью к атакам со стороны активных форм кислорода (АФК) и активных форм азота ( РНС) [5].
2.1. Основная нейропатология
Развитие травмы головного мозга после инсульта HI — это развивающийся процесс, имитируемый во время острого инсульта и переходящий в фазу реперфузии.Основным патогенетическим механизмом, лежащим в основе неврологического повреждения при ГИЭ в результате гипоксемии / ишемии или того и другого, является лишение поступления глюкозы и кислорода, которое вызывает сбой первичной энергии и запускает каскад биохимических событий, ведущих к дисфункции клеток и, в конечном итоге, к гибели клеток [6, 7] . Последующее реперфузионное повреждение часто ухудшает метаболизм мозга за счет увеличения повреждения, вызванного окислительным стрессом. Подчеркивается особая роль в увеличении внеклеточного глутамата, чрезмерной активации рецепторов глутамата (эксайтотоксичность), увеличении цитозольного кальция (Ca 2+ ) и генерации свободных радикалов.
Последующее реперфузионное повреждение часто ухудшает метаболизм мозга за счет увеличения повреждения, вызванного окислительным стрессом. Подчеркивается особая роль в увеличении внеклеточного глутамата, чрезмерной активации рецепторов глутамата (эксайтотоксичность), увеличении цитозольного кальция (Ca 2+ ) и генерации свободных радикалов.
Были идентифицированы временные аспекты изменений глюкозы и энергетического метаболизма после инсульта HI, включая отказ первичной энергии и отказ вторичной энергии [8–13]. Сразу после поражения HI первичная энергетическая недостаточность, истощение кислорода предотвращает окислительное фосфорилирование (уменьшение высокоэнергетических фосфорилированных соединений, таких как АТФ и фосфокреатин) и приводит к переключению на анаэробный метаболизм, вызывая накопление лактата и связанного с ним H + .Накопление лактата и связанного с ним H + изначально полезно для адаптации к кислородной недостаточности, но позже, по мере прогрессирования образования лактата, оно оказывает пагубное влияние на (1) нарушение ауторегуляции сосудов, потенциал для серьезного ишемического повреждения, ( 2) ингибирование активности фосфофруктокиназы при низком pH и (3) биохимический каскад, приводящий к повреждению клеток [8]. Возникновение вторичного энергетического сбоя варьируется в зависимости от вида и характера повреждения, начиная с 8–16 часов и заканчивая надиром через 24–48 часов.Уровни высокоэнергетического фосфата восстановились до исходного уровня через 2–3 часа после реперфузии и реоксигенации, а второе снижение уровня высокоэнергетического фосфата было выражено в следующие 48 часов [9, 11, 12].
Возникновение вторичного энергетического сбоя варьируется в зависимости от вида и характера повреждения, начиная с 8–16 часов и заканчивая надиром через 24–48 часов.Уровни высокоэнергетического фосфата восстановились до исходного уровня через 2–3 часа после реперфузии и реоксигенации, а второе снижение уровня высокоэнергетического фосфата было выражено в следующие 48 часов [9, 11, 12].
Первоначальное снижение уровня высокоэнергетического фосфата запускает ряд дополнительных механизмов, начиная с отказа АТФ-зависимого насоса Na + -K + . Отказ трансцеллюлярной ионной помпы приводит к внутриклеточному накоплению Na + , Ca 2+ и воды (цитотоксический отек) с последующей деполяризацией мембраны, чрезмерным высвобождением возбуждающих нейромедиаторов, в частности глутамата, увеличением цитозольного Ca 2+ , активация фосфолипазы и образование свободных радикалов.В течение последних двух десятилетий замечательные исследования продемонстрировали критическую роль глутамата как медиатора гибели нейронов при инсульте HI [14–16]. Глутамат является преобладающим возбуждающим аминокислотным нейромедиатором в головном мозге и имеет 3 основных типа ионотропных рецепторов, NMDA, AMPA и KA, а также группу метаботропных рецепторов глутамата, связанных с G-белком, которые присутствуют в большинстве нейронов и глии. Обычно глутамат-ионотропные рецепторы работают сообща в стабилизации синапсов и демонстрируют последовательное участие в зависимой от активности пластичности нейронов и возбуждении нейронов для выполнения обычных задач, таких как обучение и память.Однако их жизненно важная роль и улучшенная функция в перинатальном периоде также делают нейроны более уязвимыми для эксайтотоксичности. Концентрации внеклеточного глутамата многократно увеличиваются при поражении HI [17–19], а специфические блокаторы каналов рецептора глутамата улучшают повреждение головного мозга при HIE [20]. Онтогенез глутамата, кратковременная плотная экспрессия рецепторов NMDA и GluR2-дефицитных рецепторов AMPA, имеет отношение к уязвимости незрелых областей мозга к гибели эксайтотоксических клеток при ГИЭ [21, 22].
Глутамат является преобладающим возбуждающим аминокислотным нейромедиатором в головном мозге и имеет 3 основных типа ионотропных рецепторов, NMDA, AMPA и KA, а также группу метаботропных рецепторов глутамата, связанных с G-белком, которые присутствуют в большинстве нейронов и глии. Обычно глутамат-ионотропные рецепторы работают сообща в стабилизации синапсов и демонстрируют последовательное участие в зависимой от активности пластичности нейронов и возбуждении нейронов для выполнения обычных задач, таких как обучение и память.Однако их жизненно важная роль и улучшенная функция в перинатальном периоде также делают нейроны более уязвимыми для эксайтотоксичности. Концентрации внеклеточного глутамата многократно увеличиваются при поражении HI [17–19], а специфические блокаторы каналов рецептора глутамата улучшают повреждение головного мозга при HIE [20]. Онтогенез глутамата, кратковременная плотная экспрессия рецепторов NMDA и GluR2-дефицитных рецепторов AMPA, имеет отношение к уязвимости незрелых областей мозга к гибели эксайтотоксических клеток при ГИЭ [21, 22]. Присутствие субъединицы GluR2 делает рецепторы AMPA непроницаемыми для кальция. Приблизительное время максимальной чувствительности эксайтотоксичности у крыс составляет 6 дней для NMDA и 9-10 дней для AMPA, что соответствует недоношенным людям и доношенным новорожденным соответственно [23, 24]. Более того, топография глутаматных синапсов, ранняя экспрессия глутаматных рецепторов в человеческом гиппокампе, коре головного мозга и глубоких ядерных структурах аналогична регионам, уязвимым к повреждению HI у новорожденных [18, 19, 25]. Повышение концентрации внеклеточного глутамата и активация рецепторов глутамата после гипоксии-ишемии запускает эксайтотоксический каскад.Происходит увеличение цитозольного Ca 2+ за счет притока через открытые NMDA и кальций-проницаемые каналы рецепторов AMPA и другие потенциал-зависимые каналы Ca 2+ , а также высвобождение кальция из внутриклеточных запасов. Вредные эффекты повышенного содержания кальция в цитозоле включают активацию нейрональной синтазы оксида азота (nNOS) с образованием оксида азота, образование свободных радикалов и деградацию клеточных липидов путем активации фосфолипаз, клеточных белков путем активации протеазы и клеточной ДНК.
Присутствие субъединицы GluR2 делает рецепторы AMPA непроницаемыми для кальция. Приблизительное время максимальной чувствительности эксайтотоксичности у крыс составляет 6 дней для NMDA и 9-10 дней для AMPA, что соответствует недоношенным людям и доношенным новорожденным соответственно [23, 24]. Более того, топография глутаматных синапсов, ранняя экспрессия глутаматных рецепторов в человеческом гиппокампе, коре головного мозга и глубоких ядерных структурах аналогична регионам, уязвимым к повреждению HI у новорожденных [18, 19, 25]. Повышение концентрации внеклеточного глутамата и активация рецепторов глутамата после гипоксии-ишемии запускает эксайтотоксический каскад.Происходит увеличение цитозольного Ca 2+ за счет притока через открытые NMDA и кальций-проницаемые каналы рецепторов AMPA и другие потенциал-зависимые каналы Ca 2+ , а также высвобождение кальция из внутриклеточных запасов. Вредные эффекты повышенного содержания кальция в цитозоле включают активацию нейрональной синтазы оксида азота (nNOS) с образованием оксида азота, образование свободных радикалов и деградацию клеточных липидов путем активации фосфолипаз, клеточных белков путем активации протеазы и клеточной ДНК. активацией нуклеаз, а также усилением митохондриальных повреждений [26–28].Проницаемость внешней мембраны митохондрий, в свою очередь, вызывает высвобождение митохондриями цитохрома С, активацию расщепления каспаз 9 и 3 и фактора, индуцирующего апоптоз (AIF), что приводит к апоптозу [29]. Комбинированные эффекты энергетической недостаточности клетки, ацидоза, высвобождения глутамата, внутриклеточного накопления Ca 2+ , перекисного окисления липидов и нейротоксичности оксида азота служат для разрушения основных компонентов клетки с ее окончательной гибелью. Механизм гибели нейрональных клеток после гипоксии-ишемии включает некроз нейронов и апоптоз, в зависимости, главным образом, от тяжести поражения и состояния созревания клетки.Существует континуум некроза и апоптоза, и часто ранняя гибель клеток проявляется некротической, а более поздняя гибель клеток проявляется апоптозом [30, 31]. Первоначальное снижение уровня высокоэнергетических фосфатов приведет к нарушению АТФ-зависимого насоса Na + -K + , который при тяжелом поражении вызывает острый приток Na + , Cl — и воды с последующим набухание клеток, лизис клеток и, следовательно, ранняя гибель клеток из-за некроза, тогда как при менее тяжелом инсульте вызывает деполяризацию мембраны, за которой следует каскад эксайтотоксичности и окислительного стресса, приводящий к отсроченной гибели клеток, в основном апоптозу.
активацией нуклеаз, а также усилением митохондриальных повреждений [26–28].Проницаемость внешней мембраны митохондрий, в свою очередь, вызывает высвобождение митохондриями цитохрома С, активацию расщепления каспаз 9 и 3 и фактора, индуцирующего апоптоз (AIF), что приводит к апоптозу [29]. Комбинированные эффекты энергетической недостаточности клетки, ацидоза, высвобождения глутамата, внутриклеточного накопления Ca 2+ , перекисного окисления липидов и нейротоксичности оксида азота служат для разрушения основных компонентов клетки с ее окончательной гибелью. Механизм гибели нейрональных клеток после гипоксии-ишемии включает некроз нейронов и апоптоз, в зависимости, главным образом, от тяжести поражения и состояния созревания клетки.Существует континуум некроза и апоптоза, и часто ранняя гибель клеток проявляется некротической, а более поздняя гибель клеток проявляется апоптозом [30, 31]. Первоначальное снижение уровня высокоэнергетических фосфатов приведет к нарушению АТФ-зависимого насоса Na + -K + , который при тяжелом поражении вызывает острый приток Na + , Cl — и воды с последующим набухание клеток, лизис клеток и, следовательно, ранняя гибель клеток из-за некроза, тогда как при менее тяжелом инсульте вызывает деполяризацию мембраны, за которой следует каскад эксайтотоксичности и окислительного стресса, приводящий к отсроченной гибели клеток, в основном апоптозу. Апоптоз более распространен как способ смерти в перинатальном мозге, и были признаны как каспазозависимые, так и независимые от каспаз механизмы апоптотической гибели клеток (Рисунок 1).
Апоптоз более распространен как способ смерти в перинатальном мозге, и были признаны как каспазозависимые, так и независимые от каспаз механизмы апоптотической гибели клеток (Рисунок 1).
Экспериментальные исследования показывают, что первое наблюдаемое изменение в нейроне — это цитоплазматическая вакуолизация, вызванная набуханием митохондрий, происходящая в течение 5-30 минут после начала гипоксии, а дифференцирующиеся олигодендроциты проявляют примерно одинаковую чувствительность к глюкозе и кислородной депривации. как и нейроны.В незрелом и зрелом мозге последовательность клеточных элементов, уязвимых для гипоксии-ишемии, — нейрон> олигодендроглия> астроцит> микроглия [32]. Юэ и др. продемонстрировали, что апоптотическая гибель нейронов преобладала среди незрелых нейронов, тогда как гибель некротических клеток преобладала среди зрелых нейронов [33]. Признак невропатологии варьирует в зависимости от возраста, как гипоксия-ишемия. Три основных региональных паттерна селективного нейронального некроза у новорожденных с ГИЭ, особенно термин новорожденные, диффузное заболевание, церебрально-глубокое ядро с заметным поражением неокортекса головного мозга, гиппокамп и базальные ганглии-таламус, а также глубокая ядерно-стволовая болезнь мозга [34, 35]. Основная форма гипоксически-ишемического повреждения головного мозга в незрелом головном мозге включает белое вещество головного мозга, вызывающее перивентрикулярную лейкомаляцию (ПВЛ), и данные указывают на причастность особой внутренней уязвимости премиелинизирующих олигодендроцитов (пре-OL), зависящей от созревания, по отношению к обоим эндогенным факторам. и экзогенные активные формы кислорода [35–37]. Незрелый мозг имеет склонность к ишемии белого вещества головного мозга из-за наличия (1) концевых и пограничных зон сосудов в этой области и (2) нарушения ауторегуляции цереброваскулярной системы [7].Ness et al. отметили переход гибели клеток в белом веществе от ранней некротической гибели к гибели гибридных клеток к классическому апоптозу между 4 и 24 часами восстановления после гипоксии-ишемии [38]. Отсроченный ход апоптоза в пред-OL поддерживает возможность вмешательств для улучшения клинических исходов новорожденных, переживших асфиксию при рождении.
Основная форма гипоксически-ишемического повреждения головного мозга в незрелом головном мозге включает белое вещество головного мозга, вызывающее перивентрикулярную лейкомаляцию (ПВЛ), и данные указывают на причастность особой внутренней уязвимости премиелинизирующих олигодендроцитов (пре-OL), зависящей от созревания, по отношению к обоим эндогенным факторам. и экзогенные активные формы кислорода [35–37]. Незрелый мозг имеет склонность к ишемии белого вещества головного мозга из-за наличия (1) концевых и пограничных зон сосудов в этой области и (2) нарушения ауторегуляции цереброваскулярной системы [7].Ness et al. отметили переход гибели клеток в белом веществе от ранней некротической гибели к гибели гибридных клеток к классическому апоптозу между 4 и 24 часами восстановления после гипоксии-ишемии [38]. Отсроченный ход апоптоза в пред-OL поддерживает возможность вмешательств для улучшения клинических исходов новорожденных, переживших асфиксию при рождении.
3. Возможные методы лечения неонатальной гипоксико-ишемической энцефалопатии
3.
 1. Поддерживающая интенсивная терапия
1. Поддерживающая интенсивная терапия Перинатальный ГИЭ — основная причина смерти и инвалидности во всем мире, которая ограничивается поддерживающей интенсивной терапией.Он включает коррекцию гемодинамических и легочных нарушений (гипотензия, метаболический ацидоз и поддержание адекватной вентиляции), коррекцию метаболических нарушений глюкозы, кальция, магния и электролитов, лечение припадков, если они есть, и мониторинг дисфункций других систем органов, таких как как острая почечная недостаточность. Поддержание адекватной вентиляции и адекватной перфузии является центральным аспектом поддерживающей терапии. Кислородная недостаточность может привести к нарушению ауторегуляции цереброваскулярной системы с последствием пассивного давления в мозговом кровообращении и увеличения дополнительных повреждений нейронов и белого вещества.Тяжелая гипероксия в первые часы жизни может способствовать усилению окислительного стресса, пагубному для долгосрочных неврологических последствий [39, 40], а также руководству Международного консенсуса 2010 г. по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи с рекомендациями по лечению (CoSTR) в Международном комитете по связи по реанимации (ILCOR) рекомендуют доношенным детям начинать реанимацию с комнатного воздуха, а не со 100% кислородом [41]. Кроме того, поддержание адекватной перфузии в мозг, более связанной с адекватным артериальным давлением, чем внутричерепным давлением, важно для предотвращения дополнительного ишемического повреждения.
по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи с рекомендациями по лечению (CoSTR) в Международном комитете по связи по реанимации (ILCOR) рекомендуют доношенным детям начинать реанимацию с комнатного воздуха, а не со 100% кислородом [41]. Кроме того, поддержание адекватной перфузии в мозг, более связанной с адекватным артериальным давлением, чем внутричерепным давлением, важно для предотвращения дополнительного ишемического повреждения.
3.2. Контроль над припадками
Наличие припадка, практически происходящего в первые часы, свидетельствует о плохом исходе ГИЭ. Следовательно, противоэпилептические препараты (ПЭП) относятся к числу препаратов, наиболее часто используемых при перинатальном ГИЭ. Энергетический метаболизм может быть нарушен гиперактивными нейронами, и как острая потеря энергии после инсульта HI, так и судороги являются причиной эксайтотоксичности. Таким образом, терапевтическая ценность AED может включать не только контроль судорожной активности, но также потенциально благоприятное воздействие на нарушенный клеточный энергетический метаболизм.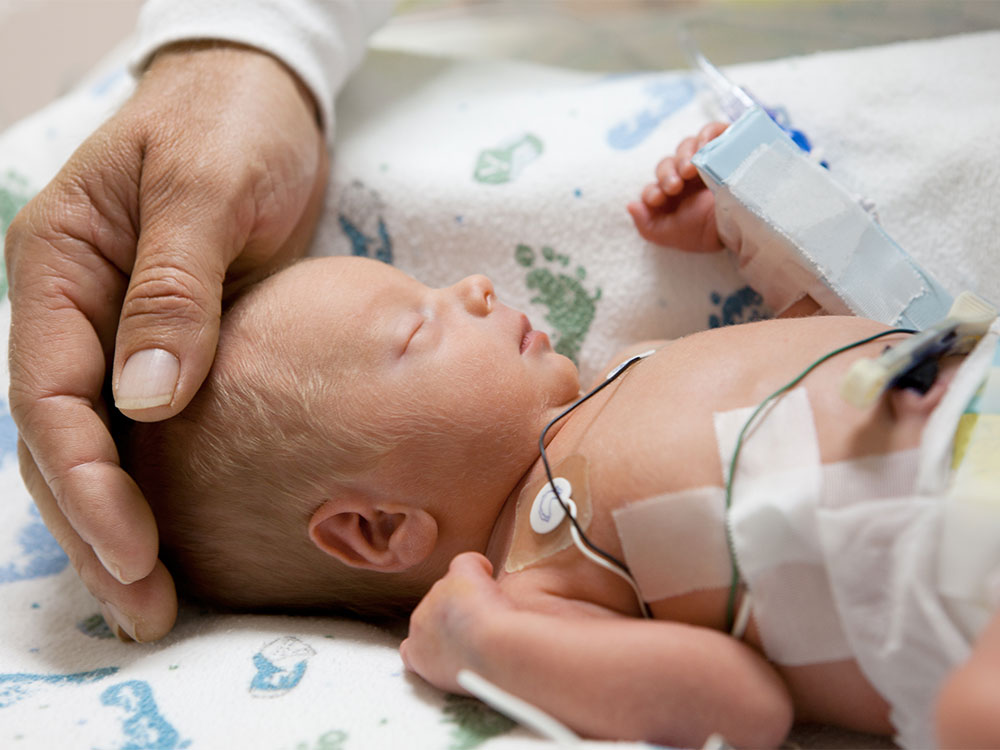 Исследования перинатального ГИЭ показали положительный эффект предварительного лечения барбитуратами [42, 43]. Фенобарбитал остается предпочтительным препаратом для лечения судорог у новорожденных с ГИЭ [7]. Вопрос о том, следует ли назначать лечение фенобарбиталом до приступов судорог, до сих пор остается спорным. Тщательное наблюдение с использованием непрерывной ЭЭГ для выявления приступов является оптимальным для лечения детей, страдающих асфиксией.
Исследования перинатального ГИЭ показали положительный эффект предварительного лечения барбитуратами [42, 43]. Фенобарбитал остается предпочтительным препаратом для лечения судорог у новорожденных с ГИЭ [7]. Вопрос о том, следует ли назначать лечение фенобарбиталом до приступов судорог, до сих пор остается спорным. Тщательное наблюдение с использованием непрерывной ЭЭГ для выявления приступов является оптимальным для лечения детей, страдающих асфиксией.
3.3. Стратегии нейрозащиты
В настоящее время не было доказано, что отдельные нейропротективные агенты безопасны и эффективны для защиты новорожденных от неврологических последствий после инсульта HI.Понимание биохимических и клеточных механизмов повреждения нейронов при перинатальном ГИЭ помогает обеспечить вмешательство, чтобы прервать эти вредные каскады, в основном сосредоточивая внимание на потенциальных эффектах акцепторов свободных радикалов, таких как N-ацетилцистеин (NAC) и аллопуринол, магний, рецептор глутамата. блокаторы, эритропоэтин (Epo) и гипотермия. NAC является акцептором свободных радикалов и, как было продемонстрировано, сводит к минимуму повреждение головного мозга, вызванное гипоксией и ишемией, на различных моделях острых состояний [44–46].Комбинированная терапия NAC и системной гипотермией улучшает объем инфаркта, экспрессию миелина после очагового повреждения HI [44]. Лечение аллопуринолом, ингибитором ксантиноксидазы и поглотителем свободных радикалов, также оказывает положительное влияние на уменьшение отека мозга и невропатологического повреждения после неонатальной ГИЭ [47]. В настоящее время считается, что эпо, главный фактор роста кроветворения, оказывает благотворное влияние на различные расстройства нервной системы, основанные на эффектах предотвращения метаболических нарушений, дегенерации нейронов и сосудов и активации воспалительных клеток [48–50].Gonzalez et al. продемонстрировали, что лечение Epo сохраняет объем полушарий мозга после окклюзионного церебрального повреждения у крыс P10 [48].
блокаторы, эритропоэтин (Epo) и гипотермия. NAC является акцептором свободных радикалов и, как было продемонстрировано, сводит к минимуму повреждение головного мозга, вызванное гипоксией и ишемией, на различных моделях острых состояний [44–46].Комбинированная терапия NAC и системной гипотермией улучшает объем инфаркта, экспрессию миелина после очагового повреждения HI [44]. Лечение аллопуринолом, ингибитором ксантиноксидазы и поглотителем свободных радикалов, также оказывает положительное влияние на уменьшение отека мозга и невропатологического повреждения после неонатальной ГИЭ [47]. В настоящее время считается, что эпо, главный фактор роста кроветворения, оказывает благотворное влияние на различные расстройства нервной системы, основанные на эффектах предотвращения метаболических нарушений, дегенерации нейронов и сосудов и активации воспалительных клеток [48–50].Gonzalez et al. продемонстрировали, что лечение Epo сохраняет объем полушарий мозга после окклюзионного церебрального повреждения у крыс P10 [48]. Другие экспериментальные исследования, касающиеся потенциальной ценности сульфата магния, показывают, что блокаторы рецепторов глутамата дают противоречивые результаты. Однако наиболее действенным и многообещающим вмешательством для предотвращения истощения энергии является переохлаждение. Экспериментально снижение температуры тела до 3–5 ° C ниже нормального уровня снижает церебральные травмы, включая снижение использования энергии мозга, уменьшение размера инфаркта и уменьшение потери нейрональных клеток и структуры гиппокампа, а также улучшает неврологические исходы после асфиксии [51 –54].Благоприятные эффекты легкой гипотермии проявляются в нескольких участках каскада, ведущего к гибели клеток. Гипотермию необходимо начинать до начала отсроченного энергетического сбоя и, в частности, возбудительных симптомов, таких как судороги [7]. Раннее индуцирование гипотермии у младенцев, перенесших ГИЭ в перинатальном периоде, улучшает выживаемость и снижает уровень инвалидности у выживших [41, 55–58].
Другие экспериментальные исследования, касающиеся потенциальной ценности сульфата магния, показывают, что блокаторы рецепторов глутамата дают противоречивые результаты. Однако наиболее действенным и многообещающим вмешательством для предотвращения истощения энергии является переохлаждение. Экспериментально снижение температуры тела до 3–5 ° C ниже нормального уровня снижает церебральные травмы, включая снижение использования энергии мозга, уменьшение размера инфаркта и уменьшение потери нейрональных клеток и структуры гиппокампа, а также улучшает неврологические исходы после асфиксии [51 –54].Благоприятные эффекты легкой гипотермии проявляются в нескольких участках каскада, ведущего к гибели клеток. Гипотермию необходимо начинать до начала отсроченного энергетического сбоя и, в частности, возбудительных симптомов, таких как судороги [7]. Раннее индуцирование гипотермии у младенцев, перенесших ГИЭ в перинатальном периоде, улучшает выживаемость и снижает уровень инвалидности у выживших [41, 55–58]. Рекомендации ILCOR CoSTR 2010 рекомендуют терапевтическую гипотермию как стандартную практику для доношенных и близких к родам детей с умеренным и тяжелым ГИЭ [41].
Рекомендации ILCOR CoSTR 2010 рекомендуют терапевтическую гипотермию как стандартную практику для доношенных и близких к родам детей с умеренным и тяжелым ГИЭ [41].
4. Заключение
Гипоксия-ишемия в перинатальном периоде является основной причиной неонатальной смертности и длительной нетрудоспособности. За последние два десятилетия достигнуты успехи в исследовании клеточных процессов и молекулярных механизмов, лежащих в основе ГИЭ. В настоящее время гипотермия является единственным эффективным методом лечения ГИЭ у новорожденных. Ожидается, что комбинированная терапия гипотермии и других нейрозащитных стратегий, направленная на предотвращение острых травм, увеличение терапевтического временного окна и усиление восстановления нервной системы, улучшит неврологические исходы ГИЭ.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Границы | Неонатальная энцефалопатия: необходимость распознавания множественной этиологии для оптимального ведения
Введение
Неонатальная энцефалопатия (NE) — сложное заболевание новорожденного, которое характеризуется измененным уровнем сознания, судорогами, плохим тонусом, неспособностью инициировать или поддерживать дыхание (1) и связано с полиорганной дисфункцией (2). Заболеваемость NE оценивается в 3 случая на 1000 живорождений (3). NE может быть результатом широкого спектра причин и является клиническим термином, не определяющим этиологию. Единственное доступное лечение — это терапевтическая гипотермия (ТГ) с максимальным эффектом, если начать в первые 6 часов жизни (4). Существует несколько причин НЭ, таких как гипоксическая ишемическая энцефалопатия (ГИЭ), перинатальные инфекции, аномалии плаценты, метаболические нарушения, коагулопатии и сосудистый инсульт новорожденных (рис. 1). Однако более чем в половине случаев причина НЭ остается неустановленной (5).
Заболеваемость NE оценивается в 3 случая на 1000 живорождений (3). NE может быть результатом широкого спектра причин и является клиническим термином, не определяющим этиологию. Единственное доступное лечение — это терапевтическая гипотермия (ТГ) с максимальным эффектом, если начать в первые 6 часов жизни (4). Существует несколько причин НЭ, таких как гипоксическая ишемическая энцефалопатия (ГИЭ), перинатальные инфекции, аномалии плаценты, метаболические нарушения, коагулопатии и сосудистый инсульт новорожденных (рис. 1). Однако более чем в половине случаев причина НЭ остается неустановленной (5).
Рисунок 1 . Многофакторная этиология неонатальной энцефалопатии. Многие факторы предрасполагают к возникновению неонатальной энцефалопатии по отдельности или в комбинации, включая (A) Факторы риска до зачатия, (B) Материнские сопутствующие заболевания или события в дородовой / интранатальный период, (C) Плацентарная патология, (D) Гипоксия-ишемия, (E) Перинатальная инфекция, (F) Неонатальный инсульт или тромбофилия, (G) Метаболические нарушения и (H) Генетические и эпигенетические аномалии. ПРОМ, длительный разрыв плодных оболочек; ЗВУР, ограничение внутриутробного развития.
ПРОМ, длительный разрыв плодных оболочек; ЗВУР, ограничение внутриутробного развития.
Использование термина NE vs. HIE является спорным. Было предложено использовать термин NE для доношенных и поздних недоношенных новорожденных, у которых не было выявленных дозорных событий (6, 7). Трудно доказать наличие церебральной гипоксической ишемии, за исключением моделей на животных и конкретных случаев неонатального инсульта. Все текущие параметры, включая pH и судороги, неспецифичны (7). Некоторые из паттернов черепно-мозговых травм, наблюдаемых у пациентов с NE, могут быть воспроизведены на животных моделях с помощью гипоксии-ишемии, но это не доказывает, что все NE вызваны HIE (7).Несколько опубликованных популяционных исследований показали, что факторы риска до родов и неасфиксии связаны с НЭ (6). Напротив, некоторые авторы утверждают, что ГИЭ является причиной НЭ в 50–80% случаев на основании клинических критериев, критериев ЭЭГ и МРТ (1). Поэтому в этом обзоре мы использовали термин NE, и мы стремились рассмотреть различные этиологии, связанные с NE.
Материнские факторы
Материнская гипертензия (16%) была важным фактором дородового риска НЭ в реестре неонатальной энцефалопатии Оксфордской сети штата Вермонт ( n = 4 165).Также была более высокая частота клинического хориоамнионита, длительного разрыва плодных оболочек и гипотиреоза матери. Хотя острый асфиксический эпизод был зарегистрирован в 15% случаев, связь с воспалением была обнаружена в 24% (5).
Популяционное исследование в Западной Австралии показало, что социально-экономический статус, семейный анамнез приступов, неврологические проблемы и зачатие после лечения бесплодия были независимыми факторами риска до зачатия для NE ( n = 164) (8).Заболевание щитовидной железы матери, кровотечение во время беременности, вирусные заболевания, преэклампсия, аномальная плацента, ограничение внутриутробного развития и переношенность были другими важными факторами риска до родов (8). Выявленные дородовые факторы риска NE были обнаружены в 69% случаев, внутриродовые факторы риска — в 5%, как дородовые, так и во время родов — в 24% и отсутствие фактора риска — в 2%. Только в 4% случаев внутриродовая гипоксия была выявлена без каких-либо факторов риска до родов или до зачатия (9). Было обнаружено, что ограничение роста в развитых странах и беременность двойней в развивающихся странах связаны с НЭ.Заболевание щитовидной железы у матери, дородовое наблюдение, инфекция, роды и тактика ведения родов должны быть важными модификаторами в исследовании 27 новорожденных с NE и 100 контрольных детей (3). Дородовые (74 против 18%), внутриродовые (67 против 19%) и острые внутриродовые события (33 против 2%) более вероятны у младенцев с НЭ по сравнению с контрольной группой. Следовательно, в неонатальном клиническом анамнезе подробный материнский анамнез важен и может быть путем к профилактическим стратегиям в будущем.
Только в 4% случаев внутриродовая гипоксия была выявлена без каких-либо факторов риска до родов или до зачатия (9). Было обнаружено, что ограничение роста в развитых странах и беременность двойней в развивающихся странах связаны с НЭ.Заболевание щитовидной железы у матери, дородовое наблюдение, инфекция, роды и тактика ведения родов должны быть важными модификаторами в исследовании 27 новорожденных с NE и 100 контрольных детей (3). Дородовые (74 против 18%), внутриродовые (67 против 19%) и острые внутриродовые события (33 против 2%) более вероятны у младенцев с НЭ по сравнению с контрольной группой. Следовательно, в неонатальном клиническом анамнезе подробный материнский анамнез важен и может быть путем к профилактическим стратегиям в будущем.
Из 45 новорожденных с NE 36% имели дозорные эпизоды, 40% имели хориоамнионит и 11% имели оба этих заболевания.Если данные дозорных событий были исключены, то возраст матери> 35 лет (ОР 2,5; 95% ДИ 1,1–5,6) и инфекция мочевыводящих путей во время беременности (ОР 2,6; 95% ДИ 1,0–6,5) были потенциальными факторами дородового риска для NE (10).
Гипоксия-ишемия
Хотя концепция гипоксии-ишемии четко выражена в моделях на животных, она не может быть подходящей терминологией для использования во всех случаях неонатальной NE у человека. «Дозу» и продолжительность гипоксии, а также степень ишемии можно непосредственно измерить на животной модели.Однако у новорожденных людей это неизвестно, если нет контрольного события, и впоследствии не используются суррогатные маркеры гипоксии. Badawi et al. показали, что асфиксия во время родов считается сопутствующим фактором в 29% случаев НЭ и самостоятельным фактором только в 4% случаев (9). Было обнаружено, что внутриродовая гипоксия-ишемия является одним из факторов, способствующих развитию НЭ в 30% случаев в развитых и 60% в развивающихся странах (3). Американский колледж акушеров и Американская академия педиатрии определили дозорное событие в своем документе о неонатальной энцефалопатии и неврологических исходах (Obstet Gynecol 2014).Следующее соответствует острому пери- или интранатальному событию: дозорное гипоксическое или ишемическое событие, происходящее непосредственно перед или во время родов и родоразрешения, например разрыв матки или тяжелая отслойка плаценты; паттерны пульсометра плода, соответствующие острым послеродовым или интранатальным событиям; сроки и тип травм головного мозга, основанные на исследованиях изображений, согласующихся с этиологией острого послеродового или внутриродового события, и отсутствуют доказательства других проксимальных или дистальных факторов, которые могли бы способствовать этому. Кроме того, сочетание низких баллов по шкале Апгарса, ацидемии, аномального кардиотокографа, изменений МРТ, согласующихся с гипоксией-ишемией и полиорганной дисфункцией, — все это связано с гипоксически-ишемической этиологией, но в равной степени может быть изменено сепсисом или другими причинами NE. Асфиксичные родовые явления и воспаление присутствовали только в 12,6% случаев церебрального паралича (11). У новорожденных с NE ( n, = 405) следующие факторы были независимо связаны с NE ( p -значение = 0,001), включая: только 1 дородовой период (гестационный возраст> 41 недели) и 7 факторов во время родов, включая длительный разрыв плодных оболочек, аномальные кардиотокограф, толстый меконий, дозорные события, дистоция плеча, тугая затылочная нить и отказ вакуума (12).В когорте из 26 новорожденных с дозорным явлением NE (aOR 74,9, 95% ДИ 11,9-бесконечность, p <0,001) и отслеживание ЧСС плода категории 3 (28,0% против 4,0%, p = 0,002) были сильно выражены.
Кроме того, сочетание низких баллов по шкале Апгарса, ацидемии, аномального кардиотокографа, изменений МРТ, согласующихся с гипоксией-ишемией и полиорганной дисфункцией, — все это связано с гипоксически-ишемической этиологией, но в равной степени может быть изменено сепсисом или другими причинами NE. Асфиксичные родовые явления и воспаление присутствовали только в 12,6% случаев церебрального паралича (11). У новорожденных с NE ( n, = 405) следующие факторы были независимо связаны с NE ( p -значение = 0,001), включая: только 1 дородовой период (гестационный возраст> 41 недели) и 7 факторов во время родов, включая длительный разрыв плодных оболочек, аномальные кардиотокограф, толстый меконий, дозорные события, дистоция плеча, тугая затылочная нить и отказ вакуума (12).В когорте из 26 новорожденных с дозорным явлением NE (aOR 74,9, 95% ДИ 11,9-бесконечность, p <0,001) и отслеживание ЧСС плода категории 3 (28,0% против 4,0%, p = 0,002) были сильно выражены. связанный с NE (13). В когорте из 45 новорожденных у 36% были дозорные события, а у 11% были как дозорные, так и хориоамнионит (10).
связанный с NE (13). В когорте из 45 новорожденных у 36% были дозорные события, а у 11% были как дозорные, так и хориоамнионит (10).
Нейровизуализация с использованием магнитно-резонансной томографии, стандартной, диффузионной и спектроскопии от 24 до 96 часов жизни дает полезные рекомендации относительно возможных сроков возникновения церебрального инсульта, особенно диффузных аномалий.Аномалии, вызванные травмой головного мозга, становятся наиболее очевидными через 7 дней при использовании качественной МРТ, диффузии и спектроскопии. Глубокое ядерное серое вещество или водораздел кортикального повреждения развиваются по четко определенному типу повреждения мозга и типичны для гипоксически-ишемического повреждения мозга у новорожденного. Генетические и метаболические причины могут быть исследованы, если на МРТ существует другая картина повреждения мозга или эволюции повреждения. Признаки того, что послеродовая гипоксия-ишемия не являлась причиной НЭ, предлагаются на МРТ: порэнцефалия, очаговый артериальный инфаркт, венозный инфаркт, изолированное внутрипаренхиматозное или внутрижелудочковое кровоизлияние или атипичные паттерны метаболических энцефалопатий.
При NE, ассоциированном с острым дозорным событием (HIE), типичная картина повреждения на МРТ показала вовлечение базальных ганглиев, таламуса с ассоциированной задней конечностью внутренней капсулы и в тяжелых случаях вовлечение ствола мозга (14). При NE без задокументированного дозорного события вовлечение базальных ганглиев или таламуса (BGT) также связано с изменениями белого вещества в 50% случаев (14). BGT с обширным повреждением белого вещества (WM) был обнаружен в 14%, BGT с WM от легкой до умеренной — в 56%, изолированное таламическое повреждение — в 5%, умеренное повреждение WM — только у 2% и легкое WM или нормальное — у 23% у 48. младенцы с ГИЭ.Внутренняя капсула была аномальной у 93% пациентов с умеренным и тяжелым повреждением WM и была связана со смертью и ХП у 86% пациентов (15).
Картина повреждения головного мозга может указывать на возможную причину, например, повреждение кортикального слоя и белого вещества (очаговое / мультифокальное) может быть связано с плацентарной недостаточностью и хориоамнионитом. Ранняя категоризация пациентов в соответствии с типом травмы головного мозга может привести к другому терапевтическому подходу, поскольку на животных моделях было показано, что разные уровни гипотермии защищают от повреждения коры головного мозга или глубокого серого вещества, поэтому для достижения максимальной пользы могут потребоваться специфические для пациента протоколы гипотермии.Точно так же в моделях на животных разные режимы охлаждения, системное и селективное, приводят к разной температуре мозга (16).
Трудно окончательно установить наличие, продолжительность и степень гипоксии и ишемии у новорожденных, и были использованы суррогатные маркеры, такие как pH и судороги (7). Следовательно, биомаркеры полиорганного поражения могут быть полезны для диагностики или оценки тяжести гипоксической ишемии и прогнозирования исхода при NE. Сердечный тропонин является маркером ишемии миокарда у новорожденных и детей и высвобождается из миоцитов после повреждения их мембраны.Сердечный тропонин I (cTnI) был значительно выше у новорожденных с ГИЭ в первые 48 часов по сравнению с контрольной группой ( p <0,0005) (17). Сердечный TnI был увеличен у новорожденных с более высокой степенью НЭ и у тех, кому потребовались инотропы (18). Пороговое значение <0,22 нг / мл для нормотермических и <0,15 нг / мл для гипотермических младенцев с NE прогнозировало нормальный исход нервного развития (19).
Гипоксия приводит к усилению эритропоэза и выбросу незрелых ядерных эритроцитов (nRBC) в кровоток (20).ЯРБК пуповинной крови были значительно выше у новорожденных с асфиксией по сравнению с контрольной группой, а также коррелировали с апгаром через 1 мин, pH и развитием NE (20). Количество ядерных эритроцитов на 100 лейкоцитов было выше у новорожденных с НЭ по сравнению с контрольной группой, младенцев с НЭ средней / тяжелой степени по сравнению с легкой ( p = 0,016) и у новорожденных с плохим исходом нервного развития ( p = 0,03) ( 21). Следовательно, стандартизованное измерение воздействия клинической гипоксии было бы полезным с использованием комбинации этих маркеров и могло бы помочь в определении времени инсульта и корреляции с доклиническими моделями на животных.
Инфекция
Риск спастического церебрального паралича (ДЦП) и квадриплегического ДЦП повышался при сочетании инфекции и асфиксии (22). Уровни интерлейкина (ИЛ) -6 через 6 часов связаны с отклонениями от нормы неврологического обследования (23). NE, инотропная поддержка, судороги без менингита, потребность в интубации и более низкий 5-минутный апгар были более вероятны у новорожденных с ХП при наличии инфекции у матери по сравнению с ХП без инфекции (22).
Инфекции матери и новорожденные с ранним началом представляют собой диагностическую проблему.Ведутся споры о том, может ли оккультная инфекция, не обнаруживаемая обычными методами культивирования, быть связана с неврологическим повреждением во всех возрастных группах. Полимеразная цепная реакция (ПЦР) выявила 11 случаев бактериемии у энцефалопатических новорожденных в Африке, у которых был отрицательный посев крови (NE n = 201). ПЦР в сочетании с посевом крови привела к обнаружению бактериальных продуктов в 8,9% случаев NE по сравнению с 3,1% при использовании одного посева крови (24). В метаанализе стрептококк группы B (GBS) был связан с NE в 0.58% случаев и смертность были выше при использовании СГБ плюс НЭ по сравнению с одним НЭ (25). В когорте из 45 новорожденных 40% имели хориоамнионит и 11% имели как дозорные события, так и хориоамнионит (10).
Терапевтическая гипотермия задерживает рост и пик ответа с-реактивного белка (СРБ), а также приводит к снижению количества лейкоцитов и нейтрофилов по сравнению с нормотермными новорожденными (26). Это влияние гипотермии на задержку эволюции естественных воспалительных маркеров следует учитывать при выборе лечения антибиотиками и продолжительности лечения новорожденных с НЭ.
Следовательно, полное обследование на сепсис необходимо всем детям с NE. Стандартных рекомендаций по выполнению люмбальной пункции во всех случаях NE не существует, и их можно выбирать в каждом конкретном случае. Кандидатами могут быть младенцы с повышенным WCC и CRP или факторами риска септического риска. Также существуют технические и практические проблемы для поясничной пункции у младенцев с НЭ, которые являются ригидными из-за ТГ, а также часто изначально имеют отек мозга на УЗИ черепа.
Аномалии плаценты
Поражение пуповины, хориоамнионит, васкулит плода, меконий хориональной пластинки и тромботическая васкулопатия плода часто встречались в плацентарных поражениях у пациентов с NE ( n = 23) (27).Поражения плаценты, указывающие на тромбоз и снижение фетоплацентарного кровотока, являются значимыми и независимыми факторами риска НЭ ( n = 93) (28). Наличие более одного поражения плаценты увеличивает вероятность НЭ, но не было корреляции между патологией плаценты и характером повреждения на МРТ ( n = 56) (29). Аномальная патология плаценты была обнаружена у 29% новорожденных с дозорными событиями и у 73% новорожденных без дозорных событий ( p = 0,0001), перенесших терапевтическую гипотермию (30).Воспалительные поражения плаценты чаще наблюдались у новорожденных без дозорных событий ( p = 0,002) (30). Хронический виллит был связан с повреждением базальных ганглиев (BGT), тогда как присутствие ядерных эритроцитов, снижение созревания плаценты и хронический виллит также приводили к повреждению белого вещества / водораздела вместе с вовлечением BGT ( n = 95) (31).
Доказательства связи хориоамнионита с НЭ разнообразны. Предполагается, что время инфицирования и степень воспалительного ответа могут привести либо к прекондиционированию, либо к сенсибилизации и могут вызвать либо защитный эффект, либо дальнейшее усиление перинатального повреждения головного мозга, соответственно (32).Этот эффект был продемонстрирован на животных моделях. Липополисахарид (ЛПС), вводимый за 4–6 ч до 20 и 50 мин воздействия HI, приводил к усилению травм головного мозга. Однако введение ЛПС за 24 часа до 50-минутного воздействия HI привело к значительному ослаблению травм головного мозга (32). КА обнаружена у 8 новорожденных с признаками перинатальной асфиксии (всего n = 23) (27). Младенцы с NE и TH имели более высокие шансы на наличие CA по сравнению с младенцами, которые не получали TH ( n = 98) (33).CA, васкулит и фунизит были связаны с NE степени I, виллитом с NE II и фунизитом с III степенью у 141 новорожденного с NE и 309 контрольных (29). CA была связана с более низким риском черепно-мозговой травмы и плохим когнитивным исходом по сравнению с не-CA (скорректированное OR 0,3; 95% CI 0,1–0,7, p = 0,004) у новорожденных с NE ( n = 258), хотя только У 20 новорожденных были гистологические доказательства СА. В той же когорте новорожденные с признаками сепсиса имели более высокие шансы травмирования водораздела и аномальных нейромоторных показателей, чем у новорожденных без каких-либо клинических признаков ( p = 0.007) (34). У 120 младенцев с сочетанием перинатального ацидоза, NE и хориоамнионита с ответом плода или без него и пятнистый / диффузный хронический виллит были независимо связаны с тяжестью NE (35). Единственным индивидуальным предиктором патологического исхода нервного развития через 22-24 месяца после терапии гипотермией был диффузный хронический виллит. Гистологическая CA имела низкую прогностическую ценность для развития энцефалопатии и смерти при NE ( n = 51) (36), но материнская лихорадка ( n = 336) во время родов была независимым фактором для NE (скорректированный OR 4.72, 95% ДИ 1,28–17,4) (37). Клинический хориоамнионит был связан с более высокими уровнями IL-6, IL-8 в пуповинной крови и регулировался активацией нормальных Т-клеток, экспрессируемых и секретируемых (RANTES) в NE ( n = 61). В когорте из 67 новорожденных с хориоамнионитом NE, независимо от того, были ли клинические или гистологические данные связаны со стойким метаболическим ацидозом, можно предсказать плохой неврологический исход (38).
Патология плаценты описывается как «черный ящик» беременности. Стандартизованная классификация результатов патологии плаценты важна для дальнейшего определения этиологии NE (39).
Нарушения обмена веществ
Нарушения обмена веществ являются редкими причинами NE, но их всегда следует учитывать. Врожденные нарушения метаболизма (ВЭМ) присутствуют в неонатальном периоде после нормального периода выздоровления и отсутствия признаков перинатальной асфиксии, но неврологические и полиорганные поражения могут проявляться как НЭ (40). Митохондриальные нарушения также являются важной причиной NE (41).
Амплитудная интегрированная электроэнцефалограмма (аЭЭГ) была аномальной у 27 новорожденных с ВЭМ, причем наиболее устойчивыми признаками были аномальная фоновая активность и судороги.Не было различий в аЭЭГ для энцефалопатии, связанной с IEM или NE, и дифференцировать можно было только на основании клинических подозрений (42). Единственное метаболическое расстройство с диагностической ЭЭГ — это некетотическая гиперглицинемия с первоначальным паттерном «подавление-всплеск», переходящим в гипсаритмию в раннем или среднем младенчестве и диагностируемое путем измерения уровня глицина в спинномозговой жидкости (42). Имеются также отдельные сообщения о случаях IEM, таких как дефицит сульфитоксидазы и цитохрома C, проявляющийся как NE (43, 44).
Результаты МРТмогут варьироваться в зависимости от типа врожденной ошибки метаболизма (ВЭМ) и могут варьироваться от поражения белого вещества до поражения глубоких серых ядер. Митохондриальные энцефалопатии имеют симметричное двустороннее распределение и изначально могут быть диагностированы как NE (45). Следует учитывать метаболические нарушения, если нет явных явлений во время родов, стойкий лактоацидоз и / или гипогликемия (45) и начато обследование. Различные паттерны повреждений на МРТ головного мозга могут помочь отличить метаболические нарушения от НЭ.Поражение Globus Pallidus часто встречается при IEM по сравнению с NE, хотя картина повреждения при дефиците сульфитоксидазы и дефиците фактора молибдена может имитировать NE (46).
Изолированные приступы связаны с такими расстройствами, как: судороги, связанные с пиридоксином, некетотическая гиперглицинемия (НКГ), дефицит дигидропиримидиндегидрогеназы, дефицит сульфитоксидазы (изолированный или как часть дефицита кофактора молибдена), 4-аминобутират аминотрансферазы (ГАМК). дефицит, судороги, связанные с фолиевой кислотой, дефицит 3-фосфоглицератдегидрогеназы, дефицит гуанидиноацетатметилтрансферазы (GAMT) и дефицит переносчика глюкозы (GLUT-1).У младенцев с полиорганными поражениями, судорогами, метаболическим ацидозом, молочной железой, гипераммониемией могут быть: органическая ацидемия, дефекты цикла мочевины, пероксисомальные нарушения (например, синдром Зеллвегера) или митохондриальные нарушения.
Подробный семейный анамнез для установления факторов риска, таких как родство родителей или ранее пораженный ребенок, важен, поскольку большинство врожденных нарушений метаболизма имеют аутосомно-рецессивное или материнское наследование. Базовые исследования, такие как электролиты, аммиак, сывороточные аминокислоты, лактат, ацилкарнитин и органическая кислота в моче, могут быть рассмотрены при NE (40).Есть проблемы с метаболическим тестированием, так как их может потребоваться повторить, если ребенок очень плохо себя чувствует с дисфункцией многих органов во время отбора образцов (46). Недавние исследования показали большой потенциал метаболомики как биомаркеров НЭ. Было показано, что содержание сукцината повышено у детей с НЭ, которые серьезно пострадали (47).
Тромбофилия и неонатальный инсульт
Асфиксия (в 4% случаев) участвует в патогенезе неонатального инсульта (48). Фокальные клонические приступы являются наиболее частым проявлением неонатального инсульта (49), и 6 младенцев с инсультом были обнаружены в когорте NE ( n = 124) (50).Эти дети обычно страдали судорогами и имели худшие исходы с точки зрения нервного развития, чем остальная часть когорты. Нарушения свертывания крови, такие как полицитемия, лейденский фактор V, нарушения гемоглобина и мутации протромбина, не были обнаружены у 4 из 6 обследованных пациентов (50).
На животных моделях повышенные уровни гомоцистеина приводили к увеличению провоспалительных цитокинов, таких как фактор некроза опухоли альфа (TNFα), интерлейкин 1 бета (IL-1β) и IL-6 в гиппокампе и коре головного мозга.Это провоспалительное состояние может быть ответственным за нейрональные и цереброваскулярные эффекты, наблюдаемые у взрослых (51). Роль гомоцистеина или полиморфизмов в гене метилентетрагидрофолатредуктазы в возникновении неонатального повреждения головного мозга неясна (52). В когорте из 118 новорожденных с НЭ повреждение белого вещества / водораздела с большей вероятностью было связано с гипогликемией, полиморфизмом метилентетрагидрофолатредуктазы (MTHFR) и уровнями гомоцистеина в плазме в верхнем квартиле нормы (52).
Генетические и эпигенетические аномалии
Отсутствуют опубликованные данные, связывающие генетическую предрасположенность к развитию NE. У 40 пациентов с NE генетическая изменчивость протромбических факторов, таких как протромбин G20210A, фактор V Leiden G1691A и метилентетрагидрофолатредуктаза [MTHFR] C677T, и ген фактора некроза опухоли не повлияли на классификацию NE, ЭЭГ, смерть, УЗИ черепа (США) , неврологический исход при выписке через 6 и 12 месяцев. Полиморфизм гена интерлейкина-6 (IL-6 174GC) имел защитный эффект и был связан с нормальной ЭЭГ, краниальным УЗИ и неврологическим обследованием при выписке (53).В ретроспективном исследовании «случай-контроль» с участием 11 новорожденных с НЭ у матерей была обнаружена более высокая частота полиморфизма MTHFR (7 гомозиготных и 4 гетерозиготных) по сравнению с контрольной группой (54). Генетический полиморфизм может увеличивать риск или тяжесть неонатального повреждения головного мозга при NE, и его следует учитывать (53).
Продольное исследование родителей и детей, проведенное Avon с участием 7611 доношенных детей, было генотипировано, и мерами воздействия было наличие одного или нескольких минорных аллелей в одном из 3 SNP (rs2284411, rs2498804, rs1835740).Первичным результатом была необходимость в реанимации при рождении, что было связано с rs1835740 (55). Требуются более крупные международные совместные исследования для определения необходимого количества пациентов для изучения генетических связей и разделения пациентов по этиологии.
Еще одна категория младенцев с генетической причиной неонатальной энцефалопатии — это дети с миопатиями и энцефалопатиями новорожденных. Пациенты, унаследовавшие миопатию (центронуклеарную миопатию), могут иметь неонатальный дистресс, гипотонию и признаки, указывающие на ГИЭ (56).Врожденная миотоническая дистрофия 1 типа характеризуется гипотонией и тяжелой генерализованной слабостью при рождении, часто с дыхательной недостаточностью, умственной отсталостью и ранней смертью. Это вызвано экспансией тринуклеотидного повтора CTG в некодирующей области DMPK .
В будущем подробное генотипирование, включая более легкий доступ к методам микроматрицы в клинических условиях, предоставит больше информации, чтобы позволить индивидуальный уход и потенциально классифицировать младенцев по генотипу.
Нейровизуализация
На МРТ можно увидеть разные модели травм, но это не исключает HIE как причины травмы. Характер повреждения зависит от тяжести, продолжительности и повторяемости гипоксической ишемии и может привести к поражению базальных ганглиев, таламуса, ствола мозга и / или белого вещества головного мозга в различных сочетаниях (1). При глубокой гипоксии преобладает повреждение более глубоких серых структур, то есть базальных ганглиев и таламуса. Это объясняется тем, что эти участки миелинизированы и имеют более высокую скорость метаболизма.Состояния, которые уменьшают, а не вызывают полное прекращение кровотока, такие как анемия и гиповолемия, связаны с повреждением коры головного мозга и сохранением более глубоких серых структур (57). В когорте из 245 пациентов с NE 197 (80%) результаты МРТ соответствовали острому перинатальному инсульту. МРТ у 40 младенцев (16%) были нормальными. У 9 младенцев (4%) помимо гипоксического ишемического инсульта на МРТ были выявлены признаки тромбоза / инфаркта, генетических нарушений, антенатального инсульта и митохондрий (дефицит комплекса I).Нейровизуализация у 8 (3%) младенцев с клиническим диагнозом NE показала либо врожденную ошибку метаболизма, нервно-мышечное расстройство, либо отсутствие диагноза, и эти результаты не соответствовали гипоксической ишемии (48). Плацентарный виллит высокой степени неизвестной этиологии ( n = 4) был обнаружен в когорте из 36 пациентов, связанных с повреждением белого вещества, вторичным по отношению к воспалению / окислительному стрессу в перинатальном периоде (58).
Значение для терапии
Не все младенцы с НЭ могут получить одинаковую пользу от гипотермии.Следовательно, выявление точной этиологии в каждом случае NE имеет значение для лечения, так как есть некоторые излечимые причины, которые требуют быстрого определения для оптимального лечения. Использование бактериальной ПЦР для выявления инфекции у новорожденных с NE может быть более полезным, чем только посев крови с низким выходом бактерий, а также гипотермия может уменьшить воспалительную реакцию. Гистология плаценты отражает внутриматочную среду и может прояснить основную этиологию. Все новорожденные с риском IEM должны быть обследованы на предмет метаболических нарушений, так как этим пациентам могут быть полезны специфические методы лечения, а не гипотермия.Аналогичным образом скрининг на тромбофилию следует рассматривать у пациентов из группы риска, таких как пациенты с инсультом, семейный анамнез тромбофилии. Подробная оценка этиологии NE важна для выявления излечимых причин и категоризации этой гетерогенной группы новорожденных, чтобы можно было подобрать соответствующее лечение в соответствии с этиологией и улучшением отдаленных результатов. Точно так же будет полезно разделить большие многоцентровые когорты младенцев с NE по этиологии, чтобы полностью понять этиологию, реакцию на лечение гипотермией и отдаленные результаты.
Взносы авторов
SA: основной автор; ТС: помогал с поиском соответствующих статей и рисунка; ЭМ: автор-руководитель.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2. Шах П., Рип Хаген С., Бейен Дж., Перлман М. Мультиорганная дисфункция у младенцев с постасфиксиальной гипоксически-ишемической энцефалопатией. Arch Dis Child Fetal Neonatal Ed . (2004) 89: F152 – F155. DOI: 10.1136 / ADC.2002.023093
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Куринчук Дж. Дж., Уайт-Конинг М., Бадави Н. Эпидемиология неонатальной энцефалопатии и гипоксически-ишемической энцефалопатии. Ранний Хум Дев . (2010) 86: 329–38. DOI: 10.1016 / j.earlhumdev.2010.05.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Джейкобс С.Е., Берг М., Хант Р., Тарнов-Морди В.О., Индер Т.Э., Дэвис П.Г.Охлаждение новорожденных с гипоксической ишемической энцефалопатией. База данных Cochr Syst Rev . (2013) 1: CD003311 DOI: 10.1002 / 14651858.CD003311.pub3
CrossRef Полный текст | Google Scholar
5. Нельсон К. Б., Бингхэм П., Эдвардс Э. М., Хорбар Д. Д., Кенни М. Дж., Индер Т. и др. Антецеденты неонатальной энцефалопатии в реестре энцефалопатии Оксфордской сети Вермонта. Педиатрия . (2012) 130: 878–86. DOI: 10.1542 / peds.2012-0714
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Dammann O, Ferriero D, Gressens P. Неонатальная энцефалопатия или гипоксически-ишемическая энцефалопатия? Соответствующая терминология имеет значение Pediatr Res . (2011) 70: 1-2. DOI: 10.1203 / PDR.0b013e318223f38d
CrossRef Полный текст | Google Scholar
8. Бадави Н., Куринчук Дж. Дж., Кио Дж. М., Алессандри Л. М., О’Салливан Ф., Бертон П. Р. и др. Факторы дородового риска энцефалопатии новорожденных: исследование случай-контроль в Западной Австралии. BMJ . (1998) 317: 1549–53. DOI: 10.1136 / bmj.317.7172.1549
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Бадави Н., Куринчук Дж. Дж., Кио Дж. М., Алессандри Л. М., О’Салливан Ф., Бертон П. Р. и др. Факторы риска внутриутробной энцефалопатии новорожденных: исследование случай-контроль в Западной Австралии. BMJ . (1998) 317: 1554–8. DOI: 10.1136 / bmj.317.7172.1554
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Паркер SJ, Kuzniewicz M, Niki H, Wu YW. Факторы дородового и внутриродового риска гипоксически-ишемической энцефалопатии в когорте новорожденных в США. Дж. Педиатр . (2018) 203: 163–9. DOI: 10.1016 / j.jpeds.2018.08.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Адамсон С.Дж., Алессандри Л.М., Бадави Н., Бертон П.Р., Пембертон П.Дж., Стэнли Ф. Предикторы неонатальной энцефалопатии у доношенных детей. BMJ . (1995) 311: 598–602 DOI: 10.1136 / bmj.311.7005.598
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Мартинес-Биарге М., Диез-Себастьян Дж., Вустхофф С.Дж., Меркури Е., Коуэн FM.Дородовые и внутриродовые факторы, предшествующие неонатальной гипоксически-ишемической энцефалопатии. Педиатрия . (2013) 132: e952 – e959 doi: 10.1542 / peds.2013-0511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Торбенсон В.Е., Толчер М.К., Несбитт К.М., Колби К.Э., Эль-Нашар С.А., Гостоут Б.С. и др. Внутриродовые факторы, связанные с неонатальной гипоксической ишемической энцефалопатией: исследование случай-контроль. BMC Беременность и роды . (2017) 17: 415 DOI: 10.1186 / s12884-017-1610-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Резерфорд М., Маламатениу С., МакГиннесс А., Оллсоп Дж., Биардж М.М., Конселл С. Магнитно-резонансная томография при гипоксически-ишемической энцефалопатии. Ранний Хум Дев . (2010) 86: 351–60. DOI: 10.1016 / j.earlhumdev.2010.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Окереафор А., Оллсоп Дж., Конселл С.Дж., Фицпатрик Дж., Аззопарди Д., Резерфорд М.А. и др. Модели травм головного мозга у новорожденных, подвергшихся перинатальным дозорным событиям. Педиатрия .(2008) 121: 906–14. DOI: 10.1542 / педс.2007-0770
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Метцлер М., Говиндан Р., Аль-Шаргаби Т., Везина Г., Андескавадж Н., Ван И и др. Особенности черепно-мозговой травмы и снижения вариабельности сердечного ритма у новорожденных с гипоксической ишемической энцефалопатией. Педиатр Рес . (2017) 82: 438–43. DOI: 10.1038 / pr.2017.94
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Симович А.М., Игрутинович З., Обрадович С., Ристич Д., Вулетич Б., Раданович М.Значение сердечного тропонина I второго поколения в раннем скрининге гипоксически-ишемической энцефалопатии после перинатальной асфиксии. SRP Arh Celok Lek . (2012) 140: 600–5.
PubMed Аннотация | Google Scholar
18. Шастри А.Т., Самарасекара С., Мунираман Х., Кларк П. Концентрации сердечного тропонина I у новорожденных с гипоксически-ишемической энцефалопатией. Акта Педиатр . (2012) 101: 26–9. DOI: 10.1111 / j.1651-2227.2011.02432.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Лю X, Chakkarapani E, Stone J, Thoresen M. Влияние компрессий сердца и лечения гипотермии на сердечный тропонин I у новорожденных с перинатальной асфиксией. Реанимация . (2013) 84: 1562–7. DOI: 10.1016 / j.resuscitation.2013.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Гош Б., Миттал С., Кумар С., Дадхвал В. Прогнозирование перинатальной асфиксии с ядросодержащими эритроцитами в пуповинной крови новорожденных. Int J Gynaecol Obstet .(2003) 81: 267–71. DOI: 10.1016 / S0020-7292 (03) 00124-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Уолш Б.Х., Бойлан Г.Б., Мюррей Д.М. Ядерные эритроциты и ранняя ЭЭГ: прогнозирование стадии Сарната и двухлетнего исхода. Ранний Хум Дев . (2011) 87: 335–9. DOI: 10.1016 / j.earlhumdev.2011.01.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Нельсон К. Б., Гретер Дж. К.. Возможное удушье и спастический церебральный паралич у младенцев с нормальной массой тела при рождении. Ам Дж. Обстет Гинеколь . (1998) 179: 507–13. DOI: 10.1016 / S0002-9378 (98) 70387-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Shalak LF, Laptook AR, Jafri HS, Ramilo O, Perlman JM. Клинический хориоамнионит, повышенные цитокины и травмы головного мозга у доношенных детей. Педиатрия . (2002) 110: 673–80. DOI: 10.1542 / педс.110.4.673
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Танн CJ, Nkurunziza P, Nakakeeto M, Oweka J, Kurinczuk JJ, Were J, et al.Распространенность патогенов кровотока выше в случаях неонатальной энцефалопатии по сравнению с контрольной группой, использующей новую панель ПЦР-анализов в реальном времени. PLOS ONE . (2014) 9: e97259. DOI: 10.1371 / journal.pone.0097259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Танн С.Дж., Мартинелло К.А., Саду С., Лоун Дж.Э., Сил А.С., Вега-Поблете М. и др. Группа исследователей неонатальной энцефалопатии GBS. неонатальная энцефалопатия со стрептококками группы b во всем мире: систематический обзор, наборы данных исследовательских групп и метаанализ. Клин Инфекция Дис . (2017) 65 (Suppl_2): S173–89. DOI: 10.1093 / cid / cix662
CrossRef Полный текст | Google Scholar
26. Chakkarapani E, Davis J, Thoresen M. Терапевтическая гипотермия задерживает ответ C-реактивного белка и подавляет количество лейкоцитов и тромбоцитов у младенцев с неонатальной энцефалопатией. Arch Dis Child Fetal Neonatal Ed . (2014) 99: F458 – F463. DOI: 10.1136 / archdischild-2013-305763
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Wintermark P, Boyd T, Gregas MC, Labrecque M, Hansen A. Патология плаценты у новорожденных с асфиксией, отвечающих критериям терапевтической гипотермии. Ам Дж. Обстет Гинеколь . (2010) 203: 579.e1–9. DOI: 10.1016 / j.ajog.2010.08.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Макдональд Д.Г., Келехан П., Макменамин Дж. Б., Горман В. А., Мэдден Д., Тоббия И. Н. и др. Плацентарная тромботическая васкулопатия плода связана с неонатальной энцефалопатией. Хум Патол .(2004) 35: 875–80 DOI: 10.1016 / j.humpath.2004.02.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Хейс BC, Кули С., Доннелли Дж., Доэрти Е., Грехан А., Мэдиган С. и др. Плацента у младенцев> 36 недель беременности с неонатальной энцефалопатией: исследование случай-контроль. Arch Dis Child Fetal Neonatal Ed . (2013) 98: F233–9. DOI: 10.1136 / archdischild-2012-301992
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Чанг Т., Рейес Т.Дж., Пласетек Дж., Массаро А.Н., Нельсон КБ. Неонатальная энцефалопатия, дозорные явления и плацента. J Неонатальная перинатальная медицина . (2012) 5: 41–8. DOI: 10.3233 / NPM-2012-54211
CrossRef Полный текст | Google Scholar
31. Хартеман Дж. К., Никкельс П. Г., Бендерс М. Дж., Кви А., Грюнендал Ф., де Фрис Л. С.. Патология плаценты у доношенных детей с гипоксически-ишемической неонатальной энцефалопатией и ассоциация с магнитно-резонансной томографией повреждения головного мозга. Дж. Педиатр .(2013) 163: 968–995 DOI: 10.1016 / j.jpeds.2013.06.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Эклинд С., Маллард С., Арвидссон П., Хагберг Х. Липополисахарид вызывает как первичную, так и вторичную фазу сенсибилизации в развивающемся мозге крысы. Педиатр Рес . (2005) 58: 112–6 DOI: 10.1203 / 01.PDR.0000163513.03619.8D
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Нельсон Д.Б., Лаке А.М., Макинтайр Д.Д., Санчес П.Дж., Левено К.Дж., Чалак Л.Ф.Акушерские предшественники лечения новорожденного с помощью охлаждения тела. Am J Obstet Gynecol. (2014) 211: 155.e1–6. DOI: 10.1016 / j.ajog.2014.02.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Йенстер М., Бонифачо С.Л., Руэл Т., Роджерс Э.Е., Там Э.У., Партридж Дж.С. и др. Материнская или неонатальная инфекция: связь с исходами неонатальной энцефалопатии. Педиатр Рес . (2014) 76: 93–9. DOI: 10.1038 / pr.2014.47
CrossRef Полный текст | Google Scholar
35.Мир И.Н., Джонсон-Велч С.Ф., Нельсон Д.Б., Браун Л.С., Розенфельд С.Р., Чалак Л.Ф. Патология плаценты связана с тяжестью неонатальной энцефалопатии и неблагоприятными исходами развития после гипотермии. Ам Дж. Обстет Гинеколь . (2015) 213: 849.e1–7. DOI: 10.1016 / j.ajog.2015.09.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Шалак Л., Джонсон-Велч С., Перлман Дж. М.. Хориоамнионит и неонатальная энцефалопатия у доношенных детей с ацидемией плода: гистопатологические корреляции. Педиатр Нейрол . (2005) 33: 162–5. DOI: 10.1016 / j.pediatrneurol.2005.04.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Импи Л., Гринвуд К., МакКвиллан К., Рейнольдс М., Шейл О. Лихорадка в родах и неонатальная энцефалопатия: проспективное когортное исследование. БЖОГ . (2001) 108: 594–7. DOI: 10.1111 / j.1471-0528.2001.00145.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Джонсон, CT, Бурд I, Рагхунатан Р., Нортингтон Ф.Дж., Грэм Э.М.Перинатальное воспаление / инфекция и его связь с коррекцией метаболического ацидоза при гипоксически-ишемической энцефалопатии. Дж Перинатол . (2016) 36: 448–52. DOI: 10.1038 / jp.2015.221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Кларк П., Мунираман Х., Гарднер Д., Венкатеш В., Керли А., Виктор С. и др. Исследование неонатальной энцефалопатии: часто теряемый плацентарный «черный ящик». Педиатр Дев Патол . (2015) 18: 343–4. DOI: 10.2350 / 15-02-1611-LET.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Tan ES. Врожденные нарушения обмена веществ, проявляющиеся как неонатальная энцефалопатия: практические советы врачам. Энн Акад Мед Сингапур . (2008) 37 (12 Suppl.): 94–3.
PubMed Аннотация | Google Scholar
42. Олишар М., Шани Э., Айгюн С., Аззопарди Д., Хант Р.В., Тоет М.С. и др. Амплитудно-интегральная электроэнцефалография у новорожденных с врожденными нарушениями обмена веществ. Неонатология .(2012) 102: 203–11. DOI: 10.1159 / 000339567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Hobson EE, Thomas S, Crofton PM, Murray AD, Dean JC, Lloyd D. Изолированная недостаточность сульфитоксидазы имитирует признаки гипоксической ишемической энцефалопатии. евро J Педиатр . (2005) 164: 655–9. DOI: 10.1007 / s00431-005-1729-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Уиллис Т.А., Дэвидсон Дж., Грей Р.Г., Поултон К., Рамани П., Уайтхаус В.Дефицит цитохромоксидазы, проявляющийся в виде асфиксии при рождении. Дев Мед Детский Нейрол . (2000) 42: 414–7. DOI: 10.1017 / S0012162200000761
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Enns GM. Врожденные нарушения обмена веществ, маскирующиеся под гипоксически-ишемическую энцефалопатию. NeoReviews . (2005) 12: e549 – e558. DOI: 10.1542 / neo.6-12-e549
CrossRef Полный текст | Google Scholar
47. Уолш Б.Х., Бродхерст Д.И., Мандал Р., Вишарт Д.С., Бойлан Г.Б., Кенни Л.К. и др.Метаболомный профиль пуповинной крови при неонатальной гипоксической ишемической энцефалопатии. PLOS ONE . (2012) 7: e50520. DOI: 10.1371 / journal.pone.0050520
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Коуэн Ф., Резерфорд М., Грюнендал Ф., Экен П., Меркури Э., Байддер Г.М. и др. Происхождение и сроки поражения головного мозга у доношенных детей с неонатальной энцефалопатией. Ланцет . (2003) 361: 736–42 DOI: 10.1016 / S0140-6736 (03) 12658-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50.Рамасвами В., Миллер С.П., Баркович А.Дж., Партридж Дж.С., Ферриеро Д.М. Перинатальный инсульт у доношенных детей с неонатальной энцефалопатией. Неврология . (2004) 62: 2088–91. DOI: 10.1212 / 01.WNL.0000129909.77753.C4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Scherer EB, Loureiro SO, Vuaden FC, da Cunha AA, Schmitz F, Kolling J, et al. Легкая гипергомоцистеинемия увеличивает уровни ацетилхолинэстеразы мозга и провоспалительных цитокинов в различных тканях. Мол Нейробиол .(2014) 50: 589–96. DOI: 10.1007 / s12035-014-8660-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Хартеман Дж. С., Грюнендал Ф., Бендерс М. Дж., Хейсман А., Блом Х. Дж., Де Фрис Л. С.. Роль тромбофильных факторов у доношенных детей с неонатальной энцефалопатией. Педиатр Рес . (2013) 73: 80–6. DOI: 10.1038 / pr.2012.150
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Цалкавур С., Акису М., Олюкман О., Балим З., Бердели А., Чакмак Б. и др.Генетические факторы, влияющие на краткосрочный исход развития нервной системы у доношенных новорожденных с гипоксически-ишемической энцефалопатией. J Int Med Res . (2011) 39: 1744–56. DOI: 10.1177 / 1473230011037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Додельсон де Кремер Р., Гроссо С. Материнская мутация 677C> T в гене метилентетрагидрофолатредуктазы, связанная с тяжелым повреждением головного мозга у потомства. Клин Генет . (2005) 67: 69–80.
PubMed Аннотация | Google Scholar
55.Odd D, Váradi A, Rajatileka S, Molnár E, Luyt K. Связь между неонатальной реанимацией и однонуклеотидным полиморфизмом rs1835740. Акта Педиатр . (2016) 105: e307–12. DOI: 10.1111 / apa.13421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Bruyland M, Liebaers I, Sacre L, Vandeplas Y, De Meirleir L, Martin JJ. Неонатальная миотубулярная миопатия с вероятным X-сцепленным наследованием: наблюдения за новой семьей с обзором литературы. Дж. Neurol . (1984) 231: 220–2. DOI: 10.1007 / BF00313942
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Баркович А.Дж., Вестмарк К., Партридж К., Сола А., Ферриеро Д.М. Перинатальная асфиксия: результаты МРТ в первые 10 дней. AJNR Am J Нейрорадиол . (1995) 16: 427–38.
PubMed Аннотация | Google Scholar
58. Барретт М.Дж., Донохью В., Муни Е.Е., Слевин М., Персо Т., Туми Е. и др. Изолированное острое некистозное повреждение белого вещества у доношенных детей с неонатальной энцефалопатией. Arch Dis Child Fetal Neonatal Ed . (2013) 98: F158 – F160. DOI: 10.1136 / archdischild-2011-301505
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пятьдесят лет визуализации мозга при неонатальной энцефалопатии после перинатальной асфиксии
Windle WF. Неврологический и психологический дефицит от асфиксии новорожденных. Представитель общественного здравоохранения 1957; 72 : 646–50.
CAS Статья Google ученый
Ранк Дж. Б. Младший, Виндл ВФ.Повреждение мозга у обезьяны macaca mulatta, вызванное асфиксией новорожденных. Exp Neurol 1959; 1 : 130–54.
Артикул Google ученый
Myers RE. Две модели перинатального повреждения головного мозга и условия их возникновения. Am J Obstet Gynecol 1972; 112 : 246–76.
CAS Статья Google ученый
Squier W. Приобретенное повреждение развивающегося мозга: время и причина . Оксфорд, Великобритания: Издательство Оксфордского университета; 2002.
Google ученый
Volpe JJ. Неврология новорожденных . Филадельфия: Книжная компания Сондерса; 2008.
Google ученый
Вольпе Дж. Дж., Пастернак Дж. Ф. Парасагиттальное повреждение головного мозга при неонатальной гипоксически-ишемической энцефалопатии: клинические и нейрорадиологические особенности. J Pediatr 1977; 91 : 472–6.
CAS Статья Google ученый
Volpe JJ, Herscovitch P, Perlman JM, Kreusser KL, Raichle ME. Позитронно-эмиссионная томография у доношенных новорожденных с асфиксией: парасагиттальные нарушения мозгового кровотока. Ann Neurol 1985; 17 : 287–96.
CAS Статья Google ученый
Lou HC, Lassen NA, Friis-Hansen B.Нарушение ауторегуляции церебрального кровотока у новорожденного в тяжелом состоянии. J Pediatr 1979; 94 : 118–21.
CAS Статья Google ученый
Бленнов М., Ингвар М., Лагеркранц Х. и др. Ранняя [ 18 F] ФДГ позитронно-эмиссионная томография у младенцев с гипоксически-ишемической энцефалопатией показывает гиперметаболизм в постасфиктический период. Acta Paediatr 1995; 84 : 1289–95.
CAS Статья Google ученый
Thorngren-Jerneck K, Ohlsson T, Sandell A, et al. Церебральный метаболизм глюкозы, измеренный с помощью позитронно-эмиссионной томографии у доношенных новорожденных с гипоксической ишемической энцефалопатией. Pediatr Res 2001; 49 : 495–501.
CAS Статья Google ученый
Табоада Д., Алонсо А, Олагуэ Р., Мулас Ф., Андрес В.Рентгенологическая диагностика перивентрикулярной и подкорковой лейкомаляции. Нейрорадиол 1980; 20 : 33–41.
CAS Статья Google ученый
Flodmark O, Becker LE, Harwood-Nash DC, Fitzhardinge PM, Fitz CR, Chuang SH. Корреляция между компьютерной томографией и аутопсией у недоношенных и доношенных новорожденных, перенесших перинатальную асфиксию. Радиология 1980; 137 (1 Pt 1): 93–103.
CAS Статья Google ученый
Voorhies TM, Lipper EG, Lee BC, Vannucci RC, Auld PA. Окклюзионные сосудистые заболевания у новорожденных с асфиксией. J Pediatr 1984; 105 : 92–6.
CAS Статья Google ученый
Чау В., Поскитт К.Дж., Сарджент М.А. и др. Сравнение компьютерной томографии и магнитно-резонансной томографии на третий день жизни доношенных новорожденных с неонатальной энцефалопатией. Педиатрия 2009; 123 : 319–26.
Артикул Google ученый
Barnette AR, Horbar JD, Soll RF, et al. Нейровизуализация в оценке неонатальной энцефалопатии. Педиатрия 2014; 133 : e1508–17.
Артикул Google ученый
Babcock DS, Ball W Jr. Постасфиксиальная энцефалопатия у доношенных детей: ультразвуковая диагностика. Радиология 1983; 148 : 417–23.
CAS Статья Google ученый
Сигел М.Дж., Шакелфорд Г.Д., Перлман Дж.М., Фуллинг К.Х. Гипоксико-ишемическая энцефалопатия у доношенных детей: диагностика и прогноз с помощью УЗИ. Радиология 1984; 152 : 395–9.
CAS Статья Google ученый
Резерфорд М.А., Пеннок Дж. М., Дубовиц Л. М..Ультразвуковое исследование черепа и магнитно-резонансная томография при гипоксически-ишемической энцефалопатии: сравнение с исходом. Dev Med Child Neurol 1994; 36 : 813–25.
CAS Статья Google ученый
Арчер Л.Н., Левен Мичиган, Эванс Д.Х. Допплерография церебральной артерии для прогнозирования исхода перинатальной асфиксии. Lancet 1986; 2 : 1116–8.
CAS Статья Google ученый
Eken P, Toet MC, Groenendaal F, de Vries LS.Прогностическая ценность ранней нейровизуализации, импульсной допплерографии и нейрофизиологии у доношенных детей с гипоксически-ишемической энцефалопатией. Arch Dis Child Fetal Neonatal Ed 1995; 73 : F75–80.
CAS Статья Google ученый
Eken P, Jansen GH, Groenendaal F, Rademaker KJ, de Vries LS. Внутричерепные поражения у доношенных новорожденных с гипоксической ишемической энцефалопатией: корреляция УЗИ и аутопсии. Neuropediatrics 1994; 25 : 301–7.
CAS Статья Google ученый
Эпельман М., Данеман А., Холлидей В., Уайт Х., Блазер С.И. Аномальное мозолистое тело у новорожденных после гипоксически-ишемического повреждения. Pediatr Radiol 2012; 42 : 321–30.
Артикул Google ученый
Динан Д., Данеман А., Гимарайнш К.В., Шовен Н.А., Виктория Т., Эпельман М.Легко упускаемые из виду результаты сонографии при оценке неонатальной энцефалопатии: уроки, извлеченные из магнитно-резонансной томографии. Semin Ultrasound CT MR 2014; 35 : 627–51.
Артикул Google ученый
de Vries LS, Cowan FM. Развитие понимания гипоксически-ишемической энцефалопатии у доношенных детей. Semin Pediatr Neurol 2009; 16 : 216–25.
Артикул Google ученый
De Vries LS, Smet M, Goemans N, Wilms G, Devlieger H, Casaer P.Одностороннее таламическое кровотечение у недоношенных и доношенных новорожденных. Neuropediatrics 1992; 23 : 153–6.
CAS Статья Google ученый
Govaert P, Achten E, Vanhaesebrouck P, De Praeter C., Van Damme J. Тромбоз глубоких церебральных вен при таламо-желудочковом кровотечении у доношенного новорожденного. Pediatr Radiol 1992; 22 : 123–7.
CAS Статья Google ученый
de Vries LS, Groenendaal F, Eken P, van Haastert IC, Rademaker KJ, Meiners LC.Инфаркты в сосудистом распределении средней мозговой артерии у недоношенных и доношенных детей. Neuropediatrics 1997; 28 : 88–96.
CAS Статья Google ученый
Cowan F, Mercuri E, Groenendaal F, et al. Выявляет ли краниальное ультразвуковое исследование инфаркт мозга у доношенных новорожденных? Arch Dis Child Fetal Neonatal Ed 2005; 90 : F252–6.
CAS Статья Google ученый
Баркович А.Ю., Трувит КЛ.Повреждение головного мозга от перинатальной асфиксии: корреляция результатов МРТ с гестационным возрастом. AJNR Am J Neuroradiol 1990; 11 : 1087–96.
CAS PubMed Google ученый
Пастернак Ю.Ф., Предей Т.А., Михаил М.А. Неонатальная асфиксия: уязвимость базальных ганглиев, таламуса и ствола мозга. Pediatr Neurol 1991; 7 : 147–9.
CAS Статья Google ученый
Баркович А.Дж., Вестмарк К., Партридж С., Сола А., Ферриеро Д.М.Перинатальная асфиксия: результаты МРТ в первые 10 дней. AJNR Am J Neuroradiol 1995; 16 : 427–38.
CAS PubMed Google ученый
Резерфорд М.А., Пеннок Дж. М., Конселл С. Дж. И др. Аномальный сигнал магнитного резонанса во внутренней капсуле предсказывает плохой исход развития нервной системы у младенцев с гипоксически-ишемической энцефалопатией. Педиатрия 1998; 102 (2 Pt 1): 323–8.
CAS Статья Google ученый
Cowan FM, Pennock JM, Hanrahan JD, Manji KP, Edwards AD.Раннее выявление инфаркта мозга и гипоксической ишемической энцефалопатии у новорожденных с помощью диффузно-взвешенной магнитно-резонансной томографии. Neuropediatrics 1994; 25 : 172–5.
CAS Статья Google ученый
Робертсон Р.Л., Бен-Сира Л., Барнс П.Д. и др. МРТ-сканирование с диффузионно-взвешенной визуализацией доношенных новорожденных с перинатальной ишемией головного мозга. AJNR Am J Neuroradiol 1999; 20 : 1658–70.
CAS PubMed Google ученый
Alderliesten T, de Vries LS, Benders MJ, Koopman C, Groenendaal F. МРТ и исход доношенных новорожденных с перинатальной асфиксией: значение диффузионно-взвешенной МРТ и ¹H МР-спектроскопии. Радиология 2011; 261 : 235–42.
Артикул Google ученый
Резерфорд М., Конселл С., Оллсоп Дж. И др.Диффузионно-взвешенная магнитно-резонансная томография при перинатальном повреждении головного мозга: сравнение с местом поражения и временем от рождения. Педиатрия 2004; 114 : 1004–14.
Артикул Google ученый
Беднарек Н., Матур А., Индер Т., Уилкинсон Дж., Нил Дж., Шимони Дж. Влияние терапевтической гипотермии на диффузные изменения МРТ при неонатальной энцефалопатии. Неврология 2012; 78 : 1420–7.
CAS Статья Google ученый
McKinstry RC, Miller JH, Snyder AZ и др. Проспективное исследование повреждений головного мозга у новорожденных с помощью тензорной визуализации продольной диффузии. Неврология 2002; 59 : 824–33.
CAS Статья Google ученый
de Vries LS, Groenendaal F. Модели неонатального гипоксически-ишемического повреждения мозга. Нейрорадиология 2010; 52 : 555–66.
Артикул Google ученый
Миллер С.П., Рамасвами В., Михельсон Д. и др. Особенности повреждения головного мозга при доношенной неонатальной энцефалопатии. J Pediatr 2005; 146 : 453–60.
Артикул Google ученый
Cowan F, Rutherford M, Groenendaal F, et al. Происхождение и сроки поражения головного мозга у доношенных детей с неонатальной энцефалопатией. Lancet 2003; 361 : 736–42.
Артикул Google ученый
Shankaran S, McDonald SA, Laptook AR, et al .; Сеть неонатальных исследований Национального института здоровья детей и человеческого развития Юнис Кеннеди Шрайвер. Неонатальная магнитно-резонансная томография травмы головного мозга как биомаркер исходов в детском возрасте после испытания гипотермии при неонатальной гипоксически-ишемической энцефалопатии. J Pediatr 2015; 167 : 987–93.e3.
Артикул Google ученый
Портер Э.Дж., Конселл С.Дж., Эдвардс А.Д., Оллсоп Дж., Аззопарди Д. Пространственная статистика магнитно-резонансных изображений на основе трактов для оценки заболевания и эффектов лечения при перинатальной асфиксической энцефалопатии. Pediatr Res 2010; 68 : 205–9.
Артикул Google ученый
Розе Э., Бендерс М.Дж., Керсберген К.Дж. и др.Неонатальный DTI на раннем этапе после рождения позволяет прогнозировать двигательный исход у недоношенных детей с перивентрикулярным геморрагическим инфарктом. Pediatr Res 2015; 78 : 298–303.
Артикул Google ученый
Wyatt JS, Edwards AD, Azzopardi D, Reynolds EO. Магнитно-резонансная и ближняя инфракрасная спектроскопия для исследования перинатального гипоксически-ишемического повреждения мозга. Arch Dis Child 1989; 64 (7 Спец. №): 953–63.
CAS Статья Google ученый
Lorek A, Takei Y, Cady EB, et al. Отсроченная («вторичная») церебральная энергетическая недостаточность после острой гипоксии-ишемии у новорожденного поросенка: непрерывные 48-часовые исследования методом магнитно-резонансной спектроскопии фосфора. Pediatr Res 1994; 36 : 699–706.
CAS Статья Google ученый
Педен С.Дж., Резерфорд М.А., Сарджентони Дж., Кокс И.Дж., Брайант Д.Дж., Дубовиц Л.М.Протонная спектроскопия головного мозга новорожденных после гипоксически-ишемического повреждения. Dev Med Child Neurol 1993; 35 : 502–10.
CAS Статья Google ученый
Groenendaal F, Veenhoven RH, van der Grond J, Jansen GH, Witkamp TD, de Vries LS. Соотношения церебрального лактата и N-ацетиласпартата / холина у доношенных новорожденных после асфиксии продемонстрировали in vivo с помощью протонной магнитно-резонансной спектроскопии. Pediatr Res 1994; 35 : 148–51.
CAS Статья Google ученый
Тейил С., Чандрасекаран М., Тейлор А. и др. Церебральные магнитно-резонансные биомаркеры при неонатальной энцефалопатии: метаанализ. Педиатрия 2010; 125 : e382–95.
Артикул Google ученый
Ханрахан Д.Д., Кокс И.Дж., Эдвардс А.Д. и др.Стойкое повышение концентрации лактата в мозге после асфиксии при рождении. Pediatr Res 1998; 44 : 304–11.
CAS Статья Google ученый
Groenendaal F, van der Grond J, Witkamp TD, de Vries LS. Протонная магнитно-резонансная спектроскопическая визуализация при инсульте новорожденных. Neuropediatrics 1995; 26 : 243–8.
CAS Статья Google ученый
De Vis JB, Hendrikse J, Petersen ET, et al.МРТ перфузии с меткой артериальной крови и исходы у новорожденных с гипоксически-ишемической энцефалопатией. евро Радиол 2015; 25 : 113–21.
Артикул Google ученый
Винтермарк П. Травма и восстановление при перинатальной травме головного мозга: выводы из неинвазивной МРТ-визуализации перфузии. Семин Перинатол 2015; 39 : 124–9.
Артикул Google ученый
Cady EB, D’Souza PC, Penrice J, Lorek A.Оценка локальной температуры мозга с помощью in vivo 1 H магнитно-резонансной спектроскопии. Magn Reson Med 1995; 33 : 862–7.
CAS Статья Google ученый
Rueger MA, Schroeter M. In vivo визуализация эндогенных нервных стволовых клеток во взрослом мозге. World J Stem Cells 2015; 7 : 75–83.
Артикул Google ученый
Bunevicius A, Yuan H, Lin W.Потенциальная роль 18 F-FDG-PET в лечении пациентов с острым инсультом. Biomed Res Int 2013; 2013 : 634598.
Артикул Google ученый
Умеш Рудрапатна С., Велох Т., Бейруп К. и др. Может ли визуализация диффузного эксцесса улучшить чувствительность и специфичность обнаружения микроструктурных изменений в ткани мозга, хронически после экспериментального инсульта? Сравнение с визуализацией тензорной диффузии и гистологией.

 Проявляется в замедленном развитии, проблемах с речью, нарушении памяти, проблемах с вниманием и т.д.;
Проявляется в замедленном развитии, проблемах с речью, нарушении памяти, проблемах с вниманием и т.д.; Питание должно быть сбалансированным и согласовываться с врачом — во избежание возникновения пищевой аллергии и расстройств органов пищеварения;
Питание должно быть сбалансированным и согласовываться с врачом — во избежание возникновения пищевой аллергии и расстройств органов пищеварения;
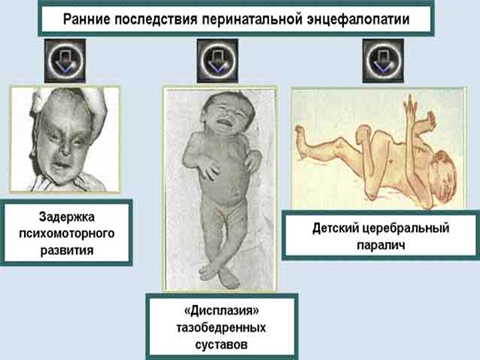 Это могут быть как частые простуды, так и периодические недомогания, связанные с плохим самочувствием, повышенной утомляемостью, головными болями и т.д.;
Это могут быть как частые простуды, так и периодические недомогания, связанные с плохим самочувствием, повышенной утомляемостью, головными болями и т.д.; Обычно эти нарушения неизменно влекут за собой другие заболевания, так как из-за нарушенного кровотока различные участки организма начинают недополучать кислород, что приводит к гибели клеток и дисфункции.
Обычно эти нарушения неизменно влекут за собой другие заболевания, так как из-за нарушенного кровотока различные участки организма начинают недополучать кислород, что приводит к гибели клеток и дисфункции.




 Когда кровоток к частям мозга прекращается, клетки начинают разрушаться, умирать и выделять вещества, токсичные для других клеток.Затем эти клетки начинают отмирать и продолжают цепную реакцию, которая вызывает повреждение головного мозга в течение нескольких часов или дней. Разрушить эту цепную реакцию может терапевтическое переохлаждение.
Когда кровоток к частям мозга прекращается, клетки начинают разрушаться, умирать и выделять вещества, токсичные для других клеток.Затем эти клетки начинают отмирать и продолжают цепную реакцию, которая вызывает повреждение головного мозга в течение нескольких часов или дней. Разрушить эту цепную реакцию может терапевтическое переохлаждение. Примеры проблем с плацентой и маткой, которые могут вызвать ГИЭ, включают:
Примеры проблем с плацентой и маткой, которые могут вызвать ГИЭ, включают: При необходимости это может включать экстренное кесарево сечение. Однако, если мониторинг носит спорадический характер или не проводится, важные признаки опасности могут быть упущены.
При необходимости это может включать экстренное кесарево сечение. Однако, если мониторинг носит спорадический характер или не проводится, важные признаки опасности могут быть упущены. К сожалению, эти лекарства также могут стать причиной того, что сокращения матки станут настолько сильными и частыми, что ребенок будет опасно лишен кислорода.
К сожалению, эти лекарства также могут стать причиной того, что сокращения матки станут настолько сильными и частыми, что ребенок будет опасно лишен кислорода.
